
- •Таврійський державний агротехнологічний університет
- •Змістовий модуль I. Неорганічна хімія
- •Тема 5. Гідроген. Хімія лужних металів. Хімія лужно - земельних елементів.
- •Змістовий модуль іі. Фізична та колоїдна хімія
- •Тема 14. Дисперсні системи та їх класифікація.
- •Тема 15. Мікрогетерогенні системи.
- •Тема 16. Напівколоїди та розчини високомолекулярних сполук.
- •Розподіл балів, що присвоюються студентам
- •Техніка безпеки та правила роботи в хімічній лабораторії Вимоги безпеки перед початком роботи
- •Вимоги безпеки під час роботи
- •Вимоги безпеки після закінчення роботи
- •Вимоги безпеки в аварійних ситуаціях
- •Розділ і. Неорганічна хімія Лабораторна робота №1. Класи неорганічних сполук
- •Вимоги до знань та умінь
- •Теоретична частина
- •Оксиди.
- •Кислоти.
- •Основи.
- •Амфоліти.
- •Паспорт роботи
- •Експериментальна частина Техніка безпеки.
- •Контрольні питання
- •Теоретична частина
- •Паспорт роботи
- •Результати оформлення роботи
- •Контрольні питання
- •Теоретична частина
- •Паспорт роботи
- •Результати оформлення роботи
- •Контрольні питання
- •ТермоХімія. Мета роботи – навчитися експериментально визначати ентальпію хімічних реакцій і робити розрахунки, використовуючи термохімічні рівняння.
- •Фактори, що визначають напрямок хімічних реакцій.
- •Паспорт роботи.
- •Експериментальна частина
- •Хід роботи.
- •Результати. Оформлення роботи.
- •Контрольні питання.
- •Рекомендована література
- •Лабораторна робота №5. Кінетика та швидкість хімічних реакцій
- •Вимоги до знань та умінь
- •Теоретична частина
- •Хімічна рівновага
- •Паспорт роботи
- •Експеріментальна частина
- •Контрольні питання
- •Рекомендована література
- •Лабораторна робота №6. Періодична система та періодичний закон д.І. Менделєєва
- •Вимоги до знань та умінь
- •Теоретична частина
- •Періодична система і будова атома.
- •Контрольні питання
- •Лабораторна робота №7. Властивості гідрогену та його сполук
- •Теоретична частина
- •Проста речовина
- •Практична частина Одержання та властивості Гідрогену. Окисно-відновні властивості Гідрогену.
- •Контрольні питання
- •Лабораторна робота №8. Властивості лужних металів.
- •Теоретична частина
- •Практична частина Властивості лужних металів та їх сполук.
- •Контрольні питання
- •Лабораторна робота №9. Властивості лужноземельних металів.
- •Теоретична частина
- •Практична частина Властивості лужноземельних металів та їх сполук
- •Контрольні питання
- •Елементи іv – а групи
- •Властивості Алюмінію, Карбону, Силіцію, Стануму, Плюмбуму та їх сполук.
- •Контрольні питання
- •Лабораторна робота № 8 Властивості Нітрогену, фосфору та їх сполук.
- •Контрольні питання
- •Галогени
- •Практична частина Властивості р-елементів та її сполук.
- •Контрольні питання
- •Лабораторна робота №13. Загальна характеристика d-елементів
- •Теоретична частина
- •Практична частина
- •Контрольні питання
- •Лабораторна робота №14. Тема: комплексні сполуки
- •Експериментальна робота Комплексні сполуки та їх властивості.
- •Контрольні питання
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 16. Розчини неелектролітів
- •Способи вираження складу розчину
- •Тиск насиченого пару розведених розчинів
- •Температура замерзання розбавлених розчинів
- •Температура кипіння розведених розчинів
- •Осмотичний тиск
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 17. Розчини електролітів
- •Роль розчинника в процесі дисоціації
- •Стан сильних електролітів у розчинах. Коефіцієнт активності
- •Дисоціація слабких електролітів
- •Рівновага в насичених розчинах електролітів
- •Реакція обміну в розчинах електролітів. Іонні рівняння
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 18. Розчини електролітів
- •Гідроліз солей
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 19. Поверхневі явища та адсорбційні рівноваги
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 20. Дисперсні систем та їх класифікація
- •Методи визначення молекулярної маси високомолекулярних сполук.
- •Середня молекулярна маса
- •Контрольні питання:
- •Список літератури
Практична частина Одержання та властивості Гідрогену. Окисно-відновні властивості Гідрогену.
Мета роботи: ознайомитись з методами лабораторного отримання Гідрогену, його хімічними властивостями, дослідити окисно-відновні властивості перекису Гідрогену.
Прилади та реактиви: лабораторний штатив, пробірки, газовідвідні трубки, лучина, спиртівка. Цинк. Порошок оксиду Купруму (ІІ). Перманганат Калію. Розчини: хлороводневої кислоти, йодиду Калію, сірчаної кислоти, 3% пероксиду Гідрогену, нітрату ртуті (ІІ).
Техніка безпеки: Досліди, що супроводжуються виділенням газів проводити під тягою. При роботі не допускати попадання розчинів кислот та перекису Гідрогену на шкіру. При спаленні Гідрогену проявляти обережність. Суміш Гідрогену та Оксигену вибухонебезпечна.
ДОСЛІД 1. Отримання Гідрогену
Д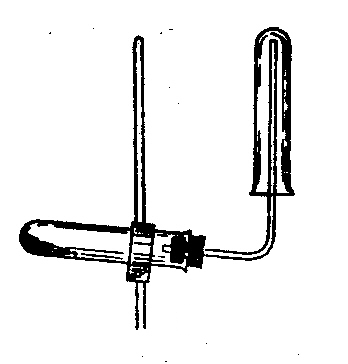 о
пробірки внести 5 крапель розчину
хлороводневої кислоти та шматочок
Цинку. Зачинити отвір пробірки пробкою
з газовідвідною трубкою. Коли реакція
буде проходити досить енергійно, піднести
до кінчика відвідної трубки гарячій
сірник та підпалити газ, що виділяється.
о
пробірки внести 5 крапель розчину
хлороводневої кислоти та шматочок
Цинку. Зачинити отвір пробірки пробкою
з газовідвідною трубкою. Коли реакція
буде проходити досить енергійно, піднести
до кінчика відвідної трубки гарячій
сірник та підпалити газ, що виділяється.
Завдання. Написати рівняння реакції отримання Гідрогену, визначити окисник. Чи можливо для отримання Гідрогену з хлороводневої кислоти замінити Цинк іншим металом? Написати рівняння горіння Гідрогену.
ДОСЛІД 2. Відновні властивості Гідрогену
Насипте скляною лопаточкою на дно сухої скляної пробірки порошок оксиду Купруму (ІІ) та закріпіть її у штативі горизонтально. Газовідвідну трубку з пробірки де утворюється Гідроген занурить до пробірки, що закріплена у штативі. Нагрівайте оксид Купруму (ІІ) слабким полум’ям горілки.
Завдання. Написати рівняння реакції взаємодії Гідрогену з оксидом Купруму (ІІ). За якою зовнішньою ознакою можливо встановити, що оксид Купруму перетворився у металічну Купрум?
ДОСЛІД 3. Окисно-відновні властивості пероксиду Гідрогену
3.1. Окислення йодиду Калію. До пробірки внести 3-4 краплі розчину йодиду Калію, 1 краплю розчину сірчаної кислоти та 1 краплю 3%-го розчину пероксиду Гідрогену.
Завдання. Написати рівняння реакції та вказати як змінюється колір розчину. Які властивості виявляє пероксид Гідрогену в цій реакції?
3.2. Відновлення нітрату Ртуті (ІІ). До пробірки внести 3-4 краплі розчину та додати таку ж кількість розчину лугу до випадіння осаду оксиду ртуті (ІІ). Додати 4-5 крапель 3%-го розчину пероксиду Гідрогену та спостерігати зміну кольору осаду в зв’язку з утворенням часток металічної ртуті.
Завдання. Написати рівняння реакції. Який газ виділяється?
ДОСЛІД 4. Каталітичне розкладення пероксиду Гідрогену
Внести до пробірки невелику кількість порошку перманганату Калію та додати 2-3 краплі розчину пероксиду Гідрогену.
Завдання. Написати рівняння реакції розкладення пероксиду Гідрогену. До якого типу окисно-відновних реакцій вона відноситься? Який газ виділяється в реакції?
Контрольні питання
-
Опішить атоми протію, дейтерію, тритію. В чому полягає різниця цих атомів? Які ізотопи стабільні?
-
Назвіть всі методи отримання Гідрогену в лабораторії та промисловості.
-
Як відрізнити Гідроген від Оксигену, диоксиду Карбону, Нітрогену?
-
При взаємодії з якими речовинами (перманганатом Калію, сірководнем, оксидом Плюмбуму (ІV), йодидом Калію) пероксид Гідрогену виявляє відновні властивості?
-
Напишіть рівняння реакції пероксиду Гідрогену з Хлором, з сульфідом Плюмбуму з утворенням сульфату Плюмбуму.
Задачі
-
Взаємодія Гідрогену з Оксигеном перебігає за рівнянням:
2Н2 + О2 = 2Н2О +583 кДж
В якому напрямку зміститься рівновага при підвищенні тиску, при зниженні температури?
-
До 150 г розчину пероксиду Гідрогену додали трохи диоксиду Мангану. Газ, що виділився за нормальних умов зайняв об’єм 10-3 м3. Розрахуйте масову частку пероксиду Гідрогену в вихідному розчині.
-
Який об’єм за 294 К і тиску 101991 Па займе водень, необхідний для відновлення нікелю з 83 кг його оксиду (ІІІ) ?
-
Складіть рівняння реакцій:
Me + H+ =
H+ + ē (електроліз) =
CH4 + H2O (каталіз) =
С + H2 =
Fe3O4 + H2 =
MoO3 + H2 =
Ba + H2 =
BaH2 + H2O =
