
- •1. Виды диэлектрической поляризации.
- •2. Уравнения диэлектрической поляризации. Уравнение Клаузиуса—Мосотти.
- •3. Релаксационные виды поляризации Зависимость диэлектрической проницаемости от различных факторов (температуры и частоты).
- •4. Атомная поляризуемость и поляризуемость смещения. Зависимость диэлектрической проницаемости от частоты для двухатомного ионного кристалла.
- •5. Электропроводность твердых диэлектриков. Токи смещения, абсорбции и сквозной проводимости.
- •3.1.2. Токи смещения, абсорбции и сквозной проводимости
- •6. Зависимость электропроводности диэлектриков от температуры, концентрации носителей зарядов и их подвижности. ТКρ диэлектриков.
- •7. Потери в диэлектриках. Угол диэлектрических потерь δ. Эквивалентные схемы диэлектрика с потерями. Требования, предъявляемые к изоляционным материалам.
- •4.2. Эквивалентные схемы замещения диэлектрика с потерями
- •8.Виды диэлектрических потерь. Механизм релаксационных потерь в диэлектриках.
- •1) Потери на электропроводность;
- •2) Релаксационные потери;
- •3) Ионизационные потери;
- •9. Виды диэлектрических потерь. Диэлектрические потери в газообразных и твердых диэлектриках.
- •13. Сегнетоэлектрики. Температура Кюри.
- •14. Зависимость поляризованности р и диэлектрической проницаемости ε от напряженности электрического поля е сегнетоэлектриков. Петля диэлектрического гистерезиса.
- •15. Применение диэлектрических материалов в микросхемах в качестве пассивных элементов в составе моп транзисторов.
- •Глава 4. Униполярные транзисторы
- •16. Керамические диэлектрические материалы. Конденсаторная, установочная керамика и керамика для подложек микросхем. Требования, предъявляемые к конденсаторной керамике.
- •17. Основы керамической технологии материалов электронной техники.
- •18. Пробой газообразных диэлектриков. Закон Пашена. Пробой газов в неоднородном электрическом поле.
- •19. Электрический и тепловой пробой.
- •5.4.1. Электрический пробой
- •5.4.2. Электротепловой пробой
- •20. Пленочные резистивные материалы. Резисторы. Параметры резисторов. Система обозначений и маркировка резисторов.
- •21. Высокоомные сплавы и их свойства. Удельное сопротивление металлических сплавов.
- •22. Влияние примеси на удельное сопротивление. Влияние размеров проводника на удельное сопротивление. (Пленочные проводники в микросхемах).
- •24. Эффект Холла и Пельтье. Эффект Холла.
- •25. Медь и ее сплавы. Алюминий и его сплавы.
- •26. Магнитомягкие и магнитотвердые материалы. Области их применения
- •15.1.1. Низкочастотные магнитомягкие материалы
- •27. Механизм технического намагничивания и магнитный гистерезис. Основная кривая намагничивания.
- •14.2.4. Причины, приводящие к образованию доменов
- •14.2.5. Механизм технического намагничивания и магнитный гистерезис
- •28. Магнитные потери. Потери на вихревые токи. Потери в катушках индуктивности.
- •29 . Ферриты. Магнитные подрешетки в структурах шпинели, перовскита и граната.
- •30. Магнитных свойств тонких ферритовых пленок. Доменная структура.
- •31. Требования, предъявляемые к свойствам магнитомягких материалов. Магнитные материалы на основе железа.
- •32. Магнитооптические тонкопленочные эффекты. Эффект Фарадея. Феррит-гранаты Поляризация света
- •Феррит-гранаты
- •33. Магнитные свойства и классификация магнитных материалов.
- •Ферромагнетики
- •14.1.4. Антиферромагнетики
- •14.1.5. Ферримагнетики
- •34. Природа ферромагнетизма. Обменное взаимодействие. Магнитная анизотропия.
- •14.2.2. Магнитная анизотропия
- •35. Междолинные переходы. Отрицательное дифференциальное сопротивление. Принцип генерирования свч-колебаний, основанный на использовании эффекта Ганна.
- •36. Основы сверхпроводимости. Лондоновская глубина проникновения, длина когерентности, куперовские пары.
- •37. Выскотемпературные сверхпроводящие материалы. Эффект Джозеффсона. Текстурированная втсп керамика.
- •§ 6.1. Стационарный эффект Джозефсона
- •38. Классификация диэлектрических материалов.
- •7.11. Керамические диэлектрики
- •Конденсаторная керамика
- •39. Коррозионная устойчивость металлов. Применение уравнения изотермы Вант-Гоффа для оценки окисляемости металлов.
39. Коррозионная устойчивость металлов. Применение уравнения изотермы Вант-Гоффа для оценки окисляемости металлов.
В химических реакциях, идущих при постоянном давлении, одновременно изменяются и энтальпия и энтропия, а процесс протекает в направлении, при котором уменьшается общая движущая сила реакции.
Движущая сила называется свободной энергией или изобарным потенциалом (∆G). По международному соглашению 1961 г. изобарный потенциал назван «свободной энергией Гиббса». Его размерность— Дж/моль. Изобарный потенциал является свойством вещества, выражающим одновременно как его энтальпию (энергию), так и присущую ему энтропию (степень беспорядка).
Основное уравнение термодинамики, связывающее эти величины, имеет вид:
∆G = ∆H - Т∆S. (2.7)
Пусть в системе протекает обратимая химическая реакция, записанная в обобщенной форме
 закон
действия масс
закон
действия масс

(3.4)
Величина Кp(Т), зависящая только от температуры и нечувствительная к суммарному давлению Р и исходному составу системы, называется константой химического равновесия. В левой части формулы (3.4) стоит произведение равновесных парциальных давлений для конечных участников реакции, взятых в степенях, равных их стехио-метрическим коэффициентам, деленное на аналогичное произведение для начальных реагентов.
При
этом их парциальные давления РН
и РК
соответствуют реальной неравновесной
ситуации. Чтобы отличить эти давления
от парциальных давлений в
условиях химического равновесия,
обозначим последние как
![]() Полагая при равновесии ∆G
= 0:
Полагая при равновесии ∆G
= 0:
Изобарный потенциал связан с константой равновесия простым соотношением:
∆Gот = ─RTlnKp(T). (2.8) Kp(T)=K

где по закону действия масс (3.4) (с обозначением равновесных давлений в виде Р,)
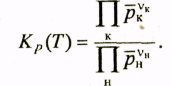
(3.22)
Выражение (3.21) дает важное для термодинамических расчетов соотношение между стандартным изобарным потенциалом ∆G° и константой химического равновесия КР(Т).
Подстановка (3.21) в (3.19) приводит изобарный потенциал химической реакции в неравновесных условиях, когда к форме

![]()
(3.23)
называемой уравнением изотермы Вант-Гоффа.
Расчет констант химического равновесия. В основе расчета константы равновесия Кp(Т) для любой реакции, записанной в обобщенной форме (3.1), лежит соотношение (3.21), выражающее Кp через ∆G°т " как
 (П.7)
(П.7)
Стандартный изобарный потенциал реакции ∆G°т в этой формуле выражается через тепловой эффект ∆H°т и энтропию ∆°S реакции в стандартных условиях с помощью известного соотношения (3.35):
![]()
Таким образом, расчет зависимости Кp (Т) сводится к вычислению стандартных величин ∆H°т и ∆G°т для конкретной химической реакции при температуре T . Исходными для расчета служат выражения

полученные из формул (1.24), (3.36) и (3.37), где ∆H°298 и ∆S°298 — стандартный тепловой эффект и стандартная энтропия реакции при T = 298 К, ∆Cp(T) — изменение изобарной теплоемкости за один пробег реакции слева направо при температуре Т.
Величины ∆H°298, ∆S°298 и ∆Cp вычисляют на основе таблиц стандартных термодинамических величин
Итак: ∆G° Т = ─RTlnKp(T). (2.8) (в равновесии)
Рассмотрим реакцию окисления металла:
Me + О2 ↔ МеО2 Kр=1/ P/o2 (опустим (Т) : Кр(Т)=Кр)
В газовой атмосфере, содержащей кислород, уравнение для изобарно-изотермического потенциала (3.23) будет иметь вид:
∆G = -RT ln(K)+ RT ln 1/PО2. (2.9)
Выражая изменение энергии Гиббса через величины равновесно-
го![]() и
парциального
и
парциального![]() давлений
кислорода, получим
давлений
кислорода, получим
![]()
У![]() равнение
позволяет оценить возможность протекания
процессаокисления.
Если
равнение
позволяет оценить возможность протекания
процессаокисления.
Если![]() то
процесс окисления возможен, так как
в
этих
условиях
∆G
<
0.
Если,
то окисление невозможно,
то
процесс окисления возможен, так как
в
этих
условиях
∆G
<
0.
Если,
то окисление невозможно,
ибо при этом ∆G > 0.
Этот
принцип
используют для предотвращения газовой
корозии в ряде
технологических операций, например, в
металлургии. Снижая парциальное
давление
![]() в
газовой среде, предохраняют металл от
окисления
при высоких температурах.
в
газовой среде, предохраняют металл от
окисления
при высоких температурах.
Стремление металлов перейти из металлического в ионное состояние характеризуется величиной уменьшения свободной энергии (∆G°) и составляет сущность процессов химической коррозии.

Рис. 3.1. Влияние температуры на ∆G° образования некоторых оксидов металла:
1— Аи2О3; 2 — Ag20; 3 — PtO; 4 — CuO; 5 — PbO; 6 — NiO; 7 — FeO; 8 — Fe2O3;9 — Cr203; 10 —TiO22;11— A12O3; 12 —MgO
вые металлы (К, Са, Na, Mg).Реакция ионизации этих металлов сопровождается убылью свободной энергии и вероятность перехода их в окисленное состояние тем больше, чем значительнее уменьшение ∆G°. Эти металлы в природе встречаются в виде руд и солей.
В конце таблицы находятся наиболее коррозионноустойчивые металлы (Pd, Ir, Pt, Аи). Положительное значение изменения свободной энергии системы указывает на невозможность самопроизвольного протекания реакций ионизации. В природных условиях золото, платина, иридий и палладий являются термодинамически устойчивыми. Они, как правило, встречаются в самородном состоянии.
