
- •§1. Несколько вводных замечаний о предмете физики.
- •§2. Механика
- •2.2. Кинематика движения материальной точки. Характеристики движения.
- •2.3. Вектор скорости. Средняя и мгновенная скорость.
- •2.4. Путь при неравномерном движении.
- •2.6. Криволинейное движение.
- •2.6.1. Ускорение при криволинейном движении (тангенциальное и нормальное ускорение).
- •2.7. Кинематика вращательного движения.
- •2.7.1. Угловая скорость.
- •2.7.2. Угловое ускорение.
- •2.7.3. Связь между линейной и угловой скоростью.
- •§3. Динамика
- •3.2. II закон Ньютона.
- •3.3. III закон Ньютона.
- •3.4. Импульс. Закон сохранения импульса.
- •3.5. Работа и энергия.
- •3.6. Мощность.
- •3.7. Энергия.
- •3.8. Кинетическая энергия тела.
- •3.9. Потенциальное поле сил. Силы консервативные и неконсервативные.
- •3.10. Потенциальная энергия тела в поле сил тяжести (в поле тяготения Земли).
- •3.11. Потенциальная энергия в гравитационном поле (в поле всемирного тяготения).
- •3.12. Потенциальная энергия упруго деформированного тела.
- •3.13. Закон сохранения энергии.
- •§4. Механика твердого тела.
- •4.1. Поступательное движение твердого тела.
- •4.2. Вращательное движение твердого тела.
- •4.3. Момент импульса тела.
- •4.4. Закон сохранения момента импульса.
- •4.5. Основное уравнение динамики вращательного движения.
- •4.6. Кинетическая энергия вращающегося твердого тела.
- •4.7. Работа внешних сил при вращательном движении твердого тела.
- •§5. Гидродинамика
- •5.1. Линии и трубки тока.
- •5.2. Уравнение Бернулли.
- •5.3. Силы внутреннего трения.
- •5.4. Ламинарное и турбулентное течения.
- •5.5. Течение жидкости в круглой трубе.
- •5.6. Движение тел в жидкостях и газах.
- •§6. Всемирное тяготение.
- •6.1. Законы Кеплера.
- •6.2. Опыт Кавендиша.
- •6.3. Напряженность гравитационного поля. Потенциал гравитационного поля.
- •§7. Основы теории относительности.
- •7.1. Принцип относительности.
- •7.2. Постулаты специальной (частной) теории относительности. Преобразования Лоренца
- •7.3. Следствия из преобразований Лоренца.
- •7.4. Интервал между событиями.
- •§8. Колебания.
- •8.1. Общие сведения.
- •8.2. Уравнение гармонического колебательного движения.
- •8.3. Графическое изображение гармонических колебаний. Векторная диаграмма.
- •8.4. Скорость, ускорение и энергия колеблющегося тела.
- •8.5. Гармонический осциллятор.
- •8.6. Малые колебания системы вблизи положения равновесия.
- •8.7. Математический маятник.
- •8.8. Физический маятник.
- •8.9. Затухающие колебания.
- •8.10. Вынужденные колебания. Резонанс.
- •Молекулярная физика и термодинамика §9. Молекулярная физика
- •9.1. Предмет и методы молекулярной физики.
- •9.2. Термодинамическая система. Параметры состояния системы. Равновесное и неравновесное состояние.
- •9.2.1. Идеальный газ. Параметры состояния идеального газа.
- •9.2.2. Газовые законы.
- •9.2.3. Закон Авогадро.
- •9.2.4. Уравнение состояния идеального газа (уравнение Менделеева Клапейрона).
- •Физический смысл универсальной газовой постоянной.
- •9.2. Основное уравнение кинетической теории газов
- •9.3. Барометрическая формула. Распределение Больцмана
- •9.4. Максвелловское распределение молекул по скоростям
- •9.5. Явления переноса. Длина свободного пробега молекул
- •9.6. Явление диффузии
- •9.7. Явление теплопроводности и вязкости
- •§10. Термодинамика
- •10.1. Внутренняя энергия идеального газа
- •10.2. Работа и теплота. Первое начало термодинамики
- •10.3. Работа газовых изопроцессов
- •10.4. Молекулярно-кинетическая теория теплоемкостей
- •10.5. Адиабатический процесс
- •10.6. Круговые обратимые процессы. Цикл Карно
- •10.7. Понятие об энтропии. Энтропия идеального газа
- •10.8. Второе начало термодинамики
- •10.9. Статистическое толкование второго начала термодинамики
- •§11. Реальные газы
- •11.1. Уравнение Ван-дер-Ваальса
- •11.2. Критическое состояние вещества
- •11.3. Эффект Джоуля-Томсона
9.2.2. Газовые законы.
Если разрешить уравнение состояния идеального газа
![]()
относительно какого-либо из параметров, например, p, то уравнение состояния примет вид
![]() .
.
И известные из школьного курса физики законы Бойля-Мариотта и Гей-Люссака дают уравнения состояния для случаев, когда один параметров остается постоянным.
Известные газовые законы (Бойля-Мариотта, Гей-Люссака, Дальтона, Авогадро) были открыты опытным путем задолго до появления молекулярно-кинетической теории. Эти законы были установлены на опытах с газами, находящимися в условиях, не очень сильно отличающихся от нормальных атмосферных условий, т.е. при не очень низких температурах и не очень высоких давлениях. При иных условиях экспериментальные газовые законы уже не точно отражают свойства газов, т.е. все эти законы являются приближенными.
Рассмотрим некоторые из этих законов:
1) Закон Бойля-Мариотта (m = const, T = const).
Изучая изотермические процессы, английский ученый Бойль (1662г.) и французский ученый Мариотт (1667г.) независимо друг от друга установили следующий закон:
ОПРЕДЕЛЕНИЕ: Для данной массы газа при постоянной температуре (T = const) давление газа изменяется обратно пропорционально объему.
А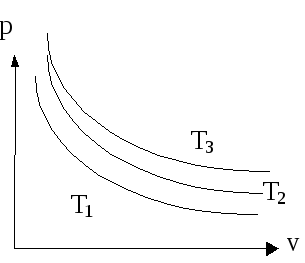 налитически
это можно записать в виде: P·V
= const (T
= const). Совокупность
состояний, отвечающих одной и той же
температуре, изобразится на диаграмме
(P, V) кривой,
определяемой уравнением гиперболы.
Каждому значению температуры соответствует
своя кривая, называемая изотермой.
А переход газа из одного состояния в
другой, совершающийся при постоянной
температуре, называется изотермическим
процессом.
налитически
это можно записать в виде: P·V
= const (T
= const). Совокупность
состояний, отвечающих одной и той же
температуре, изобразится на диаграмме
(P, V) кривой,
определяемой уравнением гиперболы.
Каждому значению температуры соответствует
своя кривая, называемая изотермой.
А переход газа из одного состояния в
другой, совершающийся при постоянной
температуре, называется изотермическим
процессом.
2) Закон Гей-Люссака (m = const, P = const).
Изучая изобарические газовые процессы, французский физик Гей-Люссак в 1802г. установил следующий закон:
ОПРЕДЕЛЕНИЕ: Для данной массы газа при
постоянном давлении объем газа меняется
линейно с ростом температуры:
![]() ,
где
V – объем газа при
температуре t;
V0
– объем газа при 0C;
– термический коэффициент объемного
расширения (
,
где
V – объем газа при
температуре t;
V0
– объем газа при 0C;
– термический коэффициент объемного
расширения (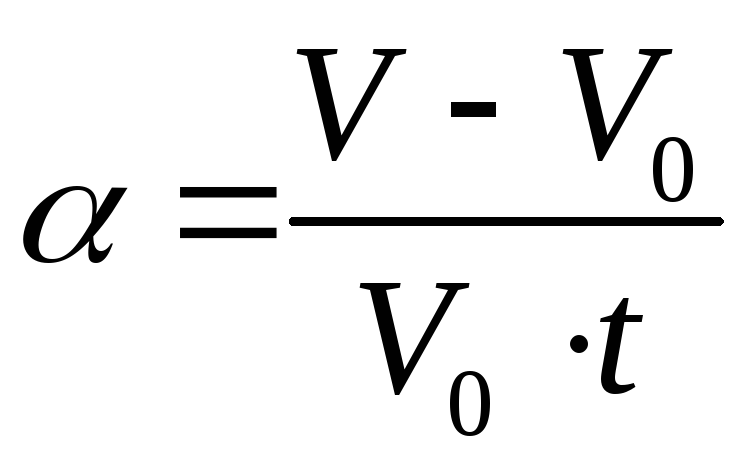 ).
).
Т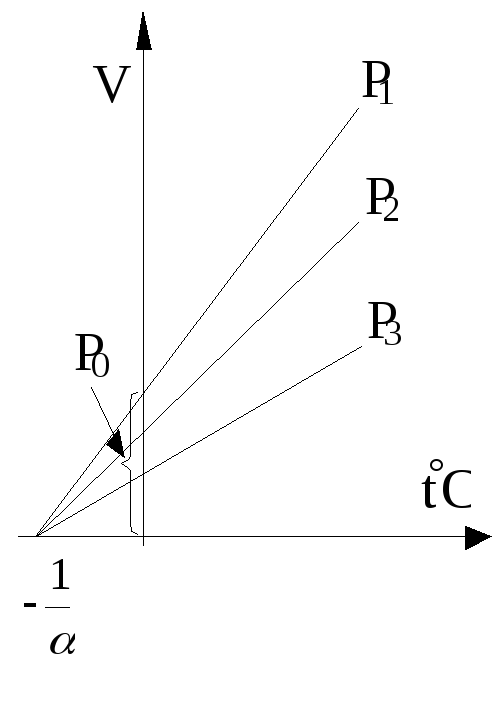 ермический
коэффициент объемного расширения
показывает, на какую часть относительно
первоначального объема изменится объем
газа при его нагреве на 1.
Для большинства газов
ермический
коэффициент объемного расширения
показывает, на какую часть относительно
первоначального объема изменится объем
газа при его нагреве на 1.
Для большинства газов
![]() .
.
Процесс, протекающий при постоянном давлении, называется изобарическим. Для газа такой процесс отобразится на диаграмме (V, t) прямой; здесь различные прямые отвечают разным давлениям и называются изобарами.
3) Закон Шарля (m = const, V = const).
ОПРЕДЕЛЕНИЕ: Для данной массы газа при
постоянном объеме давление газа
изменяется линейно с ростом
температуры:
![]() ,
где
P – давление газа при
температуре t;
P0
– давление газа при 0C;
– термический коэффициент давления
газа (
,
где
P – давление газа при
температуре t;
P0
– давление газа при 0C;
– термический коэффициент давления
газа (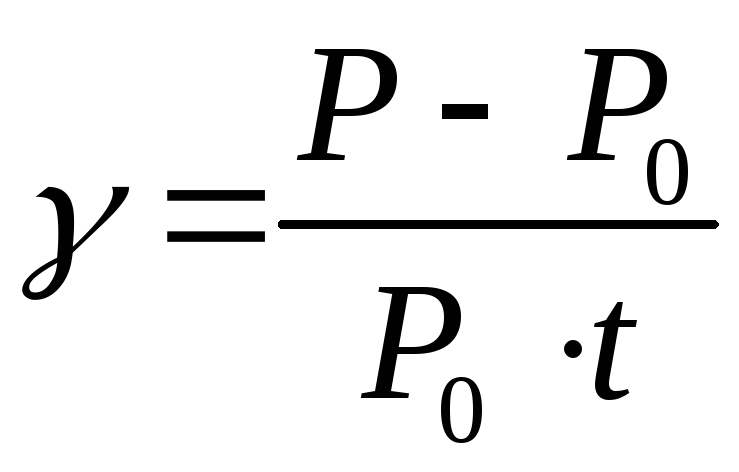 ).
).
Аналогично сказанному ранее относительно коэффициента “”, термический коэффициент давления газа показывает, на какую часть относительно первоначального давления изменится давление газа при его нагревании на 1С.
Д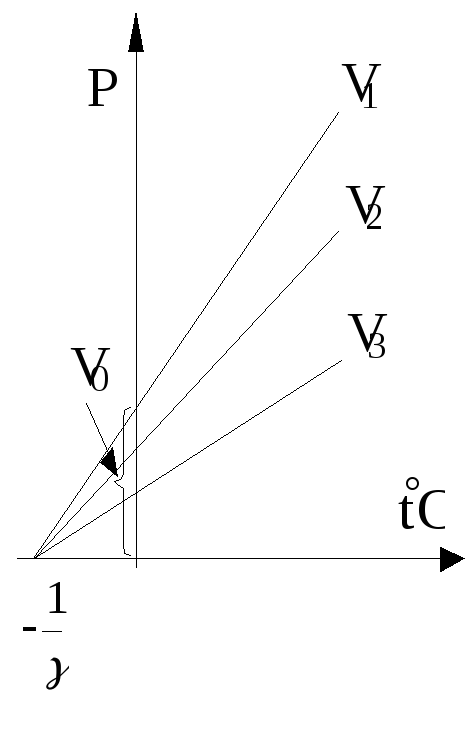 ля
идеального газа также
ля
идеального газа также
![]() .
Для идеального газа
.
Для идеального газа
![]() .
.
Изохорический процесс, т.е. процесс, протекающий при постоянном объеме на диаграмме (P, t) изобразится прямой линией. Различные прямые соответствую различным объемам и называются изохорами.
Заметим теперь, что
все изобары и изохоры пересекают ось
t в
одной и той же точке, определяемой из
условия 1+t=0.
Откуда
![]() .
.
Если за начало отсчета температуры взять нуль (как это и было), то получим шкалу температур по Цельсию. Если сместить начало отсчета в точку -273.15, то перейдем к другой температурной шкале, которая называется абсолютной (или шкалой Кельвина).
В соответствии с определением абсолютной шкалы между абсолютной температурой (Т) и температурой по Цельсию (t) существует следующее соотношение:
![]() . (9.1)
. (9.1)
Температура равная 0К называется абсолютным нулем.
Для установления абсолютной шкалы температур и абсолютного нуля мы воспользовались законами Гей-Люссака и Шарля и поступили сугубо формально. Однако Кельвин в 1852г., исходя из иных физических соображений установил такую же абсолютную шкалу температур с тем же значением абсолютного нуля, какие ранее были получены формально. Поэтому понятия абсолютной температуры и абсолютного нуля не следует рассматривать как формальные, не имеющие физического смысла. Кельвин показал, что абсолютный нуль – это самая низкая из возможных температур вещества. При абсолютном нуле прекращается хаотическое движение молекул в веществе. Однако это не означает, что в нем прекращается всякое движение. Сохраняется, например, движение электронов в атоме. В настоящее время удается охлаждать малые объемы вещества до температуры очень близкой к абсолютному нулю, не достигая последнего лишь на несколько тысячных долей градуса.
Перейдем
теперь в уравнениях, описывающих законы
Гей-Люссака и Шарля от температуры по
Цельсию к абсолютной температуре,
подставив вместо t величину
![]() .
.
Тогда
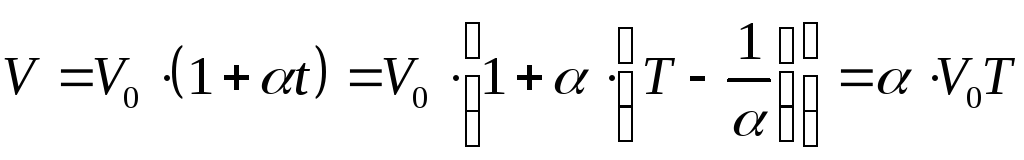 . (9.2)
. (9.2)
и аналогично
![]() (при условии =).
(при условии =).
Из этих уравнений следует, что
|
|
(P = const) |
(9.3) |
|
|
(V = const) |
(9.4) |
где индексы 1 и 2 относятся к произвольным состояниям, лежащим на одной и той же изобаре (для уравнения (9.3)), или одной и той же изохоре (для уравнения (9.4)).
Итак, при постоянном давлении объем газа пропорционален абсолютной температуре; и при постоянном объеме давление газа пропорционально абсолютной температуре.
Всякий
реальный газ тем точнее следует уравнениям
PV = const,
![]() ,
,
![]() ,
чем меньше его плотность, т.е., чем больший
объем он занимает.
,
чем меньше его плотность, т.е., чем больший
объем он занимает.
В
соответствии с уравнением PV
= const, объем растет с
уменьшением давления, а согласно с
![]() объем возрастает с температурой.
Следовательно, рассмотренные газовые
законы справедливы при не слишком низких
температурах и невысоких давлениях.
объем возрастает с температурой.
Следовательно, рассмотренные газовые
законы справедливы при не слишком низких
температурах и невысоких давлениях.
Газ, который точно следует этим уравнениям, называется идеальным. Всякий реальный газ по мере убывания его плотности приближается к идеальному.
Замечание:
1. Закон Дальтона.
ОПРЕДЕЛЕНИЕ: Парциальным давлением газа, входящего в газовую смесь, называется то давление, которое имел бы этот газ, если бы все остальные газы были удалены из объема.
В 1801гю английский физик и химик Дальтон установил соотношение между давлением газовой смеси и парциальными давлениями входящих в нее газов.
ОПРЕДЕЛЕНИЕ: Давление газовой смеси равно сумме парциальных давлений входящих в нее газов.
P=P1+P2+P3+…
