
- •§1. Несколько вводных замечаний о предмете физики.
- •§2. Механика
- •2.2. Кинематика движения материальной точки. Характеристики движения.
- •2.3. Вектор скорости. Средняя и мгновенная скорость.
- •2.4. Путь при неравномерном движении.
- •2.6. Криволинейное движение.
- •2.6.1. Ускорение при криволинейном движении (тангенциальное и нормальное ускорение).
- •2.7. Кинематика вращательного движения.
- •2.7.1. Угловая скорость.
- •2.7.2. Угловое ускорение.
- •2.7.3. Связь между линейной и угловой скоростью.
- •§3. Динамика
- •3.2. II закон Ньютона.
- •3.3. III закон Ньютона.
- •3.4. Импульс. Закон сохранения импульса.
- •3.5. Работа и энергия.
- •3.6. Мощность.
- •3.7. Энергия.
- •3.8. Кинетическая энергия тела.
- •3.9. Потенциальное поле сил. Силы консервативные и неконсервативные.
- •3.10. Потенциальная энергия тела в поле сил тяжести (в поле тяготения Земли).
- •3.11. Потенциальная энергия в гравитационном поле (в поле всемирного тяготения).
- •3.12. Потенциальная энергия упруго деформированного тела.
- •3.13. Закон сохранения энергии.
- •§4. Механика твердого тела.
- •4.1. Поступательное движение твердого тела.
- •4.2. Вращательное движение твердого тела.
- •4.3. Момент импульса тела.
- •4.4. Закон сохранения момента импульса.
- •4.5. Основное уравнение динамики вращательного движения.
- •4.6. Кинетическая энергия вращающегося твердого тела.
- •4.7. Работа внешних сил при вращательном движении твердого тела.
- •§5. Гидродинамика
- •5.1. Линии и трубки тока.
- •5.2. Уравнение Бернулли.
- •5.3. Силы внутреннего трения.
- •5.4. Ламинарное и турбулентное течения.
- •5.5. Течение жидкости в круглой трубе.
- •5.6. Движение тел в жидкостях и газах.
- •§6. Всемирное тяготение.
- •6.1. Законы Кеплера.
- •6.2. Опыт Кавендиша.
- •6.3. Напряженность гравитационного поля. Потенциал гравитационного поля.
- •§7. Основы теории относительности.
- •7.1. Принцип относительности.
- •7.2. Постулаты специальной (частной) теории относительности. Преобразования Лоренца
- •7.3. Следствия из преобразований Лоренца.
- •7.4. Интервал между событиями.
- •§8. Колебания.
- •8.1. Общие сведения.
- •8.2. Уравнение гармонического колебательного движения.
- •8.3. Графическое изображение гармонических колебаний. Векторная диаграмма.
- •8.4. Скорость, ускорение и энергия колеблющегося тела.
- •8.5. Гармонический осциллятор.
- •8.6. Малые колебания системы вблизи положения равновесия.
- •8.7. Математический маятник.
- •8.8. Физический маятник.
- •8.9. Затухающие колебания.
- •8.10. Вынужденные колебания. Резонанс.
- •Молекулярная физика и термодинамика §9. Молекулярная физика
- •9.1. Предмет и методы молекулярной физики.
- •9.2. Термодинамическая система. Параметры состояния системы. Равновесное и неравновесное состояние.
- •9.2.1. Идеальный газ. Параметры состояния идеального газа.
- •9.2.2. Газовые законы.
- •9.2.3. Закон Авогадро.
- •9.2.4. Уравнение состояния идеального газа (уравнение Менделеева Клапейрона).
- •Физический смысл универсальной газовой постоянной.
- •9.2. Основное уравнение кинетической теории газов
- •9.3. Барометрическая формула. Распределение Больцмана
- •9.4. Максвелловское распределение молекул по скоростям
- •9.5. Явления переноса. Длина свободного пробега молекул
- •9.6. Явление диффузии
- •9.7. Явление теплопроводности и вязкости
- •§10. Термодинамика
- •10.1. Внутренняя энергия идеального газа
- •10.2. Работа и теплота. Первое начало термодинамики
- •10.3. Работа газовых изопроцессов
- •10.4. Молекулярно-кинетическая теория теплоемкостей
- •10.5. Адиабатический процесс
- •10.6. Круговые обратимые процессы. Цикл Карно
- •10.7. Понятие об энтропии. Энтропия идеального газа
- •10.8. Второе начало термодинамики
- •10.9. Статистическое толкование второго начала термодинамики
- •§11. Реальные газы
- •11.1. Уравнение Ван-дер-Ваальса
- •11.2. Критическое состояние вещества
- •11.3. Эффект Джоуля-Томсона
Физический смысл универсальной газовой постоянной.
У
![]()
В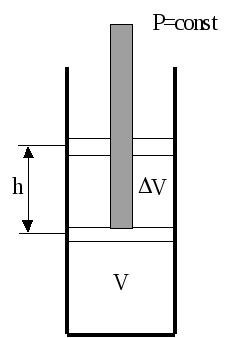 ыясним
физический смысл постоянной “R”.
ыясним
физический смысл постоянной “R”.
Пусть в цилиндре под
поршнем находится 1 моль газа объема V.
Газ под поршнем оказывает давление
равное внешнему постоянному давлению,
т.е. p = const.
Пусть газ в цилиндре нагревается на
1К. Расширяясь, он
поднимает поршень на высоту “h”,
совершив при том работу
![]() ,
но давление на поршень
,
но давление на поршень
![]() ,
поэтому
,
поэтому
![]() ,
здесь
,
здесь
![]() – приращение объема, т.е.
– приращение объема, т.е.
![]() ,
поэтому работа расширения будет равна
,
поэтому работа расширения будет равна
|
|
(*) |
С другой стороны до нагревания уравнение состояния
-
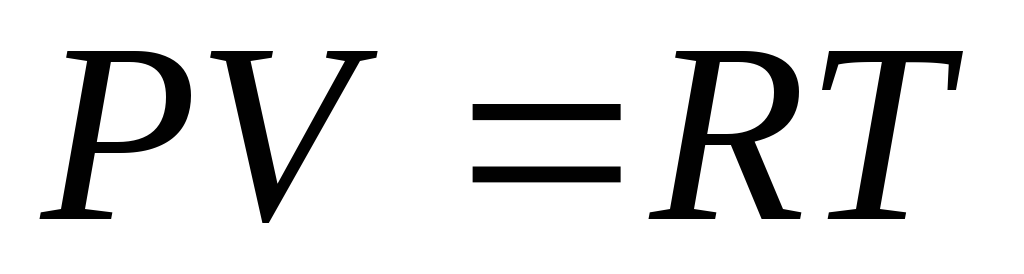
(1)
после нагревания
-

(2)
Вычитая из (2) – (1),
получим
![]() .
Сопоставляя со (*), имеем
.
Сопоставляя со (*), имеем
![]() .
.
|
Т.е. |
универсальная газовая постоянная численно равна работе при изобарическом расширении 1 моля газа вследствие его нагревания на 1К. |
ЗАПОМНИТЬ |
ЗАМЕЧАНИЕ: Уравнение Клапейрона – Менделеева справедливо и для смеси газов. Пусть имеем смесь газов:
|
Массы газов – |
m1, m2, m3, …, mn |
|
молярные массы газов – |
1, 2, 3, …, n |
Введем величины:
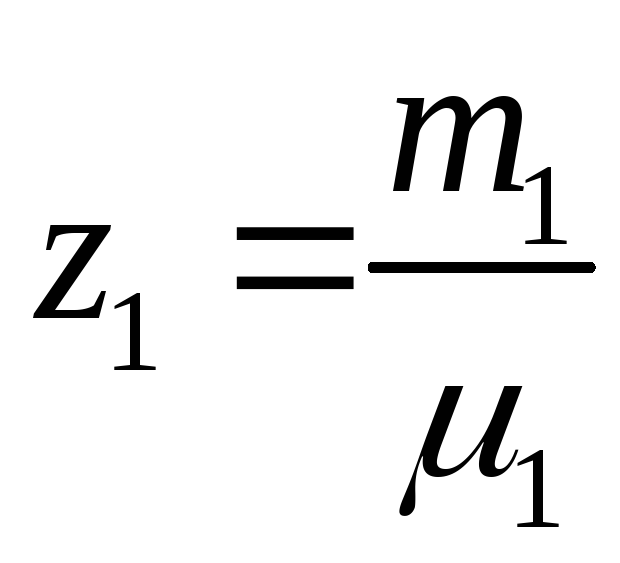 ;
;
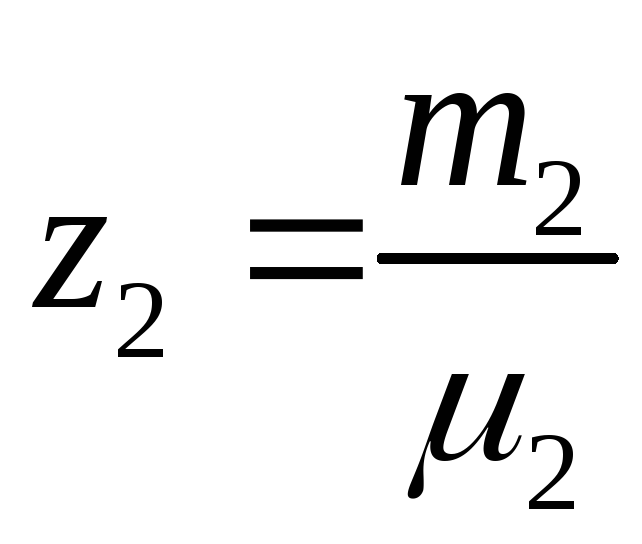 и т.д. Причем
и т.д. Причем
![]() .
.
Уравнение Менделеева Клапейрона для смеси газов запишется в виде:
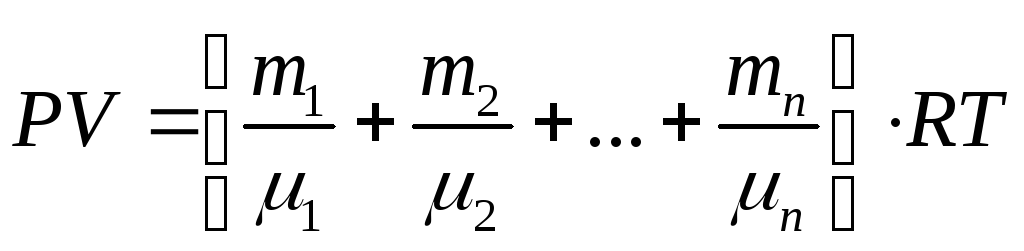 .
.
Для того, чтобы упростить это выражение для смеси газов вводят понятие эффективного молекулярного веса смеси газов.
ОПРЕДЕЛЕНИЕ: Эффективным молекулярным весом называется вес такого газа, который при одинаковых параметрах со смесью газов имеет ту же массу, что и смесь газов.
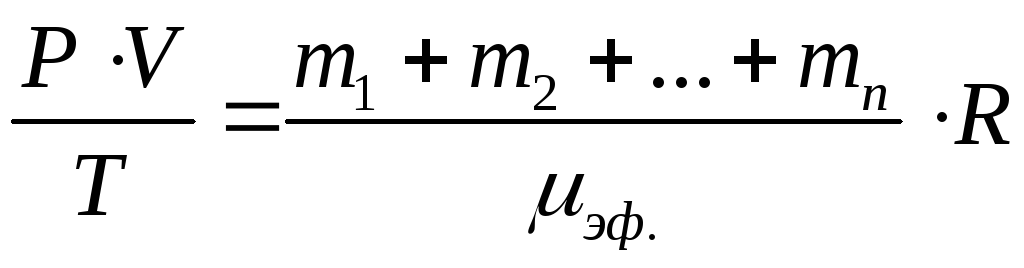 ;
;
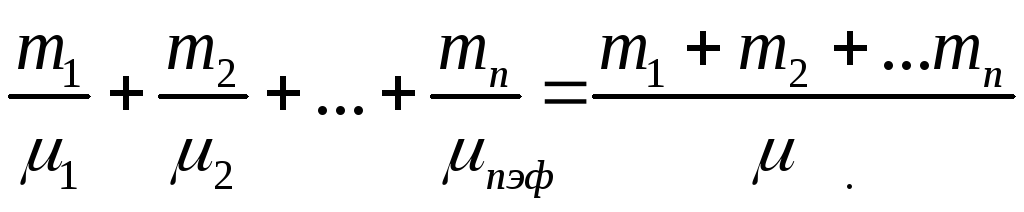 ;
;
 .
.
9.2. Основное уравнение кинетической теории газов
Если в предыдущем разделе применялся термодинамический метод исследования, то в этом разделе будет использован статистический метод исследования молекулярных процессов. На основании исследования совокупного действия молекул будут получены такие термодинамические параметры, как давление и температура.
Для расчетов воспользуемся моделью идеального газа с точки зрения молекулярно-кинетической теории:
-
молекулы газа непрерывно и хаотично движутся;
-
молекулы взаимодействуют только во время удара;
-
удары молекул абсолютно упругие;
-
размеры молекул малы по сравнению с расстоянием между ними.
П усть
в сосуде кубической формы объемом V =
l 3 , где l - длина ребра
(рис. 9.2), число молекул в единице объема
равно no . Молекулы движутся
хаотично и, соударяясь со стенкой
площадью S = l 2,
оказывают на нее давление. Результаты
расчета давления на стенку не изменятся,
если хаотическое движение молекул
заменить направленным движением их
вдоль осей x, y, z . Тогда со
стенкой S будет соударяться третья
часть от всех молекул, равная
усть
в сосуде кубической формы объемом V =
l 3 , где l - длина ребра
(рис. 9.2), число молекул в единице объема
равно no . Молекулы движутся
хаотично и, соударяясь со стенкой
площадью S = l 2,
оказывают на нее давление. Результаты
расчета давления на стенку не изменятся,
если хаотическое движение молекул
заменить направленным движением их
вдоль осей x, y, z . Тогда со
стенкой S будет соударяться третья
часть от всех молекул, равная
 (9.8)
(9.8)
При каждом соударении со стенкой молекула передает ей импульс, равный mv1 - (-mv1) = 2mv1 , где m - масса молекулы, v1 -ее скорость. За время t молекула пройдет путь v1t, соударится со стенкой число раз, равное v1t/2l, и передаст стенке импульс P1 = mv12t/l. Просуммируем импульс, переданный стенке всеми n молекулами: P =(mt/l)(v12 + v22 + ...+ vn2). В данном выражении находится сумма квадратов скоростей. Статистическое усреднение будет заключаться в том, что мы введем новую среднюю величину - среднеквадратичную скорость - по формуле vкв2 = (v12 + v22 + ...+ vn2)/n . Следует заметить, что vкв приблизительно на 10% больше, чем средняя скорость молекулы, которая определяется по формуле: vср = (v1 + v2 + ... + vn)/n. Используя выражение для vкв2 , получим P = mvкв2tn/l . По второму закону Ньютона на стенку будет действовать сила F = P/t = mvкв2n/l. Давление газа на стенку найдем по формуле p = F/S = F/l 2 или p = mvкв2n/l3 . Используя формулу (9.8), получим окончательно
![]() (9.9)
(9.9)
Мы получили основное уравнение кинетической теории газов, которое связывает макроскопический параметр - давление газа - с микроскопическими параметрами молекул. Величина no(mvкв2/2) есть кинетическая энергия молекул, заключенная в единице объема. Отсюда следует, что давление есть мера плотности кинетической энергии молекул.
Сравнивая формулы (9.9) и (9.7), получим выражение для средней кинетической энергии молекулы
![]() (9.10)
(9.10)
Итак, мы пришли к важному выводу: кинетическая энергия молекул зависит только от абсолютной температуры. Отсюда следует физический смысл температуры: абсолютная температура есть мера средней энергии поступательного движения молекул. Из формулы (9.10) можно найти среднеквадратичную скорость движения молекул: vкв2 = 3kT/m = 3RT/ . Для кислорода при комнатной температуре vкв 480 м/с и сравнима со скоростью пули.
