
- •1 Оглавление
- •Часть 1
- •Молекулярная физика и термодинамика 84
- •Итоговые задания 130 предисловие
- •В добрый путь, читатель, – удачи!
- •Введение
- •Физическая картина мира
- •Математическое введение Углы
- •Скаляры и векторы
- •Натуральные логарифмы
- •Суммирование
- •Элементы дифференциального исчисления
- •Элементы интегрального исчисления
- •Глава 1 механика
- •Кинематика
- •Механическое движение
- •Вектор перемещения. Путь
- •Скорость
- •Ускорение
- •Равномерное и равнопеременное прямолинейные движения
- •Свободное падение тел
- •Равномерное движение точки по окружности
- •Вращательное движение абсолютно твердого тела вокруг неподвижной оси
- •Динамика движения материальной точки
- •Классическая механика. Границы ее применимости
- •Первый закон Ньютона. Инерциальные системы отсчета
- •Масса и импульс
- •Второй закон Ньютона
- •Третий закон Ньютона
- •Закон сохранения импульса
- •Механический принцип относительности Галилея – Ньютона
- •Силы тяготения
- •Силы упругости
- •Силы трения
- •Элементы динамики вращательного движения абсолютно твердого тела относительно неподвижной оси
- •Момент силы и момент инерции
- •Основной закон динамики вращательного движения
- •Статика
- •Работа и механическая энергия
- •Работа силы при движении материальной точки
- •Механическая энергия
- •Закон сохранения и превращения энергии
- •Мощность
- •Элементы гидроаэромеханики
- •Закон Паскаля
- •Закон Архимеда
- •Давление в движущейся среде
- •Внутреннее трение
- •Основы специальной теории относительности
- •Постулаты Эйнштейна
- •Интервалы длины и времени
- •Закон сложения скоростей
- •Энергия
- •Ответы на вопросы к главе 1
- •Глава 2 молекулярная физика и термодинамика
- •Основы молекулярно-кинетической теории вещества
- •Основные понятия и определения
- •Силы и потенциальная энергия взаимодействия двух молекул
- •О строении газообразных, жидких и твердых тел
- •Молекулярно-кинетическая теория идеальных газов
- •Идеальный газ
- •Распределение Максвелла – Больцмана
- •Распределение Больцмана
- •Средняя длина свободного пробега молекулы
- •Основное уравнение кинетической теории газов
- •Уравнение состояния идеального газа
- •Связь средней кинетической энергии поступательного движения молекул и температуры
- •Реальные газы
- •Свойства жидкостей и твердых тел
- •Поверхностный слой
- •Поверхностное натяжение
- •Лапласово давление
- •Твердое тело
- •Термодинамика
- •Внутренняя энергия системы
- •Внутренняя энергия идеального газа
- •Первое начало термодинамики
- •Калориметрия33
- •Работа газа
- •Цикл Карно. Второе начало термодинамики
- •Некоторые тепловые машины
- •Изменение агрегатного состояния вещества
- •Плавление. Кристаллизация
- •Парообразование. Конденсация. Испарение
- •Свойства паров
- •Кипение
- •Ответы на вопросы к главе 2
- •Итоговые задания
- •Часть 1
- •346500, Г. Шахты, Ростовская обл., ул. Шевченко, 147.
-
Изменение агрегатного состояния вещества
-
Плавление. Кристаллизация
-
Мы изучили некоторые свойства вещества в трех агрегатных состояниях – твердом, жидком и газообразном. Теперь рассмотрим переходы между этими состояниями.
П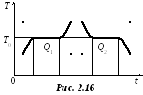 ереход
вещества из твердого в жидкое состояние
– плавление. Напомним, что твердым
телом мы назвали тело кристаллическое.
Обратный переход из жидкого состояния
в твердое – кристаллизация
(отвердевание).
ереход
вещества из твердого в жидкое состояние
– плавление. Напомним, что твердым
телом мы назвали тело кристаллическое.
Обратный переход из жидкого состояния
в твердое – кристаллизация
(отвердевание).
Поместим пробирку с нафталином в сосуд с водой и начнем подогревать, измеряя температуру нафталина. График зависимости температуры от времени нагревания, затем охлаждения изображен на рисунке 2.16.
Сначала температура увеличивается до значения Т0, после чего перестает расти, хотя некоторое количество теплоты передается извне нафталину. В это время нафталин плавится, т.е. из кристаллического порошка превращается в бесцветную жидкость. При этом разрушается кристаллическая решетка, увеличивается потенциальная энергия взаиморасположения молекул. Кинетическая энергия молекул, в среднем пропорциональная температуре, при плавлении не изменяется. Внутренняя энергия возрастает на теплоту плавления Q1. После того как все вещество расплавится, температура жидкости вновь станет увеличиваться.
Таким образом, плавление происходит при такой температуре плавления, которая соответствует минимальной кинетической энергии хаотического движения молекул жидкости.
Прекратим подачу энергии – начнется процесс остывания, при котором определенное количество теплоты будет передаваться окружающим телам и рассеиваться. Температура понизится до Т0 и не изменится в течение всего времени кристаллизации, хотя при этом определенное количество теплоты Q2 будет рассеяно и передано окружающим телам. В процессе отвердевания образуется кристаллическая решетка, расположение частиц снова становится упорядоченным, что связано с минимальным значением потенциальной и, следовательно, внутренней энергии. Вообще, при переходе от некристаллического (в частности, аморфного) состояния к кристаллическому внутренняя энергия уменьшается, чем объясняется устойчивость кристаллической структуры.
После того как все вещество закристаллизовалось, снова понижается температура теперь уже твердого тела. В процессе плавления энергия затрачивается на разрушение кристаллической решетки и переходит во внутреннюю. Эта энергия измеряется теплотой плавления Q1; при отвердевании выделяется такая же энергия, измеряемая теплотой отвердевания Q2, причем Q1= Q2. Мерой энергетических затрат при плавлении является удельная теплота плавления
![]()
величина, равная отношению количества
теплоты35,
необходимого для изотермического
превращения определенной массы твердого
вещества в жидкое состояние, к этой
массе. Здесь
![]() количество теплоты,
необходимое для плавления массы dm
твердого тела при температуре плавления.
Оно равно
количество теплоты,
необходимое для плавления массы dm
твердого тела при температуре плавления.
Оно равно
![]() .
.
Чтобы
найти теплоту плавления или отвердевания
конечной массы вещества, надо сложить
все такие выражения. Если
![]() считать неизменной, то
считать неизменной, то
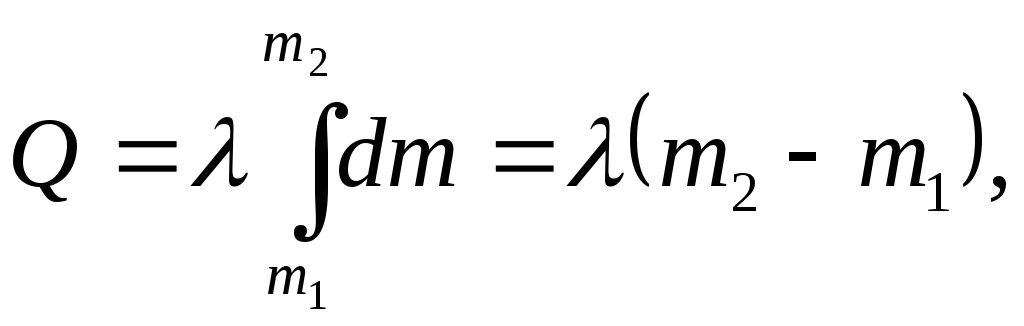
где m1 и m2 массы жидкости до и после процесса.
В частности, если плавится тело массы m, то перед процессом плавления масса жидкости была m1=0, после плавления m2= m. Теплота плавления
![]()
Перед отвердеванием вся масса вещества была жидкой, m1= m, а после кристаллизации масса жидкости m2=0. Тогда теплота отвердевания
![]()
Это соответствует
тому, что при плавлении количество
теплоты сообщается телу
![]() ,
а при отвердевании – отнимается у него
,
а при отвердевании – отнимается у него
![]() .
.
В подразделе 2.3.4 мы говорили, что достаточно «твердыми», кроме кристаллических, бывают аморфные тела. Аморфное состояние вещества можно получить из вязкой жидкости, если быстро ее охладить, не отнимая теплоты отвердевания. Тогда может получиться переохлажденная жидкость, достаточно твердая в обыденном смысле этого слова, но с неупорядоченным расположением частиц (стекло, аморфная сера и т.п.).
При нагревании аморфных тел температура постепенно увеличивается, вещество размягчается и становится жидким (без определенной температуры плавления).
Если такие вещества надолго предоставить самим себе, то теплота отвердевания постепенно выделится, структура вещества станет упорядоченной, и вещество кристаллизуется. При этом уменьшается потенциальная энергия взаимного расположения частиц и, следовательно, внутренняя энергия тела.
