
- •1 Оглавление
- •Часть 1
- •Молекулярная физика и термодинамика 84
- •Итоговые задания 130 предисловие
- •В добрый путь, читатель, – удачи!
- •Введение
- •Физическая картина мира
- •Математическое введение Углы
- •Скаляры и векторы
- •Натуральные логарифмы
- •Суммирование
- •Элементы дифференциального исчисления
- •Элементы интегрального исчисления
- •Глава 1 механика
- •Кинематика
- •Механическое движение
- •Вектор перемещения. Путь
- •Скорость
- •Ускорение
- •Равномерное и равнопеременное прямолинейные движения
- •Свободное падение тел
- •Равномерное движение точки по окружности
- •Вращательное движение абсолютно твердого тела вокруг неподвижной оси
- •Динамика движения материальной точки
- •Классическая механика. Границы ее применимости
- •Первый закон Ньютона. Инерциальные системы отсчета
- •Масса и импульс
- •Второй закон Ньютона
- •Третий закон Ньютона
- •Закон сохранения импульса
- •Механический принцип относительности Галилея – Ньютона
- •Силы тяготения
- •Силы упругости
- •Силы трения
- •Элементы динамики вращательного движения абсолютно твердого тела относительно неподвижной оси
- •Момент силы и момент инерции
- •Основной закон динамики вращательного движения
- •Статика
- •Работа и механическая энергия
- •Работа силы при движении материальной точки
- •Механическая энергия
- •Закон сохранения и превращения энергии
- •Мощность
- •Элементы гидроаэромеханики
- •Закон Паскаля
- •Закон Архимеда
- •Давление в движущейся среде
- •Внутреннее трение
- •Основы специальной теории относительности
- •Постулаты Эйнштейна
- •Интервалы длины и времени
- •Закон сложения скоростей
- •Энергия
- •Ответы на вопросы к главе 1
- •Глава 2 молекулярная физика и термодинамика
- •Основы молекулярно-кинетической теории вещества
- •Основные понятия и определения
- •Силы и потенциальная энергия взаимодействия двух молекул
- •О строении газообразных, жидких и твердых тел
- •Молекулярно-кинетическая теория идеальных газов
- •Идеальный газ
- •Распределение Максвелла – Больцмана
- •Распределение Больцмана
- •Средняя длина свободного пробега молекулы
- •Основное уравнение кинетической теории газов
- •Уравнение состояния идеального газа
- •Связь средней кинетической энергии поступательного движения молекул и температуры
- •Реальные газы
- •Свойства жидкостей и твердых тел
- •Поверхностный слой
- •Поверхностное натяжение
- •Лапласово давление
- •Твердое тело
- •Термодинамика
- •Внутренняя энергия системы
- •Внутренняя энергия идеального газа
- •Первое начало термодинамики
- •Калориметрия33
- •Работа газа
- •Цикл Карно. Второе начало термодинамики
- •Некоторые тепловые машины
- •Изменение агрегатного состояния вещества
- •Плавление. Кристаллизация
- •Парообразование. Конденсация. Испарение
- •Свойства паров
- •Кипение
- •Ответы на вопросы к главе 2
- •Итоговые задания
- •Часть 1
- •346500, Г. Шахты, Ростовская обл., ул. Шевченко, 147.
-
Реальные газы
Подобно газовым законам уравнение Клапейрона – Менделеева является уравнением состояния идеального газа и для реальных газов выполняется приближенно на сравнительно небольших интервалах температур и давлений.
В модели реального газа мы пренебрегли размерами молекул (по сравнению с размерами сосуда) и их взаимодействием на расстоянии.
Учтем теперь, что молекулы газа имеют какой-то объем. В уравнении
![]()
написанном
для идеального газа, молярный объем
![]() представлен движущимися молекулами
данного газа. Если же суммарный объем
самих молекул моля газа равен b,
то для движения молекул остается только
объем
представлен движущимися молекулами
данного газа. Если же суммарный объем
самих молекул моля газа равен b,
то для движения молекул остается только
объем
![]() ,
и уравнение примет вид
,
и уравнение примет вид
![]()
Давление газа по этому уравнению
![]()
Это давление результат ударов молекул газа о стенки сосуда, если, как было сказано, молекулы не взаимодействуют на расстоянии. На самом деле молекулы газа притягиваются друг к другу. Следовательно, непосредственно прилегающий к стенке слой молекул испытывает притяжение к остальным молекулам газа, направленное от стенки в глубь сосуда, в результате чего средняя сила удара молекул о стенку уменьшается. Поэтому в действительности давление будет меньше введенного нами, и уменьшение давления зависит от силы притяжения молекул друг к другу, которая в свою очередь зависит от расстояния между молекулами, т.е. от представленного молю объема. Другими словами, уменьшение давления должно быть обратно пропорционально объему моля в какой-то степени:
![]()
Голландский физик
Ван-дер-Ваальс экспериментально
определил, что n=2
и
![]() Таким образом, уравнение состояния
реального газа выглядит как
Таким образом, уравнение состояния
реального газа выглядит как
![]() ,
,
откуда
![]()
В этом уравнении Ван-дер-Ваальса коэффициенты а и b подобраны экспериментально для каждого газа. Это уравнение выполняется для реальных газов значительно точнее, чем уравнение (2.12). Еще раз напомним, что выведено оно для моля газа.
У равнение
Ван-дер-Ваальса –
это уравнение третьей степени относительно
равнение
Ван-дер-Ваальса –
это уравнение третьей степени относительно
![]() и, следовательно, имеет три корня, т.е.
при постоянной температуре и определенном
давлении у моля газа могут быть три
различных объема!
и, следовательно, имеет три корня, т.е.
при постоянной температуре и определенном
давлении у моля газа могут быть три
различных объема!
Если по точкам построить кривую, изображающую это уравнение при определенной температуре – изотерму Ван-дер-Ваальса (сплошная линия, рис. 2.3), то на ней будет целая область давлений, которым соответствуют три объема.
Сравним изотерму Ван-дер-Ваальса с экспериментальной изотермой реального газа (пунктир, рис. 2.3). Видим, что изотермы практически совпадают в областях I и III. В области II изотерма реального газа горизонтальна (давление постоянно). Область I соответствует жидкому состоянию, область III – насыщенному пару (газу), область II – двухфазной системе жидкость – насыщенный пар. К обсуждению свойств вещества в этих состояниях мы еще вернемся.
-
Свойства жидкостей и твердых тел
-
Поверхностный слой
-
Сравнивая плотности жидкостей и газов при нормальных условиях, легко заметить, что плотности и, следовательно, концентрации молекул в жидкостях больше, чем в газах.
Молекулы жидкости находятся гораздо ближе друг к другу, чем молекулы газа. Поэтому сильнее их взаимодействие, больше сказывается потенциальная энергия взаимодействия молекул.
В отличие от газа жидкость имеет определенный объем, очень слабо изменяющийся при всестороннем сжатии. В первом приближении можно принять модель несжимаемой жидкости. Назовем радиусом молекулярного действия наибольшее расстояние r0, на котором молекулы еще взаимодействуют, и с увеличением этого расстояния их взаимодействием можно пренебречь, а часть пространства, в котором заметно взаимодействие этой молекулы с другими – сферой молекулярного действия. В однородной среде это пространство ограниченно сферой радиусом r0. Рассмотрим молекулу, находящуюся в глубине жидкости (А, рис. 2.4). Симметричные молекулы из ее сферы молекулярного действия притягивают центральную с равными и противоположно направленными силами, так что равнодействующая всех сил взаимодействия, действующих на выбранную молекулу, равна нулю.
В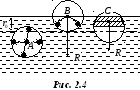 ыделим
молекулу на поверхности жидкости (В,
рис. 2.4). Все молекулы жидкости, действующие
на нее, можно перебрать попарно
симметрично относительно перпендикуляра
к поверхности, так что равнодействующие
их сил взаимодействия с данной молекулой
направлены по этому перпендикуляру.
Равнодействующая всех таких сил
направлена нормально поверхности в
глубь жидкости, так как аналогичная
равнодействующая со стороны молекул
пара гораздо меньше (концентрация
молекул пара в обычных условиях много
меньше концентрации молекул жидкости).
ыделим
молекулу на поверхности жидкости (В,
рис. 2.4). Все молекулы жидкости, действующие
на нее, можно перебрать попарно
симметрично относительно перпендикуляра
к поверхности, так что равнодействующие
их сил взаимодействия с данной молекулой
направлены по этому перпендикуляру.
Равнодействующая всех таких сил
направлена нормально поверхности в
глубь жидкости, так как аналогичная
равнодействующая со стороны молекул
пара гораздо меньше (концентрация
молекул пара в обычных условиях много
меньше концентрации молекул жидкости).
Опишем теперь сферу молекулярного действия вокруг любой молекулы (С, рис. 2.4) из поверхностного слоя – слоя жидкости около ее поверхности толщиной в радиус молекулярного действия. Все молекулы из заштрихованного симметричного шарового пояса можно попарно перебрать, как молекулы из сферы А. Равнодействующая их сил притяжения равна нулю. Все молекулы из незаштрихованных сегментов можно попарно перебрать, как молекулы из сферы В. Равнодействующая их сил взаимодействия направлена в глубь жидкости перпендикулярно ее поверхности (объемы сегментов одинаковы, концентрация в нижнем гораздо больше). Следовательно, на все молекулы поверхностного слоя действуют равнодействующие силы молекулярного взаимодействия, направленные в глубь жидкости нормально ее поверхности. Поэтому поверхностный слой производит на жидкость молекулярное давление. Под действием сил молекулярного давления молекулы, если могут, переходят из поверхностного слоя в глубь жидкости и поверхность жидкости становится минимальной для данных условий. Так, предоставленная самой себе жидкость принимает шарообразную форму – для тел заданного объема минимальную поверхность имеет шар (капля воды или маленькие капельки ртути). Молекулы поверхностного слоя обладают избыточной потенциальной энергией (по сравнению с «глубинными» молекулами). Поэтому наблюдаемая тенденция к уменьшению поверхности согласуется с обычным стремлением всякой механической системы к устойчивому равновесию, связанному с минимумом потенциальной энергии. Увеличение поверхности жидкости требует совершения определенной работы.
На Земле вода в сосуде имеет горизонтальную поверхность под действием силы тяжести. Действием молекулярного давления можно объяснить малую сжимаемость жидкости – она уже сжата значительными силами. Эти силы не передаются по закону Паскаля, действуют только на молекулы жидкости, а не на погруженные в нее тела.
