
- •1 Оглавление
- •Часть 1
- •Молекулярная физика и термодинамика 84
- •Итоговые задания 130 предисловие
- •В добрый путь, читатель, – удачи!
- •Введение
- •Физическая картина мира
- •Математическое введение Углы
- •Скаляры и векторы
- •Натуральные логарифмы
- •Суммирование
- •Элементы дифференциального исчисления
- •Элементы интегрального исчисления
- •Глава 1 механика
- •Кинематика
- •Механическое движение
- •Вектор перемещения. Путь
- •Скорость
- •Ускорение
- •Равномерное и равнопеременное прямолинейные движения
- •Свободное падение тел
- •Равномерное движение точки по окружности
- •Вращательное движение абсолютно твердого тела вокруг неподвижной оси
- •Динамика движения материальной точки
- •Классическая механика. Границы ее применимости
- •Первый закон Ньютона. Инерциальные системы отсчета
- •Масса и импульс
- •Второй закон Ньютона
- •Третий закон Ньютона
- •Закон сохранения импульса
- •Механический принцип относительности Галилея – Ньютона
- •Силы тяготения
- •Силы упругости
- •Силы трения
- •Элементы динамики вращательного движения абсолютно твердого тела относительно неподвижной оси
- •Момент силы и момент инерции
- •Основной закон динамики вращательного движения
- •Статика
- •Работа и механическая энергия
- •Работа силы при движении материальной точки
- •Механическая энергия
- •Закон сохранения и превращения энергии
- •Мощность
- •Элементы гидроаэромеханики
- •Закон Паскаля
- •Закон Архимеда
- •Давление в движущейся среде
- •Внутреннее трение
- •Основы специальной теории относительности
- •Постулаты Эйнштейна
- •Интервалы длины и времени
- •Закон сложения скоростей
- •Энергия
- •Ответы на вопросы к главе 1
- •Глава 2 молекулярная физика и термодинамика
- •Основы молекулярно-кинетической теории вещества
- •Основные понятия и определения
- •Силы и потенциальная энергия взаимодействия двух молекул
- •О строении газообразных, жидких и твердых тел
- •Молекулярно-кинетическая теория идеальных газов
- •Идеальный газ
- •Распределение Максвелла – Больцмана
- •Распределение Больцмана
- •Средняя длина свободного пробега молекулы
- •Основное уравнение кинетической теории газов
- •Уравнение состояния идеального газа
- •Связь средней кинетической энергии поступательного движения молекул и температуры
- •Реальные газы
- •Свойства жидкостей и твердых тел
- •Поверхностный слой
- •Поверхностное натяжение
- •Лапласово давление
- •Твердое тело
- •Термодинамика
- •Внутренняя энергия системы
- •Внутренняя энергия идеального газа
- •Первое начало термодинамики
- •Калориметрия33
- •Работа газа
- •Цикл Карно. Второе начало термодинамики
- •Некоторые тепловые машины
- •Изменение агрегатного состояния вещества
- •Плавление. Кристаллизация
- •Парообразование. Конденсация. Испарение
- •Свойства паров
- •Кипение
- •Ответы на вопросы к главе 2
- •Итоговые задания
- •Часть 1
- •346500, Г. Шахты, Ростовская обл., ул. Шевченко, 147.
-
Молекулярно-кинетическая теория идеальных газов
-
Идеальный газ
-
В молекулярно-кинетической теории рассматривается идеализированная модель реальных газов – идеальный газ.
Идеальным газом называется газ, между молекулами которого отсутствуют силы взаимного притяжения. Принимается, что при соударениях между собой и со стенками сосуда молекулы такого газа ведут себя как абсолютно упругие шарики конечных, но весьма малых размеров (модель упругих шариков). Существование конечных, хотя и малых размеров молекул связано с действием сил отталкивания между частицами. Резкое возрастание сил отталкивания при сближении молекул на малые расстояния не позволяет частицам проникнуть друг в друга и определяет конечные размеры молекул.
В общем курсе физики рассматривают идеальные газы, молекулы которых состоят из одного атома.
Существующие в действительности газы при не слишком низких температурах и достаточно малых давлениях – разреженные газы – по своим свойствам близки к идеальному газу. Например, гелий при комнатной температуре и атмосферном давлении с хорошим приближением подчиняется законам идеальных газов.
Движение каждой молекулы газа может быть описано законами механики Ньютона. Но число молекул в любом газе чрезвычайно велико, а силы, действующие между молекулами, таковы, что описание свойств громадной совокупности всех молекул законами механики оказывается невозможным. В таких случаях для исследования применяется статистический метод. С помощью особого математического аппарата – теории вероятностей – этим методом вычисляются средние значения физических величин, характеризующие движение всех молекул. Статистическим методом изучаются не только газы, но и жидкости, и твердые тела.
-
Распределение Максвелла – Больцмана
В статистическом методе в отличие от термодинамического существенным является предположение о «зернистой» структуре макротел. В этом методе используют следующие (подтверждаемые многочисленными опытами) положения: все макротела состоят из микрообъектов; микрообъекты участвуют в хаотическом движении; микрообъекты взаимодействуют между собой. В классической статистической физике предполагают, что два одинаковых микрообъекта не тождественны. Поведение одной микрочастицы (материальной точки) рассматривают в шестимерном фазовом пространстве (μ-пространстве) координат (x, y, z) и проекций вектора импульса (px, py, pz) или вектора скорости (vx, vy, vz). Ее состояние определяется точкой в этом пространстве. Если микрочастица движется хаотически, то ее нахождение в элементе объема dτ=dxdydzdpxdpydpz этого пространства является случайным событием, вероятность которого
dω=f(x, y, z, px, py, pz) dτ, (2.1)
где f – функция распределения (плотность вероятности).
Функция f удовлетворяет условию нормировки
![]() . (2.2)
. (2.2)
В (2.2) интегрирование производится по всему фазовому пространству. С
помощью функции f можно определить среднее значение некоторой функции φ(x, y, z, px, py, pz):
![]() . (2.3)
. (2.3)
Распределение Максвелла – Больцмана молекул в μ-пространстве имеет вид
![]() , (2.4)
, (2.4)
где
![]() потенциальная
энергия молекулы.
потенциальная
энергия молекулы.
Распределение Максвелла – Больцмана можно рассматривать как два независимых распределения в трехмерном пространстве импульсов (распределение Максвелла)
![]() , (2.5)
, (2.5)
и в трехмерном пространстве координат (распределение Больцмана)
![]() , (2.6)
, (2.6)
где А и В – постоянные, определяемые из условия нормировки (2.2).
учитывая это условие, получаем распределение Максвелла:
![]() . (2.7)
. (2.7)
Из распределения Максвелла (2.7) можно
получить распределение по компонентам
скоростей
![]()
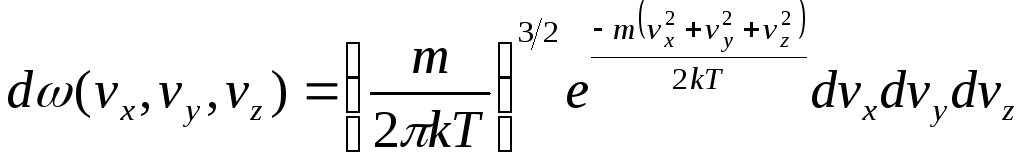 , (2.8)
, (2.8)
распределение по модулю скорости v
![]() , (2.9)
, (2.9)
распределение
по кинетической энергии
![]()
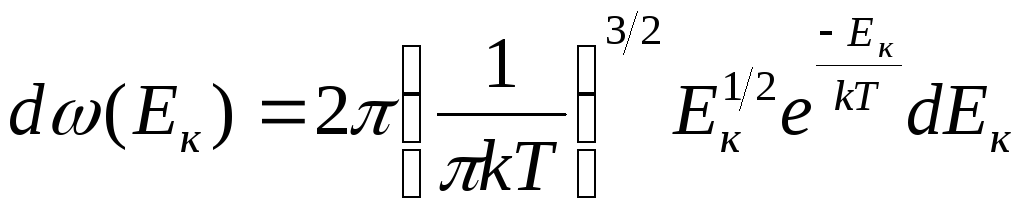 (2.10)
(2.10)
и другие распределения.
В состоянии термодинамического равновесия макросостояние системы, состоящей из N частиц, характеризуется сравнительно не-большим числом макропараметров (физических величин, которые можно определить путем измерения из эксперимента), имеющих определенное, независящее от времени значение. Вследствие хаотического движения частиц их положение и скорости непрерывно изменяются. Следовательно, изменяются микросостояния системы, в то время как макропараметры остаются постоянными. Таким образом, одному и тому же макросостоянию соответствует множество микросостояний. Поэтому любые макроскопические величины зависят от микроскопических параметров. В статистической физике принимается, что наблюдаемые экспериментально физические величины (макропараметры) могут быть найдены как среднее значения, вычисленные по множеству допустимых микросостояний (см. 2.3). Вследствие этого одной из основных задач, решаемых статистическим методом, является нахождение средних значений различных физических величин и определение среднего числа dN (из данных N), обладающих некоторым свойством.
Для совокупности всех молекул удобно ввести некоторые средние скорости, характеризующие газ при данной температуре Т.
а) Средняя
арифметическая
скорость
движения
молекул
![]() по модулю равна
по модулю равна
![]() ,
,
где ![]() общее число молекул.
общее число молекул.
Величина средней арифметической скорости движения молекул
![]() ,
,
где ![]() универсальная газовая постоянная22;
универсальная газовая постоянная22;
![]() молярная масса.
молярная масса.
б) Средняя квадратичная скорость
![]() движения молекул
движения молекул
![]() ,
,
![]() .
.
Здесь
![]() – средний квадрат скорости движения
молекул.
– средний квадрат скорости движения
молекул.
