
- •1 Оглавление
- •Часть 1
- •Молекулярная физика и термодинамика 84
- •Итоговые задания 130 предисловие
- •В добрый путь, читатель, – удачи!
- •Введение
- •Физическая картина мира
- •Математическое введение Углы
- •Скаляры и векторы
- •Натуральные логарифмы
- •Суммирование
- •Элементы дифференциального исчисления
- •Элементы интегрального исчисления
- •Глава 1 механика
- •Кинематика
- •Механическое движение
- •Вектор перемещения. Путь
- •Скорость
- •Ускорение
- •Равномерное и равнопеременное прямолинейные движения
- •Свободное падение тел
- •Равномерное движение точки по окружности
- •Вращательное движение абсолютно твердого тела вокруг неподвижной оси
- •Динамика движения материальной точки
- •Классическая механика. Границы ее применимости
- •Первый закон Ньютона. Инерциальные системы отсчета
- •Масса и импульс
- •Второй закон Ньютона
- •Третий закон Ньютона
- •Закон сохранения импульса
- •Механический принцип относительности Галилея – Ньютона
- •Силы тяготения
- •Силы упругости
- •Силы трения
- •Элементы динамики вращательного движения абсолютно твердого тела относительно неподвижной оси
- •Момент силы и момент инерции
- •Основной закон динамики вращательного движения
- •Статика
- •Работа и механическая энергия
- •Работа силы при движении материальной точки
- •Механическая энергия
- •Закон сохранения и превращения энергии
- •Мощность
- •Элементы гидроаэромеханики
- •Закон Паскаля
- •Закон Архимеда
- •Давление в движущейся среде
- •Внутреннее трение
- •Основы специальной теории относительности
- •Постулаты Эйнштейна
- •Интервалы длины и времени
- •Закон сложения скоростей
- •Энергия
- •Ответы на вопросы к главе 1
- •Глава 2 молекулярная физика и термодинамика
- •Основы молекулярно-кинетической теории вещества
- •Основные понятия и определения
- •Силы и потенциальная энергия взаимодействия двух молекул
- •О строении газообразных, жидких и твердых тел
- •Молекулярно-кинетическая теория идеальных газов
- •Идеальный газ
- •Распределение Максвелла – Больцмана
- •Распределение Больцмана
- •Средняя длина свободного пробега молекулы
- •Основное уравнение кинетической теории газов
- •Уравнение состояния идеального газа
- •Связь средней кинетической энергии поступательного движения молекул и температуры
- •Реальные газы
- •Свойства жидкостей и твердых тел
- •Поверхностный слой
- •Поверхностное натяжение
- •Лапласово давление
- •Твердое тело
- •Термодинамика
- •Внутренняя энергия системы
- •Внутренняя энергия идеального газа
- •Первое начало термодинамики
- •Калориметрия33
- •Работа газа
- •Цикл Карно. Второе начало термодинамики
- •Некоторые тепловые машины
- •Изменение агрегатного состояния вещества
- •Плавление. Кристаллизация
- •Парообразование. Конденсация. Испарение
- •Свойства паров
- •Кипение
- •Ответы на вопросы к главе 2
- •Итоговые задания
- •Часть 1
- •346500, Г. Шахты, Ростовская обл., ул. Шевченко, 147.
-
Первое начало термодинамики
Мерой, переданной при теплообмене внутренней энергии является количество теплоты. Количество теплоты – не запас, а именно мера переданной внутренней энергии. У тела нет количества теплоты до или после теплообмена, до или после этого процесса есть определенные запасы внутренней энергии (U1 и U2), их разность равна полученному или отданному при теплообмене количеству теплоты.
Практически изменение внутренней энергии может быть осуществлено всего двумя принципиально различными способами: совершением работы и теплообменом.
В первом случае изменение внутренней энергии равно работе внешних сил:
![]()
(![]() работа
системы над
внешними телами).
работа
системы над
внешними телами).
Во втором случае изменение внутренней энергии равно количеству теплоты, переданному системе:
![]() .
.
В общем случае происходит суммарное изменение внутренней энергии31:
![]() .
.
Найдем количество теплоты, переданное системе извне в процессе теплообмена:
![]() .
.
Количество теплоты, переданное системе, увеличивает ее внутреннюю энергию и превращается в работу, совершаемую системой против внешних сил, - первое начало термодинамики или наиболее общая формулировка закона сохранения и превращения энергии32.
-
Калориметрия33
Если веществу передается какое-либо количество теплоты (в любой форме), то изменяется его температура (за исключением изотермических процессов). Характеристиками такого изменения являются различные теплоемкости.
Пусть
![]() количество теплоты, необходимое для
изменения температуры тела от Т
до T+dT.
Теплоемкость тела измеряется
отношением этого количества теплоты
к изменению температуры:
количество теплоты, необходимое для
изменения температуры тела от Т
до T+dT.
Теплоемкость тела измеряется
отношением этого количества теплоты
к изменению температуры:
![]() .
.
Теплоемкость единицы массы называется удельной теплоемкостью данного вещества:
![]() .
.
Теплоемкость одного моля вещества называется молярной теплоемкостью данного вещества:
![]() .
.
Удельная и молярная теплоемкости
вещества зависят от характера процесса
передачи энергии (в частности для газа
различают теплоемкости при постоянном
давлении
![]() и при постоянном объеме
и при постоянном объеме
![]() )
и, в общем случае, от температуры. Поэтому
интервал температуры выбран вблизи
определенной температуры Т.
)
и, в общем случае, от температуры. Поэтому
интервал температуры выбран вблизи
определенной температуры Т.
Количество теплоты, необходимое для изменения температуры массы т данного вещества от Т до T+dT:
![]() .
.
Если зависимостью теплоемкости от температуры можно пренебречь, то для конечного интервала температур
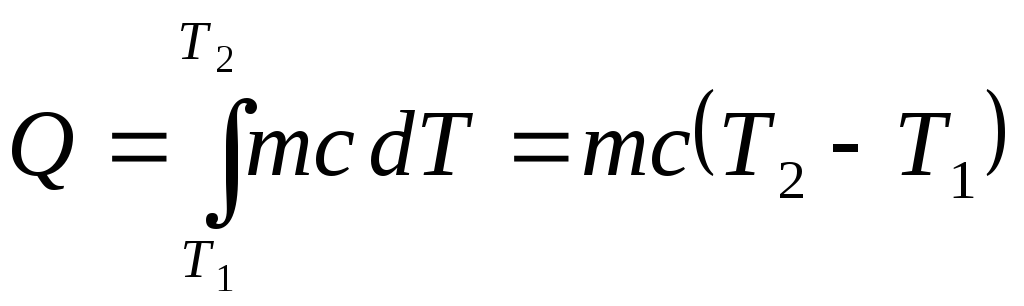 .
.
Рассмотрим некоторую систему тел, в которой не происходит никаких превращений энергии, кроме теплообмена. Для этой системы
![]() и
и
![]() .
.
В процессе теплообмена внутренняя энергия одних тел увеличивается, других – уменьшается, мерой этого изменения является количество теплоты, которое данное тело получило или отдало в процессе теплообмена.
Если система охватывает все тела, участвующие в теплообмене, то первое начало термодинамики, или, что то же самое, закон сохранения и превращения энергии, можно записать в виде уравнения теплового баланса.
![]() .
.
Алгебраическая сумма количеств
теплоты, отданных и полученных всеми
телами, участвующими в теплообмене,
равна нулю. Здесь
![]() означает получение соответствующей
порции внутренней энергии телами –
нагревание,
означает получение соответствующей
порции внутренней энергии телами –
нагревание,
![]() – наоборот, остывание.
– наоборот, остывание.
