
- •Федеральное агентство по образованию
- •Кафедра физики физика. Часть 1 Учебно-методический комплекс
- •1. Информация о дисциплине
- •1.1. Предисловие
- •Содержание дисциплины «Физика. Часть 1»
- •Содержание дисциплины «Физика. Часть 1» по гос
- •Объем дисциплины и виды учебной работы по курсу физики на I семестре 2 курса
- •2. Рабочие учебные материалы
- •2.1. Рабочая программа (110 часов)
- •2.1.1. Физические основы механики
- •2.1.2. Молекулярная и статистическая физика, термодинамика
- •2.2. Тематический план дисциплины «Физика, часть 1»
- •3. Структурно-логическая схема дисциплины
- •2.4. Временной график изучения 1 части курса физики
- •2.5. Практический блок Практические занятия (все формы обучения)
- •Лабораторные работы (все формы обучения)
- •Информационные ресурсы дисциплины
- •Библиографический список
- •Опорный конспект лекций по дисциплине
- •3.2.1. Физические основы механики
- •3.2.1.1. Элементы кинематики материальной точки
- •Вопросы для самопроверки
- •3.2.1.2. Динамика материальной точки и системы материальных
- •Пример 2
- •Вопросы для самопроверки
- •3.2.1.3. Работа и энергия
- •Пример 3
- •Вопросы для самопроверки
- •3.2.1.4. Элементы динамики вращательного движения твердого тела
- •Пример 4
- •3.2.1.5. Элементы механики жидкости и газа
- •Ламинарное течение
- •Уравнение Бернулли
- •Вопросы для самопроверки
- •3.2.1.6. Элементы релятивистской механики
- •Пример 5
- •Физические основы механики
- •3.2.2. Молекулярная физика и термодинамика
- •3.2.2.1. Кинетические явления и теория идеальных газов
- •Работа газа, нагреваемого при постоянном объеме, равна нулю:
- •Вопросы для самопроверки
- •3.2.2.2. Основы классической статистической физики
- •Вопросы для самопроверки
- •3.2.2.3. Реальные газы. Уравнение Ван-дер-Ваальса
- •Вопросы для самопроверки
- •3.2.2.4. Основы термодинамики
- •Определяем изменение энтропии в этом процессе
- •Вопросы для самопроверки
- •3.2.2.5. Термодинамика макросистем
- •Молекулярная и статистическая физика. Термодинамика
- •Глоссарий
- •4. Блок контроля освоения дисциплины
- •4.1. Методические указания к выполнению контрольной работы №1
- •Контрольная работа №1 «Физические основы механики»
- •4.3. Задание на контрольную работу №1
- •4.4. Методические указания к выполнению контрольной работы №2
- •4.5. Контрольная работа №2 «Молекулярная физика, элементы термодинамики»
- •4.6. Задание на контрольную работу №2
- •Некоторые астрономические величины
- •3. Некоторые соотношения между единицами измерения
- •4. Множители и приставки для образования десятичных кратных и дольных единиц и их наименования
- •5. Греческий алфавит
- •6. Некоторые физические постоянные (округленные значения)
- •7. Относительные атомные массы некоторых элементов
- •8. Некоторые физические постоянные (округленные значения)
- •4.8. Вопросы к зачету
- •Содержание
- •1.1. Предисловие……………………………………………………………3
- •191186, Санкт-Петербург, ул. Миллионная, 5
Вопросы для самопроверки
-
Дайте определение вероятности получения некоторого результата измерения.
-
Дайте определение элементарной вероятности при измерении величины скорости.
-
Что такое функция распределения?
-
Как связаны функции распределения величины и проекции скорости?
-
Каковы особенности графика функции распределения величины скорости для молекул идеального газа?
-
Как вычисляется среднее значение некоторой физической величины А, если известна ее функция распределения f(A)?
-
Напишите формулу для вычисления среднего значения скорости молекул.
-
Напишите формулу для вычисления средней квадратичной скорости молекул.
-
Напишите условие для вычисления наиболее вероятной скорости молекул.
-
Напишите выражение для средней скорости молекул идеального газа.
-
Напишите выражение для средней квадратичной скорости молекул идеального газа.
-
Напишите выражение для наиболее вероятной скорости молекул идеального газа.
-
Вычислите, на сколько процентов отличаются средняя и средняя квадратичная скорости молекул идеального газа.
-
Вычислите, на сколько процентов отличаются средняя и наиболее вероятная скорости молекул идеального газа.
3.2.2.3. Реальные газы. Уравнение Ван-дер-Ваальса
Идеальный газ, для которого нами рассмотрены основные законы, представляет собой совокупность невзаимодействующих молекул. Эта модель может быть принята и для реальных разреженных газов. С повышением давления свойства реальных газов начинают отличаться от свойств идеальных газов.
Причина отличия свойств заключается в существовании сил отталкивания и притяжения между молекулами. Силы отталкивания возникают в связи с тем, что газовые молекулы имеют конечные размеры. Силы притяжения между молекулами вызывают изменение давления газа в сосуде. Эти силы были учтены Ван-дер-Ваальсом при выводе уравнения реального газа. Рассмотрим действие этих сил.
Сила отталкивания
Молекулы газа, имеющие различные кинетические энергии, не могут сблизиться на расстояние, меньшее эффективного диаметра молекул. Поэтому часть объема оказывается недоступной для молекул газа. Эту недоступную часть объема нужно вычесть из общего объема сосуда. Обозначим эту часть объема через b и запишем уравнение состояния для одного моля газа с поправкой на этот объем:
p(V-b)=RT. (3.147)
Расчет показывает, что величина b равна учетверенному объему газовых молекул, содержащихся в одном моле. Размерность b равна размерности объема.
Сила притяжения
Сила взаимного притяжения между молекулами приводит к ослаблению интенсивности давления на стенки сосуда. Поэтому давление реального газа следует уменьшить на величину р'. С учетом формулы (3.147) получим:
 .
(3.148)
.
(3.148)
Для расчета можно воспользоваться следующими рассуждениями. Давление газа определяется концентрацией частиц n в прилегающем к стенке слое газа. Сила притяжения со стороны соседнего слоя, рассчитанная на единицу площади, пропорциональна концентрации молекул в обоих слоях ~n2, т. е. пропорциональна квадрату плотности газа или обратно пропорциональна квадрату объема газа:
![]() .
.
С учетом коэффициента пропорциональности для одного моля получается
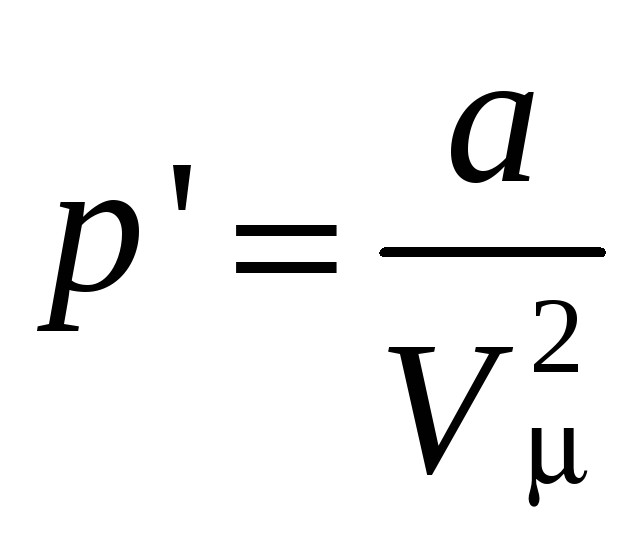 ,
(3.149)
,
(3.149)
где а - коэффициент, зависящий от природы газа.
В итоге получается уравнение Ван-дер-Ваальса для одного моля реального газа
 .
(3.150)
.
(3.150)
Если под р
понимать внешнее давление, оказываемое
на газ, то p'
добавляется к внешнему давлению, т. е.
газ как бы оказывается дополнительно
сжатым. Для произвольной массы газа
уравнение Ван-дер-Ваальса получается
путем обобщения выражения (3.150), если
это уравнение
умножить
на число молей
![]() .
Следует также учесть, что
.
Следует также учесть, что
 .
Тогда получим
.
Тогда получим
 .
(3.151)
.
(3.151)
Это и есть уравнение Ван-дер-Ваальса. Это уравнение нельзя считать абсолютно точным, так как отсутствует способ точного определения сил взаимодействия между молекулами газа.
Изотермы реальных газов
Уравнение Ван-дер-Ваальса (3.151) является кубическим (т. е. уравнением третьей степени) относительно объема. Поэтому в отличие от изотермы идеального газа, имеющей вид гиперболы, изотерма Ван-дер-Ваальса, т. е. кривая, соответствующая уравнению (3.151), имеет области с максимумом и минимумом, где каждому значению давления соответствуют три значения объема. Эта изотерма представляет собой, по существу, график, изображающий решение уравнения (3.151).
Семейство таких изотерм для углекислого газа, находящегося при различных температурах, представлено на рис.3.23. Из этого графика видно, что, действительно, имеется некоторая область, в которой одному значению давления соответствуют три значения объема. В этой области находятся изотермы, рассчитанные для температур 250, 270 и 290 К.
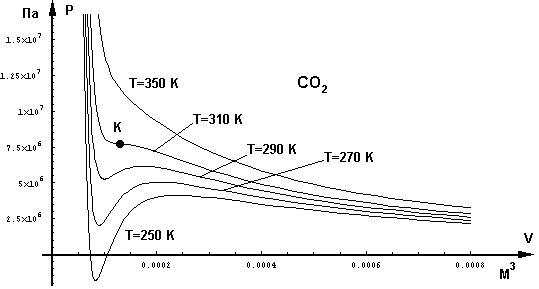
Рис. 3.23
Однако уже при 310 К изотерма имеет лишь точку перегиба, но не имеет трех корней. Эта изотерма критическая, и точка перегиба К называется критической точкой. Температура критической изотермы также называется критической температурой ТК. Все изотермы, находящиеся выше критической, перегибов не имеют и приближаются к изотермам идеального газа, описываемым обычным уравнением Клапейрона. Для всех температур ниже критической на изотермах, построенных по уравнению Ван-дер-Ваальса, изгиб выражен тем резче, чем ниже температура.
Однако экспериментальные изотермы отличаются от изотерм, представленных на рис. 3.23. Противоречие между теоретическими и экспериментальными кривыми заключается в том, что последние вместо волнового изгиба имеют прямолинейный участок (рис. 3.24).
Действительно, в реальности не может такого быть, чтобы при одном и том же давлении вещество находилось при нескольких объемах. Что же происходит при температурах ниже критической?
Горизонтальный участок изотермы b - d является областью фазового перехода, областью, в которой насыщенный пар находится в равновесии с жидкостью и постепенно, по мере уменьшения объема, переходит в жидкую фазу. То есть в этой области реальные изотермы совпадают с изобарами и фазовый переход из газообразного состояния в жидкое происходит при постоянном давлении. Выше области фазового перехода, на участке е-d , мы имеем газ, сжимаемый легко - кривая идет полого. Ниже области фазового перехода, на участке b-a, кривая идет очень круто, что соответствует трудносжимаемой жидкости.
Изгиб теоретической изотермы на участке b - d определяет неустойчивые так называемые метастабильные состояния. Эти метастабильные состояния, действительно, существуют. В точке d газ превращается в насыщенный пар. Состояние, которое характеризуется участком изотермы слева от точки d, отличается от насыщенного пара повышенной плотностью и повышенным давлением. Здесь мы имеем перенасыщенный пар.
Увеличение жидкой фазы происходит путем конденсации насыщенного пара вокруг центров конденсации. Центрами конденсации могут служить мельчайшие капельки жидкой фазы или примеси в виде микроскопических пылинок или ионизированных молекул газа.
Прямой участок экспериментальной изотермы располагается таким образом, что заштрихованные площади ниже участка b - c и выше участка c - d равны друг другу.

Рис. 3.24
Для сравнения на графике приведена изотерма идеального газа, соответствующая этой же температуре.
Из рис. 3.24 видно, что при температурах выше критической фазовый переход происходить не может - при любом сжатии газа он в жидкость не переходит. В этих условиях изотермы реального газа мало отличаются от изотерм идеального газа.
