
- •Федеральное агентство по образованию
- •Кафедра физики физика. Часть 1 Учебно-методический комплекс
- •1. Информация о дисциплине
- •1.1. Предисловие
- •Содержание дисциплины «Физика. Часть 1»
- •Содержание дисциплины «Физика. Часть 1» по гос
- •Объем дисциплины и виды учебной работы по курсу физики на I семестре 2 курса
- •2. Рабочие учебные материалы
- •2.1. Рабочая программа (110 часов)
- •2.1.1. Физические основы механики
- •2.1.2. Молекулярная и статистическая физика, термодинамика
- •2.2. Тематический план дисциплины «Физика, часть 1»
- •3. Структурно-логическая схема дисциплины
- •2.4. Временной график изучения 1 части курса физики
- •2.5. Практический блок Практические занятия (все формы обучения)
- •Лабораторные работы (все формы обучения)
- •Информационные ресурсы дисциплины
- •Библиографический список
- •Опорный конспект лекций по дисциплине
- •3.2.1. Физические основы механики
- •3.2.1.1. Элементы кинематики материальной точки
- •Вопросы для самопроверки
- •3.2.1.2. Динамика материальной точки и системы материальных
- •Пример 2
- •Вопросы для самопроверки
- •3.2.1.3. Работа и энергия
- •Пример 3
- •Вопросы для самопроверки
- •3.2.1.4. Элементы динамики вращательного движения твердого тела
- •Пример 4
- •3.2.1.5. Элементы механики жидкости и газа
- •Ламинарное течение
- •Уравнение Бернулли
- •Вопросы для самопроверки
- •3.2.1.6. Элементы релятивистской механики
- •Пример 5
- •Физические основы механики
- •3.2.2. Молекулярная физика и термодинамика
- •3.2.2.1. Кинетические явления и теория идеальных газов
- •Работа газа, нагреваемого при постоянном объеме, равна нулю:
- •Вопросы для самопроверки
- •3.2.2.2. Основы классической статистической физики
- •Вопросы для самопроверки
- •3.2.2.3. Реальные газы. Уравнение Ван-дер-Ваальса
- •Вопросы для самопроверки
- •3.2.2.4. Основы термодинамики
- •Определяем изменение энтропии в этом процессе
- •Вопросы для самопроверки
- •3.2.2.5. Термодинамика макросистем
- •Молекулярная и статистическая физика. Термодинамика
- •Глоссарий
- •4. Блок контроля освоения дисциплины
- •4.1. Методические указания к выполнению контрольной работы №1
- •Контрольная работа №1 «Физические основы механики»
- •4.3. Задание на контрольную работу №1
- •4.4. Методические указания к выполнению контрольной работы №2
- •4.5. Контрольная работа №2 «Молекулярная физика, элементы термодинамики»
- •4.6. Задание на контрольную работу №2
- •Некоторые астрономические величины
- •3. Некоторые соотношения между единицами измерения
- •4. Множители и приставки для образования десятичных кратных и дольных единиц и их наименования
- •5. Греческий алфавит
- •6. Некоторые физические постоянные (округленные значения)
- •7. Относительные атомные массы некоторых элементов
- •8. Некоторые физические постоянные (округленные значения)
- •4.8. Вопросы к зачету
- •Содержание
- •1.1. Предисловие……………………………………………………………3
- •191186, Санкт-Петербург, ул. Миллионная, 5
3.2.2.1. Кинетические явления и теория идеальных газов
Молекулярная физика изучает строение и свойства вещества, исходя из молекулярно-кинетических представлений, когда любое тело (твердое, жидкое или газообразное) состоит из большого числа молекул или атомов, находящихся в беспорядочном непрерывном движении.
Эти свойства (давление, температура и т. д.)тел наблюдаются на опыте, как суммарный результат взаимодействия молекул. При этом в молекулярной физике изучается движение, не сводимое к механическому. Для описания закономерностей молекулярного движения используются методы статистической физики, описывающие не движение отдельных молекул, а лишь средние величины, которые характеризуют движение огромной совокупности частиц. В зависимости от агрегатного состояния (газ, жидкость, твердое тело), вещество по-разному ведет себя при внешних воздействиях.
Простейшая модель - идеальный газ, т.е. совокупность материальных точек, не взаимодействующих между собой и обладающих лишь кинетической энергией.
Состояние - совокупность его свойств. Параметры состояния тела - величины, характеризующие его состояние и изменяющиеся под влиянием внешних воздействий - объема V, температуры Т и давления р.
Если параметры в разных точках тела неодинаковы, то такое состояние называется неравновесным. Если тело изолировать от других тел, то эти параметры выравниваются.
Состояние системы, при котором все ее параметры сохраняются постоянными неограниченно долго при изменении внешних условий, называется равновесным состоянием.
Связь между параметрами устанавливается уравнением состояния идеального газа, которое является обобщением опытных газовых законов Гей-Люссака и Бойля—Мариотта. Рис. 3.19 иллюстрирует процесс перехода из одного состояния в другое по схеме: сначала изотермический переход из состояния 1 в состояние 1', а затем изохорический переход из состояния 1' в состояние 2. В состоянии 1 параметры газа p1, V1 , Т1 , в состоянии 2 - p2, V2, Т2

Р
Рис.3.19
Точки системы, находящейся в состояниях 1 и 1', лежат на одной и той же изотерме, и согласно закону Бойля—Мариотта:
![]() .
(3.109)
.
(3.109)
Точки, определяющие состояния 1' и 2, принадлежат одной изохоре:
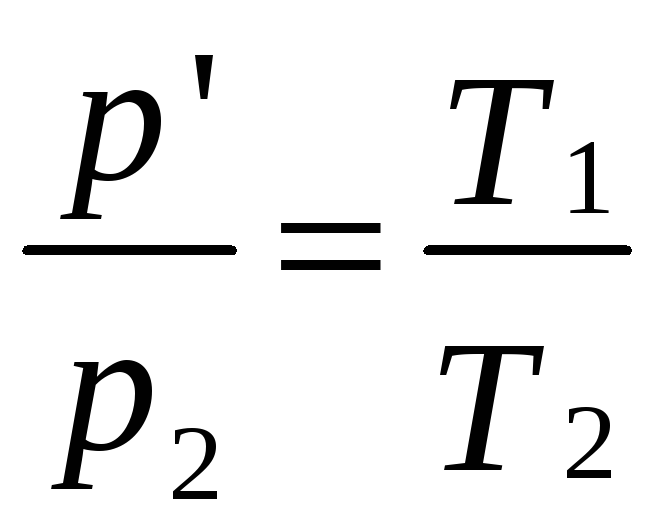 .
(3.110)
.
(3.110)
Исключая давление р' , можно получить объединенный газовый закон Клапейрона:
![]() .
(3.111)
.
(3.111)
Согласно закону Авогадро один моль любого газа занимает при одинаковых условиях (одинаковых температуре, давлении) один и тот же объем. Поэтому значение R для одного моля любого газа будет одинаково и называется универсальной газовой постоянной. Нормальное состояние газа в системе СИ: р = 1,01·10 5 Па; V= 22,4 ·10-3 м3/моль; T = О°С=273 К. Поэтому
 .
.
Для произвольной массы идеального газа получается уравнение Менделеева —Клапейрона:
 .
(3.112)
.
(3.112)
Основное уравнение молекулярно-кинетической теории газов устанавливает связь между макроскопическим параметром (давлением газа в сосуде) и микроскопическим параметром - средней кинетической энергией газовых молекул. Если считать столкновение молекул газа со стенками абсолютно упругим, то давление на стенки сосуда определится ударами частиц, отскакивающих от стенок без изменения величины скорости. Вследствие хаотичности движения частиц число ударяющихся частиц и их скорости будут различны в отдельные моменты времени. Давление, оказываемое газом на стенки сосуда, представляет собой средний импульс силы от ударов молекул газа, приходящийся в единицу времени на единицу площади стенки.
Основное уравнение молекулярно-кинетической теории газов
![]() (3.113)
(3.113)
устанавливает связь между макроскопическим параметром - давлением и микроскопическим - средней кинетической энергией молекул газа. Это уравнение выведено приближенно с использованием следующих допущений:
-
Движение молекул возможно только в трех взаимно перпендикулярных направлениях.
2. В каждом из направлений движется 1/3 всех молекул.
-
При каждом ударе молекул газа о стенку они передают стенке импульс. При этом считается, что движение молекулы нормально к стенке и удар абсолютно упругий.
Умножив левую и правую ее части на объем одного моля газа, получим
![]() ,
(3.114)
,
(3.114)
где nV=NА - число частиц в одном моле, равное числу Авогадро. Отсюда
 ,
(3.115)
,
(3.115)
где отношение
 представляет собой постоянную
Больцмана.
Т. е. средняя
кинетическая энергия поступательного
движения молекул идеального газа
пропорциональна абсолютной температуре.
представляет собой постоянную
Больцмана.
Т. е. средняя
кинетическая энергия поступательного
движения молекул идеального газа
пропорциональна абсолютной температуре.
Физический смысл абсолютной температуры: она является количественной мерой средней кинетической энергии поступательного движения молекул.
Кинетическая энергия поступательного движения всех частиц NA в одном моле газа
![]() ,
(3.116)
,
(3.116)
а для произвольной массы газа m, содержащей (m/) молей:
 .
(3.117)
.
(3.117)
Из (3.113) и (3.115) следует, что давление газа пропорционально его температуре:
![]() ,
(3.118)
,
(3.118)
Если газ представляет собой смесь, содержащую в единице объема n1 молекул одного газа, n2 - второго, n3 - третьего и т.д., то общее число молекул в единице объема равно
![]() .
(3.119)
.
(3.119)
Из (3.118) и (3.119) получается закон Дальтона:
 .
(3.120)
.
(3.120)
Давление смеси идеальных газов равно сумме парциальных давлений газов, образующих смесь. Давления p1, р2,.. .рN называются парциальными давлениями.
Внутренняя энергия системы
Внутренней энергией системы (некоторой массы газа) называется суммарная кинетическая энергия хаотического теплового движения молекул. Она является функцией состояния. Это означает, что внутренняя энергия системы, которая находится в данном состоянии, принимает присущее этому состоянию значение, независимо от того, что происходило в системе ранее.
Следовательно, изменение внутренней энергии при переходе системы из одного состояния в другое будет всегда равно разности значений внутренней энергии в этих состояниях, независимо от пути, по которому совершается переход.
Средняя
кинетическая энергия поступательного
движения, одной молекулы идеального
газа равна
![]() .
При рассмотрении двухатомных, трехатомных
и многоатомных молекул, кроме
поступательного движения следует
учитывать также вращательное и
колебательное движения. При этом
вводится понятие числа
степеней свободы,
под которым понимается минимальное
число независимых координат, полностью
определяющих положение тела в пространстве.
Если все виды движения равновероятны,
то на одну степень свободы приходится
количество энергии
.
При рассмотрении двухатомных, трехатомных
и многоатомных молекул, кроме
поступательного движения следует
учитывать также вращательное и
колебательное движения. При этом
вводится понятие числа
степеней свободы,
под которым понимается минимальное
число независимых координат, полностью
определяющих положение тела в пространстве.
Если все виды движения равновероятны,
то на одну степень свободы приходится
количество энергии
 .
.
Если молекула
имеет i
степеней свободы, то ее средняя энергия
равна
![]() и внутренняя энергия одного моля
идеального газа равна
и внутренняя энергия одного моля
идеального газа равна
![]() ,
(3.121)
,
(3.121)
а внутренняя энергия произвольной массы газа
 .
(3.122)
.
(3.122)
Теплоемкость газов
Для повышения температуры тела, масса которого равна m, на величину ΔT необходимо затратить количество тепла:
Q=cmT, (3.123)
где с — удельная теплоемкость вещества, под которой подразумевают физическую величину, равную количеству тепла, необходимому для нагревания единицы массы вещества на T=1К.
Для одного моля газа вводится молярная теплоемкость C. Под молярной теплоемкостью подразумевается физическая величина, численно равная количеству тепла, которое необходимо сообщить одному молю этого вещества, чтобы поднять его температуру на 1К.
Количество тепла, необходимое для нагревания нескольких молей газа на один Кельвин:
 .
(3.124)
.
(3.124)
Соотношение между удельной и молярной теплоемкостями
С=с. (3.125)
Величина теплоемкости газа зависит от условий, при которых она измеряется. Нагрев может идти при постоянном объеме или при постоянном давлении, и при этом теплоемкости называются соответственно теплоемкостью при постоянном объеме CV и теплоемкостью при постоянном давлении СP.
-
V=const . Если газ нагревается при постоянном объеме, то тепло, подводимое к газу, идет лишь на его нагревание, т. е. на увеличение внутренней энергии, поскольку работа против действия внешних сил не производится:
![]()
Тогда
для
![]() получим
получим
![]() ;
;
 . (3.126)
. (3.126)
Молярная теплоемкость газа при постоянном объеме определяется числом степеней свободы его молекул и по классической теории теплоемкость газа не зависит от температуры.
-
p=const. При нагревании газа при постоянном давлении этот газ расширяется. Сообщаемое ему тепло идет не только на увеличение его внутренней энергии, но и на совершение работы против сил внешнего давления. Поэтому теплоемкость СP должна быть выше теплоемкости CV на величину, равную работе A, которую совершает один моль газа при расширении:
![]() .
(3.127)
.
(3.127)
Для 1 моля газа, находящегося при температуре Т и давлении р в цилиндре с поршнем, площадь которого равна S, работа A, которая совершается против действия сил внешнего давления при перемещении поршня на малое расстояниеl и при соответствующем увеличении объема газа на величину V за счет подводимого тепла Qp, определится так:
A=Fl=pSl=pV=RT. (3.128)
Таким образом, при нагревании 1 моля газа при постоянном давлении на 1 Кельвин работа численно равна универсальной газовой постоянной:
A=R. (3.129)
Теперь из (3.127) получим
Cp=CV+R
=![]() .
(3.130)
.
(3.130)
Отношение этих теплоемкостей для каждого газа
 (3.131)
(3.131)
является
характеристикой газа и зависит только
от числа степеней свободы молекул этого
газа. Для различных по своему составу
газов, но имеющих одинаковое число
атомов в молекулах, это отношение
одинаково. Так, например, молекулы
двухатомных газов таких, как кислород,
водород, азот и т. д., имеют в составе
одной молекулы два атома. Поэтому для
всех этих газов
![]() ,
а для одноатомных газов таких, как неон,
аргон и т. д.,
,
а для одноатомных газов таких, как неон,
аргон и т. д.,
![]() .
.
Адиабата идеального газа
Адиабатическим называется процесс, протекающий без теплообмена с окружающей средой. При этом система не получает тепла извне и не отдает тепла окружающим телам. Реально это условие неосуществимо, и всякий реальный процесс может происходить лишь как приближенный к адиабатическому. Близкими к адиабатическому оказываются процессы, протекающие настолько быстро, что обмен теплом с внешней средой не успевает произойти.
Поскольку величина подводимого тепла равна нулю, то работа может производиться только за счет изменения внутренней энергии газа. Из закона сохранения энергии
dU+dA=0, т. e. dA=-dU. (3.132)
Если газ совершает положительную работу, то его внутренняя энергия убывает. Если внешние силы совершают работу над газом, то его внутренняя энергия увеличивается.
Изменение внутренней энергии одного моля идеального газа равно
![]() .
(3.133)
.
(3.133)
Откуда
CVdT+pdV=0. (3.134)
И с учетом уравнения состояния идеального газа для одного моля газа получим
![]() .
(3.135)
.
(3.135)
Это выражение преобразуется так:
 ,
или:
,
или:
 .
(3.136)
.
(3.136)
Откуда следует
 .
(3.137)
.
(3.137)
Коэффициент, стоящий перед lnV, равен
 .
(3.138)
.
(3.138)
Тогда из (3.137) получается уравнение адиабатического процесса в переменных Т и V:
![]() .
(3.139)
.
(3.139)
Если в этой формуле выразить температуру Т из уравнения состояния идеального газа, то получим уравнение адиабаты в переменных р и V, или уравнение Пуассона:
PV=const. (3.140)
Если изотермический процесс происходит за счет непрерывного поступления извне тепла, которое полностью компенсирует изменение внутренней энергии при совершении газом работы. внешними телами, то при адиабатическом процессе работа газа совершается за счет его внутренней энергии. При расширении газ охлаждается, при сжатии — нагревается.
Если изобразить оба эти процесса графически, то кривая адиабаты пойдет круче, чем кривая изотермы (рис. 3.20,а). В точке M обе кривые пересекаются.


Рис. 3.20,а Рис. 3.20,б
Поскольку кривая изотермы соответствует процессу, проходящему при постоянной температуре, то адиабатическое расширение сопровождается понижением температуры, а адиабатическое сжатие - повышением температуры. Поэтому участок адиабаты выше точки M (т. е. при больших, чем в этой точке значениях объема) лежит ниже изотермы, а участок адиабаты, соответствующий значениям объема, меньшим, чем в точке M, лежит выше изотермы.
На рис. 3.20,б представлены та же изотерма и две адиабаты - для двухатомного газа ( = 1,4) и для одноатомного газа ( = 1,67). Видно, что последняя адиабата идет круче первой.
Реальные процессы не носят строго изотермического или адиабатического характера, так как невозможно осуществить ни идеального обмена теплом, ни полной тепловой изоляции. Реальные процессы носят промежуточный характер между изотермическим и адиабатическим.
Для закрепления данной темы рассмотрим пример решения задачи.
Пример 6
Чему равны удельные теплоемкости cV и сp некоторого двухатомного газа, если плотность этого газа при нормальных условиях равна 1, 43 кг/м3?
Дано:
= 1,43 кг/м3
i = 5
____________
cp - ? cV - ?
Решение. Удельные теплоемкости равны
 и
и
![]()
Из уравнения Клапейрона-Менделеева находим
![]()
так как плотность газа = m / V.
Подставляя молярную массу в формулы для теплоемкости, имеем
 и
и
![]()
Произведем вычисления, учитывая, что для двухатомного газа число степеней свободы i = 5. Так как при нормальных условиях давление p = 1,01.105 Па и T = 273 K, находим
![]() Дж/(кг .К),
Дж/(кг .К),
![]() Дж/(кг .К).
Дж/(кг .К).
Пример 7
Кислород массой 2 кг занимает объем 1 м3 и находится под давлением 0,2 МПа. Газ был нагрет сначала при постоянном давлении до объема 3 м3, а затем при постоянном объеме - до давления 0,5 МПа. Найти изменение внутренней энергии газа, совершенную им работу и теплоту, переданную газу. Построить график процесса.
Дано:
О2
m = 2 кг
V1 = 1 м3
P1 = 0,2 МПа = 2.105 Па
1) P = const, V2 = 3 м3
2) V = const, P3 = 0,5 МПа = 5.105 Па
____________________
U - ? A - ? Q - ?
Решение. Изменение внутренней энергии газа
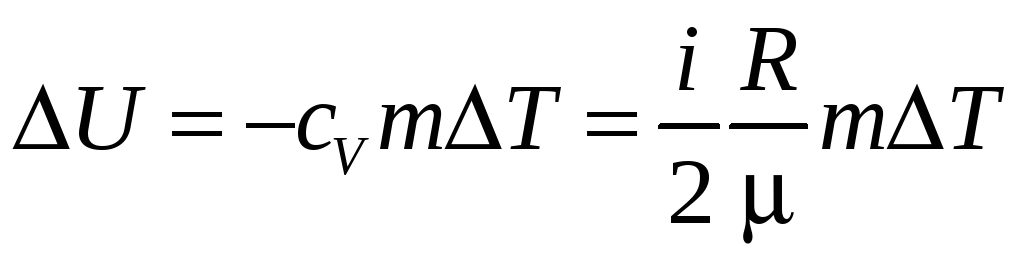 (3.141)
(3.141)
где i - число степеней свободы молекул газа (для двухатомных молекул кислорода i = 5), T = T3 - T1 - разность температур газа в конечном (третьем) и начальном состояниях.
Начальную и конечную температуру газа найдем из уравнения Менделеева-Клапейрона:
PV = ( m / ) RT,
откуда
T = PV / (mR).
Работа расширения газа при постоянном давлении выражается формулой
A1 = (m / ) RT.
