
- •Федеральное агентство по образованию
- •Кафедра физики физика. Часть 1 Учебно-методический комплекс
- •1. Информация о дисциплине
- •1.1. Предисловие
- •Содержание дисциплины «Физика. Часть 1»
- •Содержание дисциплины «Физика. Часть 1» по гос
- •Объем дисциплины и виды учебной работы по курсу физики на I семестре 2 курса
- •2. Рабочие учебные материалы
- •2.1. Рабочая программа (110 часов)
- •2.1.1. Физические основы механики
- •2.1.2. Молекулярная и статистическая физика, термодинамика
- •2.2. Тематический план дисциплины «Физика, часть 1»
- •3. Структурно-логическая схема дисциплины
- •2.4. Временной график изучения 1 части курса физики
- •2.5. Практический блок Практические занятия (все формы обучения)
- •Лабораторные работы (все формы обучения)
- •Информационные ресурсы дисциплины
- •Библиографический список
- •Опорный конспект лекций по дисциплине
- •3.2.1. Физические основы механики
- •3.2.1.1. Элементы кинематики материальной точки
- •Вопросы для самопроверки
- •3.2.1.2. Динамика материальной точки и системы материальных
- •Пример 2
- •Вопросы для самопроверки
- •3.2.1.3. Работа и энергия
- •Пример 3
- •Вопросы для самопроверки
- •3.2.1.4. Элементы динамики вращательного движения твердого тела
- •Пример 4
- •3.2.1.5. Элементы механики жидкости и газа
- •Ламинарное течение
- •Уравнение Бернулли
- •Вопросы для самопроверки
- •3.2.1.6. Элементы релятивистской механики
- •Пример 5
- •Физические основы механики
- •3.2.2. Молекулярная физика и термодинамика
- •3.2.2.1. Кинетические явления и теория идеальных газов
- •Работа газа, нагреваемого при постоянном объеме, равна нулю:
- •Вопросы для самопроверки
- •3.2.2.2. Основы классической статистической физики
- •Вопросы для самопроверки
- •3.2.2.3. Реальные газы. Уравнение Ван-дер-Ваальса
- •Вопросы для самопроверки
- •3.2.2.4. Основы термодинамики
- •Определяем изменение энтропии в этом процессе
- •Вопросы для самопроверки
- •3.2.2.5. Термодинамика макросистем
- •Молекулярная и статистическая физика. Термодинамика
- •Глоссарий
- •4. Блок контроля освоения дисциплины
- •4.1. Методические указания к выполнению контрольной работы №1
- •Контрольная работа №1 «Физические основы механики»
- •4.3. Задание на контрольную работу №1
- •4.4. Методические указания к выполнению контрольной работы №2
- •4.5. Контрольная работа №2 «Молекулярная физика, элементы термодинамики»
- •4.6. Задание на контрольную работу №2
- •Некоторые астрономические величины
- •3. Некоторые соотношения между единицами измерения
- •4. Множители и приставки для образования десятичных кратных и дольных единиц и их наименования
- •5. Греческий алфавит
- •6. Некоторые физические постоянные (округленные значения)
- •7. Относительные атомные массы некоторых элементов
- •8. Некоторые физические постоянные (округленные значения)
- •4.8. Вопросы к зачету
- •Содержание
- •1.1. Предисловие……………………………………………………………3
- •191186, Санкт-Петербург, ул. Миллионная, 5
Работа газа, нагреваемого при постоянном объеме, равна нулю:
A2 = 0.
Следовательно, полная работа, совершаемая газом,
A = A1 + A2 = A1.
Согласно первому началу термодинамики теплота Q1, переданная газу, равна сумме изменения внутренней энергии U и работы A
Q = U + A.
Произведем вычисления, учтя, что для кислорода = 32 .10-3 кг/моль (см. справочные таблицы):
![]() K;
K;
![]() K;
K;
![]() K;
K;
![]() Дж
= 0,4 .
106 Дж
= 0,4 МДж; A
= A1
= 0,4
МДж;
Дж
= 0,4 .
106 Дж
= 0,4 МДж; A
= A1
= 0,4
МДж;
![]() Дж
= 3,24 .
106
Дж = 3,24 МДж;
Q =
(3,24 + 0,4) МДж = 3,64 МДж.
Дж
= 3,24 .
106
Дж = 3,24 МДж;
Q =
(3,24 + 0,4) МДж = 3,64 МДж.
График процесса приведен на рисунке.

Вопросы для самопроверки
-
Что такое параметры состояния системы?
-
Дайте определение равновесного состояния системы.
-
Какой процесс называется обратимым?
-
Что такое цикл?
-
Что такое уравнение состояния?
-
Для какого состояния газа можно применить модель «идеальный газ»?
-
Какому уравнению подчиняется состояние идеального газа? Напишите его.
-
Дайте определение теплоемкости тела.
-
Дайте определение удельной теплоемкости.
-
Напишите формулу для теплоемкости при постоянном объеме.
-
Напишите формулу для теплоемкости идеального газа при постоянном давлении.
-
Что такое число степеней свободы? Чему оно равно для одноатомной молекулы?
-
Что такое показатель адиабаты?
-
Напишите формулу связи показателя адиабаты с числом степеней свободы молекулы идеального газа.
-
Дайте определение адиабатического процесса.
-
Напишите уравнение адиабатического процесса.
-
Дайте определение изопроцесса. Перечислите известные изопроцессы.
-
Напишите уравнение и нарисуйте PV-диаграмму изотермического процесса.
-
Напишите уравнение и нарисуйте PV-диаграмму изобарического процесса.
-
Напишите уравнение и нарисуйте PV-диаграмму изохорического процесса.
3.2.2.2. Основы классической статистической физики
Законы механики, применяемые для систем частиц в условиях теплового равновесия, получили название статистической механики. Одно из положений статистической механики известно. Это положение о том, что при некоторой температуре энергия, приходящаяся на каждую степень свободы, равна 1/2kT.
Кроме того, из основного уравнения молекулярно-кинетической теории газов можно определить среднюю квадратичную скорость молекул газа:
 ,
(3.142)
,
(3.142)
где m - масса одной молекулы газа, а - молярная масса этого газа.
Таким образом, скорость молекул газа зависит от температуры. Экспериментальное определение скоростей молекул было осуществлено в опыте Штерна.
Опыт показывает, что при каждом значении температуры Т существует наиболее вероятная скорость vВ, с которой движется большинство молекул. Молекулы, скорости которых много больше или много меньше наиболее вероятной, встречаются редко. Таким образом, существует некоторая статистическая закономерность распределения молекул по скоростям.
Впервые закон распределения молекул газа по скоростям (и по кинетическим энергиям) был получен Максвеллом на основе теории вероятности.
Вводя функцию
распределения
![]() ,
характеризующую относительное число
молекул
,
характеризующую относительное число
молекул
![]() ,
скорости которых лежат в заданном
интервале от
,
скорости которых лежат в заданном
интервале от![]() до
до![]() +d
+d![]() ,
математически закон Максвелла можно
записать так:
,
математически закон Максвелла можно
записать так:
 ,
(3.143)
,
(3.143)
где m - масса одной молекулы;
k - постоянная Больцмана;
T - абсолютная температура.
График функции распределения Максвелла показан на рис. 3.21.
Относительное
число молекул
![]() ,
для которых значения скоростей находятся
в заданном интервале от
,
для которых значения скоростей находятся
в заданном интервале от![]() до (
до (![]() +
+![]() ),
численно равно площади прямоугольника,
заштрихованного на рис.
3.21.
),
численно равно площади прямоугольника,
заштрихованного на рис.
3.21.

Рис. 3.21
Скорость, соответствующая максимальному значению функции распределения f(v), называется наиболее вероятной скоростью vВ. Её можно найти, если продифференцировать формулу (3.143) и приравнять полученную производную нулю:
 .
(3.144)
.
(3.144)
Закону Максвелла
можно придать
другой вид, если вместо скорости в
качестве переменной взять кинетическую
энергию
![]() .
Тогда выражение
.
Тогда выражение
 (3.145)
(3.145)
будет характеризовать
функцию распределения молекул, значения
кинетической энергии которых находятся
в заданном интервале от
![]() до (
до (![]() ).
).
Из выражений (3.144) - (3.145) следует, что вид функции распределения зависит от температуры и массы молекул.
С увеличением
температуры максимум кривой функции
распределения
 смещается вправо и становится ниже. Это
означает, что число быстрых молекул
увеличивается, а медленных —
уменьшается,
при этом площадь, ограниченная сверху
кривой, не изменяется, так как число
молекул не меняется.
смещается вправо и становится ниже. Это
означает, что число быстрых молекул
увеличивается, а медленных —
уменьшается,
при этом площадь, ограниченная сверху
кривой, не изменяется, так как число
молекул не меняется.
Графики функции распределения молекул кислорода по их скоростям, рассчитанные по формуле (3.145), приведены на рис. 3.22.
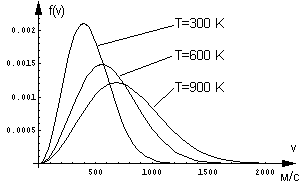
Рис. 3.22
Три кривые, изображенные на рисунке 3.22, соответствуют трем различным температурам - 300, 600 и 900 К. По оси абсцисс отложены скорости молекул в м/c. Можно видеть, что наиболее вероятная скорость, соответствующая максимуму распределения, с ростом температуры увеличивается в соответствии с формулой (3.144).
Больцман обобщил закон Максвелла на случай, когда молекулы движутся в поле силы тяжести (в общем случае - в любом силовом поле). При этом кинетическую энергию в формуле (3.145) следует заменить на полную энергию молекул Е=ЕK+ЕP, где ЕP - потенциальная энергия. Так как потенциальная энергия зависит от координат, то приходится говорить о числе молекул, для которых ограничены не только скорости определенным интервалом скоростей, но и координаты которых также ограничены определенным интервалом.
Окончательно закон распределения Максвелла — Больцмана имеет вид
 .
(3.146)
.
(3.146)
Существенно, что законы Максвелла и Больцмана справедливы для равновесного состояния идеального газа и выполняются тем точнее, чем больше число молекул N.
