
- •Введение
- •Электронное строение элементов-органогенов. Химическая связь в органических молекулах
- •Химическая связь в органических молекулах
- •Классификация химических реакций. Химические свойства алканов, алкенов и алкадиенов
- •Реакционная способность алканов
- •Реакционная способность алкенов
- •Химические свойства алкенов
- •Общий механизм реакций электрофильного присоединения
- •Реакции электрофильного присоединения к несимметричным алкенам
- •Реакции присоединения к алкадиенам
- •Сопряжённые системы. Ароматичность. Электронные эффекты. Реакции электрофильного замещения в бензоле и его производных
- •Химические свойства бензола
- •Взаимное влияние атомов в молекулах органических соединений. Электронные эффекты
- •Реакции электрофильного замещения в нафталине
- •Реакции окисления гомологов бензола
- •Химические свойства галогеналканов, спиртов и фенолов
- •Медико-биологическое значение галогеналканов
- •Спирты и фенолы
- •Медико-биологическое значение спиртов и фенолов
- •Кислотные и основные свойства органических соединений. Реакционная способность аминов
- •Кислоты Бренстеда
- •Основания Бренстеда
- •Реакционная способность оксосоединений
- •Классификация и номенклатура оксосоединений
- •Названия алифатических альдегидов
- •Реакционные центры в молекулах оксосоединений
- •Примеры реакций нуклеофильного присоединения
- •Медико-биологическое значение альдегидов и кетонов
- •Химические свойства карбоновых кислот и их функциональных производных
- •Названия предельных алифатических монокарбоновых кислот
- •Реакционные центры в молекулах карбоновых кислот
- •Кислотные свойства карбоновых кислот
- •Реакции нуклеофильного замещения
- •Реакции карбоновых кислот по радикалу
- •Названия насыщенных алифатических дикарбоновых кислот
- •Медико-биологическое значение карбоновых кислот и их производных
- •Гетерофункциональные соединения алифатического ряда – метаболиты и биорегуляторы
- •Аминоспирты
- •Аминокислоты
- •Гидроксикислоты (оксикислоты)
- •Оксокислоты
- •Медико-биологическое значение гетерофункциональных производных карбоновых кислот
- •Оптическая изомерия
- •Стереоизомерия молекул с несколькими центрами хиральности
- •Стереоизомерия и биологическая активность
- •Гетерофункциональные производные бензольного ряда
- •Производные сульфаниловой кислоты
- •Сульфаниламидные препараты
- •Салициловая кислота и ее производные
- •Гетероциклические соединения. Производные пятичленных гетероциклов
- •Пятичленные гетероциклы с одним гетероатомом
- •Свойства пиррола и его производных
- •Свойства фурана и его производных
- •Пятичленные гетероциклы с двумя гетероатомами
- •Шестичленные гетероциклические соединения
- •Шестичленные гетероциклы с двумя гетероатомами
- •Углеводы. Моносахариды
- •Цикло-оксо-таутомерия моносахаридов
- •Углеводы. Ди- и полисахариды
- •Природные α-аминокислоты. Пептиды, белки
- •Строение и классификация природных α-аминокислот
- •Стереоизомерия α-аминокислот
- •Химические свойства
- •Реакции α-аминокислот in vivo
- •Нуклеиновые кислоты
- •Нуклеиновые основания
- •Нуклеозиды
- •Названия нуклеозидов
- •Нуклеотиды
- •Нуклеиновые кислоты
- •Омыляемые липиды
- •Фосфолипиды
- •Неомыляемые липиды
- •Алкалоиды
- •Литература
- •Оглавление
- •305041, Г. Курск, ул. К. Маркса, 3.
- •305041, Г. Курск, ул. К. Маркса, 3. Заказ № 313.
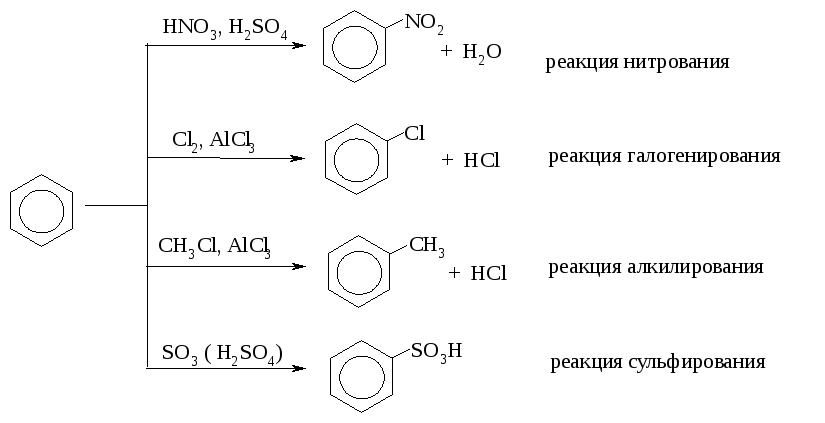
Химические свойства бензола
Бензол является ненасыщенным соединением, но мы выяснили, что в его структуре нет двойных связей, а есть ароматическая связь – делокализованное электронное облако. Типичные реакции непредельных углеводородов – электрофильное присоединение и окисление – для бензола не характерны. Так, он не обесцвечивает бромную воду, не даёт реакции Вагнера (окисление раствором перманганата калия при комнатной температуре). Для бензола характерны реакции, не приводящие к нарушению замкнутой сопряжённой системы, – реакции замещения. Чтобы выяснить, какой тип замещения (радикальное, электрофильное, нуклеофильное) характерен для бензола, вспомните его электронное строение: σ-скелет молекулы плоский, а над и под плоскостью расположено ароматическое облако. Чтобы провзаимодействовать с этим ароматическим облаком, реагент должен быть электрофильным. Итак, для бензола (и ароматических соединений вообще) характерны реакции электрофильного замещения. Примерами реакций SE являются:
Рассмотрим общий механизм реакций электрофильного замещения в бензоле.
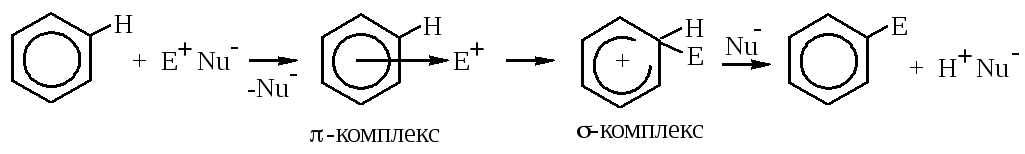
На первой стадии электрофил подходит к молекуле бензола и взаимодействует со всем ароматическим облаком (они притягиваются друг к другу). Образуется π-комплекс. Для образования новой ковалентной связи углерод-электрофил необходима пара электронов. Электрофил вырывает её из ароматического облака, образуется σ-комплекс. Он не является замкнутой сопряжённой системой, т.к. атом углерода, образовавший новую σ-связь, перешёл в sp3-гибридизацию (он вышел из плоскости и больше не имеет негибридной pz-орбитали). Остальные пять атомов углерода продолжают участвовать в сопряжении, образуя общее электронное облако, в котором делокализовано четыре электрона (6-2=4), поэтому положительный заряд в σ-комплексе обозначается не на конкретном атоме углерода, а в центре разомкнутого кольца. Итак, σ-комплекс не является ароматической структурой. Для того чтобы вернуть ароматичность, ему необходимо отщепить протон водорода (H+). Его забирает оставшийся в реакционной среде нуклеофил (Nu-). Два электрона связи C-H возвращаются в ароматическое облако, атом углерода вновь становится sp2-гибридизованным и может участвовать в сопряжении.
Лимитирующей стадией реакции электрофильного замещения является стадия образования σ-комплекса, т.к. при этом происходит потеря ароматичности, что требует затрат энергии.
Различные реакции электрофильного замещения в бензоле протекают по общему механизму и отличаются только стадией образования электрофильной частицы.
Реакция нитрования бензола протекает под действием смеси концентрированных азотной и серной кислот (схему реакции см. выше). Рассмотрим её механизм.

На первой стадии реакции азотная кислота взаимодействует с серной. В данном случае азотная кислота выполняет роль основания, принимая протон от молекулы серной кислоты (по теории Бренстеда, кислота – это молекула или ион, отдающие протон, а основание – молекула или ион, принимающие протон водорода). Образуется протонированная азотная кислота, которая, отщепляя молекулу воды, превращается в катион нитрония, или нитроний-катион. Это и есть электрофильная частица. Таким образом, серная кислота выполняет роль катализатора, принимая участие в образовании электрофильного реагента. Вторая роль серной кислоты – это роль водоотнимающего средства. Воду необходимо отводить из сферы реакции, чтобы сместить её равновесие вправо.
После образования электрофила – катиона нитрония - реакция протекает по общему механизму, через образование π- и σ-комплексов:
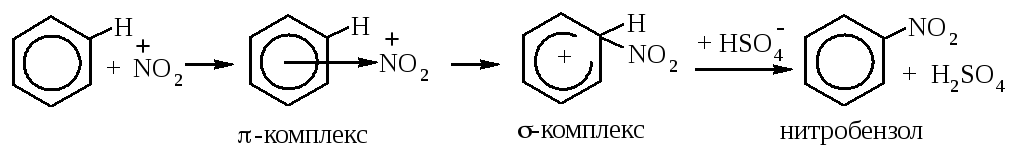
Обратите внимание: на стадии превращения σ-комплекса в нитробензол (стадии возвращения ароматичности) протон водорода отщепляется под действием аниона серной кислоты, при этом вновь образуется серная кислота, что доказывает, что она являлась катализатором данной реакции.
К атализатором
реакции
галогенирования
являются так называемые кислоты Льюиса
(по теории Льюиса, кислоты – это
нейтральные молекулы или ионы, способные
принимать пару электронов): FeCl3,
FeBr3,
AlCl3,
AlBr3
и т.п. Катализатор необходим, чтобы
поляризовать молекулу галогена. Кислота
Льюиса смещает на себя неподелённую
электронную пару хлора, образуя комплекс,
в котором на одном из атомов хлора
сосредоточивается частичный положительный
заряд:
атализатором
реакции
галогенирования
являются так называемые кислоты Льюиса
(по теории Льюиса, кислоты – это
нейтральные молекулы или ионы, способные
принимать пару электронов): FeCl3,
FeBr3,
AlCl3,
AlBr3
и т.п. Катализатор необходим, чтобы
поляризовать молекулу галогена. Кислота
Льюиса смещает на себя неподелённую
электронную пару хлора, образуя комплекс,
в котором на одном из атомов хлора
сосредоточивается частичный положительный
заряд:

Далее молекула бензола взаимодействует с образовавшимся комлексом как с электрофилом:
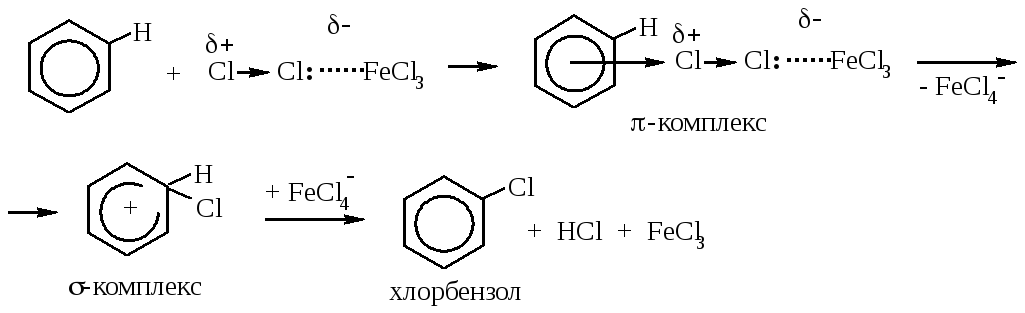
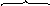
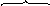
На стадии образования π-комплекса происходит дальнейшая поляризация связи Cl-Cl, и она разрывается гетеролитически, причём Cl+ сразу участвует в образовании σ-комплекса.
А налогично
протекают реакции
алкилирования (реакция
Фриделя-Крафтса).
налогично
протекают реакции
алкилирования (реакция
Фриделя-Крафтса).

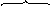
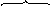
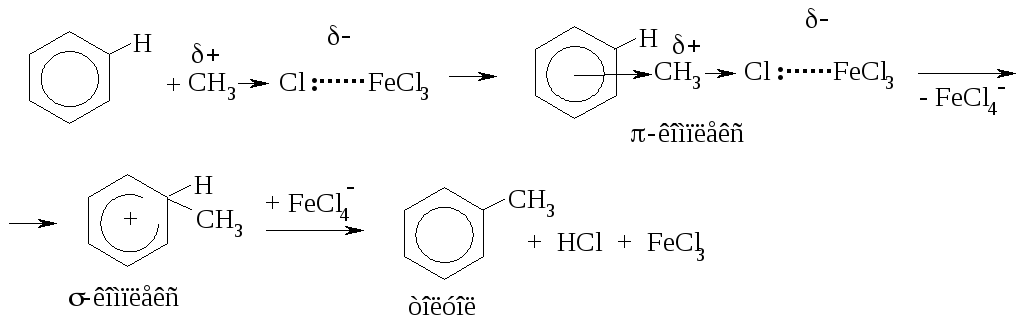
Связь C-Cl в метилхлориде недостаточно полярна, чтобы разорваться гетеролитически. Под действием кислоты Льюиса увеличивается частичный положительный заряд на атоме углерода, и комплекс реагента с катализатором является более сильным электрофилом, чем исходный метилхлорид.
Реакция сульфирования бензола протекает под действием олеума (раствор серного ангидрида SO3 в концентрированной серной кислоте).
М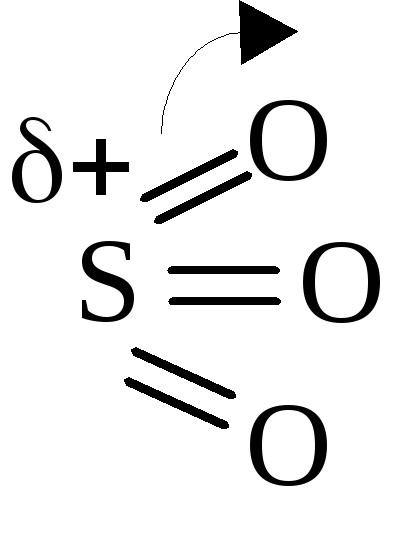 олекула
серного ангидрида является электрофилом
из-за большого по величине частичного
положительного заряда на атоме серы.
олекула
серного ангидрида является электрофилом
из-за большого по величине частичного
положительного заряда на атоме серы.

При образовании π-комплекса связь S=O (в первую очередь π-связь) поляризуется и разрывается по гетеролитическому типу, поэтому при образовании σ-комплекса на атоме кислорода возникает полный отрицательный заряд. Для восстановления ароматичности протон водорода отщепляется от атома углерода кольца и переходит к отрицательно заряженному кислороду. Образуется бензолсульфокислота.
Когда мы рассматриваем реакции электрофильного замещения в бензоле, перед нами не стоит вопрос, в каком положении протекает реакция, т.к. все атомы углерода абсолютно равноценны. Другое дело, если в бензольном кольце уже есть заместитель. В этом случае в результате электрофильного замещения принципиально возможно образование трёх изомеров:

Чтобы ответить на вопрос, какой из этих возможных продуктов является преобладающим, необходимо рассматривать электронные эффекты заместителя.
Отвлечёмся от реакций электрофильного замещения в бензоле и его производных и рассмотрим электронные эффекты в целом.
