
- •Введение
- •Электронное строение элементов-органогенов. Химическая связь в органических молекулах
- •Химическая связь в органических молекулах
- •Классификация химических реакций. Химические свойства алканов, алкенов и алкадиенов
- •Реакционная способность алканов
- •Реакционная способность алкенов
- •Химические свойства алкенов
- •Общий механизм реакций электрофильного присоединения
- •Реакции электрофильного присоединения к несимметричным алкенам
- •Реакции присоединения к алкадиенам
- •Сопряжённые системы. Ароматичность. Электронные эффекты. Реакции электрофильного замещения в бензоле и его производных
- •Химические свойства бензола
- •Взаимное влияние атомов в молекулах органических соединений. Электронные эффекты
- •Реакции электрофильного замещения в нафталине
- •Реакции окисления гомологов бензола
- •Химические свойства галогеналканов, спиртов и фенолов
- •Медико-биологическое значение галогеналканов
- •Спирты и фенолы
- •Медико-биологическое значение спиртов и фенолов
- •Кислотные и основные свойства органических соединений. Реакционная способность аминов
- •Кислоты Бренстеда
- •Основания Бренстеда
- •Реакционная способность оксосоединений
- •Классификация и номенклатура оксосоединений
- •Названия алифатических альдегидов
- •Реакционные центры в молекулах оксосоединений
- •Примеры реакций нуклеофильного присоединения
- •Медико-биологическое значение альдегидов и кетонов
- •Химические свойства карбоновых кислот и их функциональных производных
- •Названия предельных алифатических монокарбоновых кислот
- •Реакционные центры в молекулах карбоновых кислот
- •Кислотные свойства карбоновых кислот
- •Реакции нуклеофильного замещения
- •Реакции карбоновых кислот по радикалу
- •Названия насыщенных алифатических дикарбоновых кислот
- •Медико-биологическое значение карбоновых кислот и их производных
- •Гетерофункциональные соединения алифатического ряда – метаболиты и биорегуляторы
- •Аминоспирты
- •Аминокислоты
- •Гидроксикислоты (оксикислоты)
- •Оксокислоты
- •Медико-биологическое значение гетерофункциональных производных карбоновых кислот
- •Оптическая изомерия
- •Стереоизомерия молекул с несколькими центрами хиральности
- •Стереоизомерия и биологическая активность
- •Гетерофункциональные производные бензольного ряда
- •Производные сульфаниловой кислоты
- •Сульфаниламидные препараты
- •Салициловая кислота и ее производные
- •Гетероциклические соединения. Производные пятичленных гетероциклов
- •Пятичленные гетероциклы с одним гетероатомом
- •Свойства пиррола и его производных
- •Свойства фурана и его производных
- •Пятичленные гетероциклы с двумя гетероатомами
- •Шестичленные гетероциклические соединения
- •Шестичленные гетероциклы с двумя гетероатомами
- •Углеводы. Моносахариды
- •Цикло-оксо-таутомерия моносахаридов
- •Углеводы. Ди- и полисахариды
- •Природные α-аминокислоты. Пептиды, белки
- •Строение и классификация природных α-аминокислот
- •Стереоизомерия α-аминокислот
- •Химические свойства
- •Реакции α-аминокислот in vivo
- •Нуклеиновые кислоты
- •Нуклеиновые основания
- •Нуклеозиды
- •Названия нуклеозидов
- •Нуклеотиды
- •Нуклеиновые кислоты
- •Омыляемые липиды
- •Фосфолипиды
- •Неомыляемые липиды
- •Алкалоиды
- •Литература
- •Оглавление
- •305041, Г. Курск, ул. К. Маркса, 3.
- •305041, Г. Курск, ул. К. Маркса, 3. Заказ № 313.
Реакции присоединения к алкадиенам
Алкадиенами (или просто диенами) называют углеводороды, содержащие две двойные связи. По взаимному расположению двойных связей их классифицируют на:
-
к
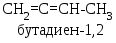 умулированные,
в молекулах которых две двойные связи
расположены рядом, например
умулированные,
в молекулах которых две двойные связи
расположены рядом, например
-
с
 опряжённые,
в молекулах которых двойные связи
чередуются с одинарными, например
опряжённые,
в молекулах которых двойные связи
чередуются с одинарными, например
-
и
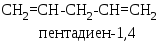 золированные,
в молекулах которых две двойные
связи разделены двумя или более
одинарными, например
золированные,
в молекулах которых две двойные
связи разделены двумя или более
одинарными, например
Р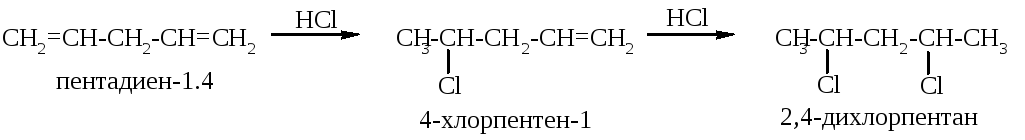 еакционная
способность кумулированных и изолированных
алкадиенов сходна с реакционной
способностью алкенов: каждая двойная
связь вступает в реакции присоединения
независимо от другой. Единственное
отличие этих типов алкадиенов состоит
в том, что они могут присоединить два
моля реагента. Например, при взаимодействии
пентадиена-1,4 с хлороводородом сначала
образуется 4-хлорпентен-1, а затем
2,4-дихлорпентан:
еакционная
способность кумулированных и изолированных
алкадиенов сходна с реакционной
способностью алкенов: каждая двойная
связь вступает в реакции присоединения
независимо от другой. Единственное
отличие этих типов алкадиенов состоит
в том, что они могут присоединить два
моля реагента. Например, при взаимодействии
пентадиена-1,4 с хлороводородом сначала
образуется 4-хлорпентен-1, а затем
2,4-дихлорпентан:
Сопряжённые алкадиены вступают в реакции электрофильного присоединения особенным образом. Для них характерно так называемое 1,2- и 1,4-присоединение.
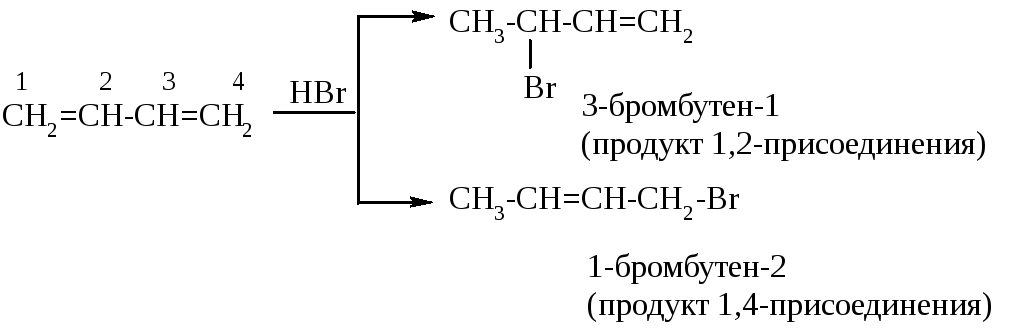
При 1,2-присоединении реакция протекает за счёт разрыва одной π-связи (между С-1 и С-2). При 1,4-присоединении реакция идёт по концам сопряжённой системы (т.е. к С-1 и С-4) с разрывом обеих π-связей и образованием новой π-связи. Эта особенность в реакциях присоединения связана с тем, что в сопряжённых алкадиенах существуют так называемые сопряжённые системы (подробнее об этом – в следующем разделе).
Сопряжённые системы. Ароматичность. Электронные эффекты. Реакции электрофильного замещения в бензоле и его производных
Сопряжение – это выравнивание связей и зарядов в реальной молекуле (или частице) по сравнению с идеальной, но несуществующей структурой. Можно дать и другое определение этому явлению: это процесс дополнительного взаимодействия p-электронных орбиталей, приводящий к делокализации электронной плотности.
Рассмотрим пример сопряжённой системы – молекулу бутадиена-1,3.
CH2=CH-CH=CH2
А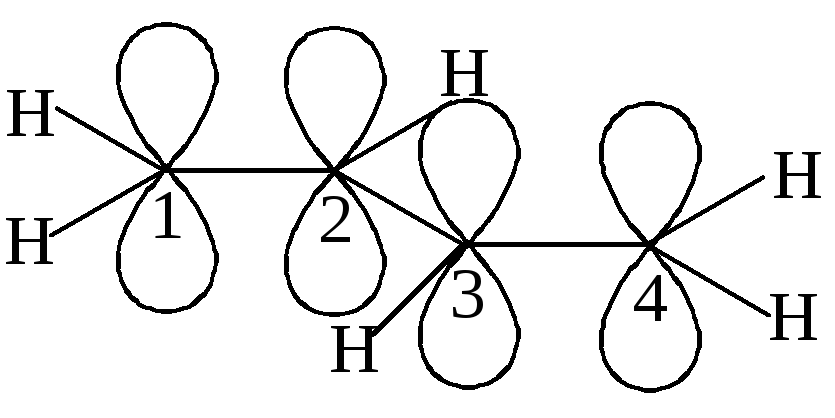 томы
углерода в молекуле бутадиена-1,3
sp2-гибридизованы.
Это значит, что все σ-связи расположены
в одной плоскости под углом 120о.
p-Электронная
орбиталь каждого атома углерода
расположена перпендикулярно плоскости
σ-связей. Вы уже знаете, что за счёт
бокового перекрывания p-орбиталей
образуются π-связи. В соответствии с
формулой бутадиена-1,3 мы можем предположить,
что одна π-связь образуется за счёт
перекрывания р-орбиталей С-1 и С-2, а
вторая – С-3 и С-4. Но посмотрите на
приведенный выше рисунок: почему
р-орбитали С-2 и С-3 не смогут перекрыться?
Действительно, происходит их дополнительное
перекрывание, и на самом деле в молекуле
бутадиена-1,3 не существует двух отдельных
областей с повышенной электронной
плотностью (две π-связи), а образуется
общее электронное облако, содержащее
4 электрона и принадлежащее четырём
атомам углерода. Поэтому реальную
структуру бутадиена-1,3 можно изобразить
следующим образом:
томы
углерода в молекуле бутадиена-1,3
sp2-гибридизованы.
Это значит, что все σ-связи расположены
в одной плоскости под углом 120о.
p-Электронная
орбиталь каждого атома углерода
расположена перпендикулярно плоскости
σ-связей. Вы уже знаете, что за счёт
бокового перекрывания p-орбиталей
образуются π-связи. В соответствии с
формулой бутадиена-1,3 мы можем предположить,
что одна π-связь образуется за счёт
перекрывания р-орбиталей С-1 и С-2, а
вторая – С-3 и С-4. Но посмотрите на
приведенный выше рисунок: почему
р-орбитали С-2 и С-3 не смогут перекрыться?
Действительно, происходит их дополнительное
перекрывание, и на самом деле в молекуле
бутадиена-1,3 не существует двух отдельных
областей с повышенной электронной
плотностью (две π-связи), а образуется
общее электронное облако, содержащее
4 электрона и принадлежащее четырём
атомам углерода. Поэтому реальную
структуру бутадиена-1,3 можно изобразить
следующим образом:
![]()
Все углерод-углеродные связи в молекуле выравнены и в ней практически нет одинарных и двойных связей, а есть общее делокализованное электронное облако. Это и есть выравнивание связей в реальной молекуле по сравнению с идеальной, но несуществующей, строение которой мы записали как
CH2=CH-CH=CH2 .
Сопряжение – это энергетически выгодный для молекулы процесс. Вы знаете, что при образовании связи (т.е. при взаимодействии атомных орбиталей) выделяется энергия, значит, внутренняя энергия системы понижается, и она становится более стабильной. Так как при сопряжении происходит дополнительное перекрывание орбиталей, то выделяется и дополнительная энергия, и система становится ещё более стабильной. Энергия, выделяющаяся в результате сопряжения, называется энергией сопряжения. Количественно – это разность энергий соединения с сопряжёнными двойными связями и соединения с изолированными двойными связями (где сопряжение невозможно). Для бутадиена-1,3 она составляет 15 кДж/моль. Чем больше атомов участвует в сопряжении, тем выше энергия сопряжения, тем стабильнее молекула. Поэтому в природе распространены соединения, молекулы которых содержат длинные сопряжённые цепи (например, каротиноиды, см. стр. 232).
Бутадиен-1,3 является примером π,π-сопряжённой системы, т.к. в сопряжении участвуют электроны π-связей. Признаком π,π-сопряжённой системы является чередование одинарных и двойных связей в молекуле.
Другим видом сопряжения является p,π-сопряжение. В p,π-сопряжении участвуют электронные облака π-связей и p-орбитали, причём на p-орбитали может находиться 1 электрон, неподелённая электронная пара или эта орбиталь может быть вакантной. Рассмотрим конкретные примеры.
Э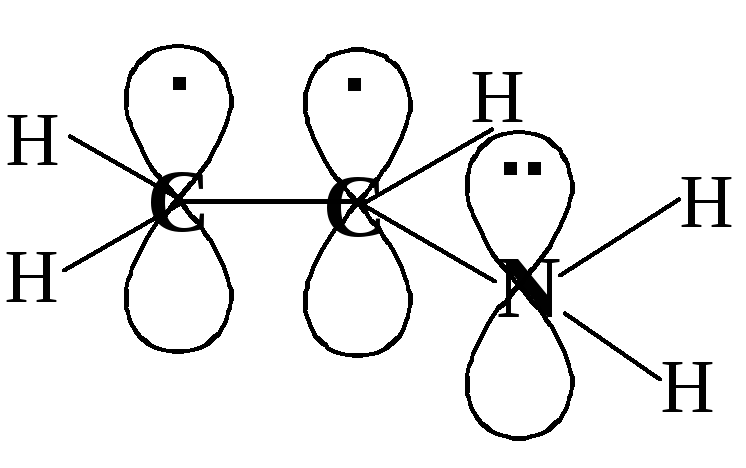
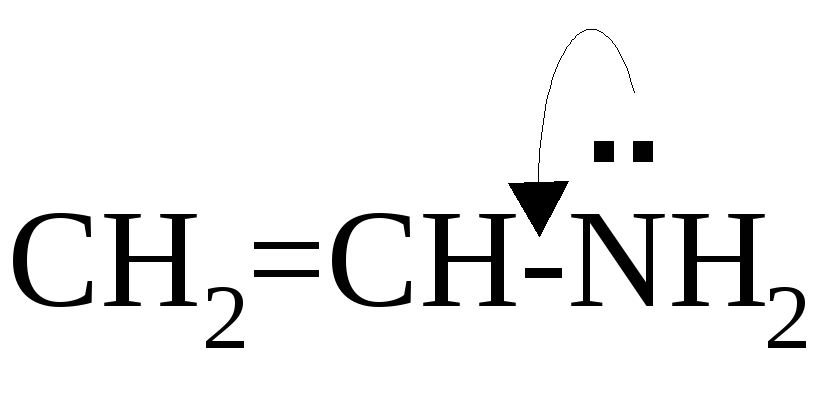 то
электронное строение молекулы виниламина
CH2=CH-NH2
. Атомы углерода и азота sp2-гибридизованы,
т.е. все σ-связи лежат в одной плоскости,
а негибридные p-орбитали
перпендикулярны этой плоскости.
Происходит перекрывание всех трёх
р-орбиталей с образованием делокализованного
электронного облака; 4 электрона (т.к. у
азота на негибридной орбитали неподелённая
электронная пара) принадлежат трём
атомам сопряжённой системы. На формуле
виниламина это можно обозначить так:
то
электронное строение молекулы виниламина
CH2=CH-NH2
. Атомы углерода и азота sp2-гибридизованы,
т.е. все σ-связи лежат в одной плоскости,
а негибридные p-орбитали
перпендикулярны этой плоскости.
Происходит перекрывание всех трёх
р-орбиталей с образованием делокализованного
электронного облака; 4 электрона (т.к. у
азота на негибридной орбитали неподелённая
электронная пара) принадлежат трём
атомам сопряжённой системы. На формуле
виниламина это можно обозначить так:
Количество электронов, делокализованных в р,π-сопряжённой системе, не всегда совпадает с количеством атомов, принимающих участие в сопряжении, например:

Признаком р,π-сопряжённой системы является sp2-гибридизация атомов, т.е. если в молекуле есть фрагмент, в котором три или более атомов подряд sp2-гибридизованы – этот фрагмент является р,π-сопряжёной системой.
В о
всех сопряжённых системах, которые мы
рассмотрели, можно выделить начало и
конец, поэтому их называют открытыми
сопряжёнными системами. А теперь
рассмотрим так называемые замкнутые
сопряжённые системы.
Примером является молекула бензола.
о
всех сопряжённых системах, которые мы
рассмотрели, можно выделить начало и
конец, поэтому их называют открытыми
сопряжёнными системами. А теперь
рассмотрим так называемые замкнутые
сопряжённые системы.
Примером является молекула бензола.
Формула Кекуле показывает, что бензол – это ненасыщенный углеводород, в молекуле которого есть три π-связи.
Если же мы рассмотрим электронное строение бензола, то увидим, что это π.π-сопряжённая система (атомы углерода sp2-гибридизованы, все σ-связи лежат в одной плоскости, а p-орбитали расположены перпендикулярно этой плоскости и перекрываются не попарно, а образуя общее электронное облако, в котором делокализовано 6 электронов).

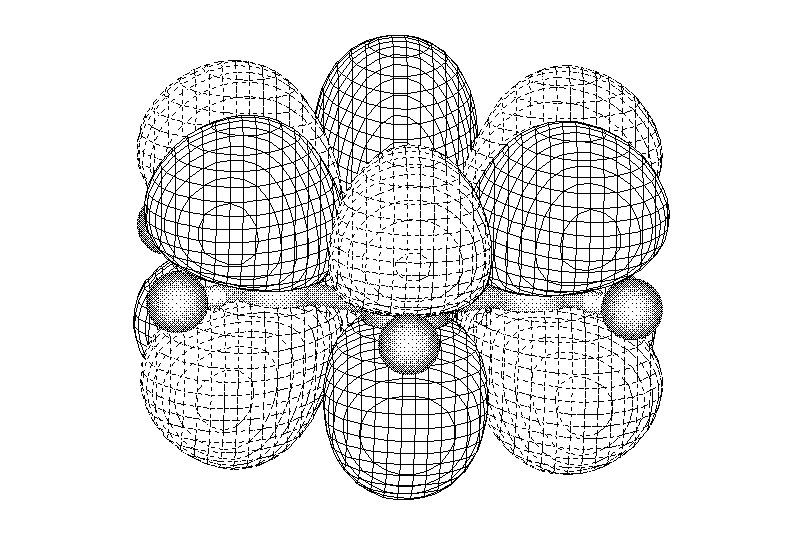
Н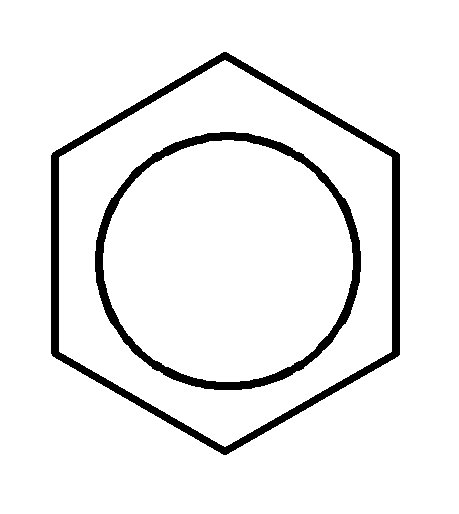 ад
и под плоскостью цикла располагаются
электронные облака, так называемые
«электронные бублики». Чтобы выразить
это, используют другую формулу бензола:
ад
и под плоскостью цикла располагаются
электронные облака, так называемые
«электронные бублики». Чтобы выразить
это, используют другую формулу бензола:
Длины С-С-связей в бензоле выравнены и равны 0,140 нм (сравните: длина одинарной С-С-связи – 0,154 нм, двойной С=С-связи – 0,134 нм).
Замкнутые сопряжённые системы более стабильны, чем открытые, т.к. энергия сопряжения замкнутых сопряжённых систем выше (в случае бензола – это 151 кДж/моль).
Бензол называют ароматическим соединением. Ароматичность – это совокупность свойств замкнутых сопряжённых систем, проявляющаяся в их высокой устойчивости к реакциям присоединения и окисления.
Ароматическими свойствами обладает не только бензол. Соединения, даже абсолютно не похожие по строению на бензол, также могут быть ароматическими, если они удовлетворяют квантово-механическим критериям ароматичности. Эти критерии следующие:
-
Наличие плоского цикла (все атомы цикла должны быть sp2-гибридизованы).
-
Наличие замкнутой сопряжённой системы (все атомы должны участвовать в сопряжении).
-
Выполнение правила Хюккеля. Число делокализованных электронов должно быть равно (4n+2), где n – это любое целое число.
(Например, в случае бензола 4n+2=6, n=1).
А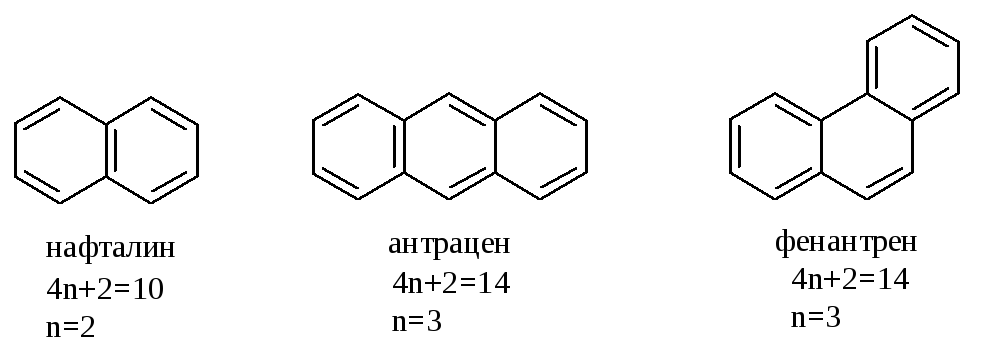 роматическими
являются, например, нафталин, антрацен,
фенантрен:
роматическими
являются, например, нафталин, антрацен,
фенантрен:
