
- •Введение
- •Электронное строение элементов-органогенов. Химическая связь в органических молекулах
- •Химическая связь в органических молекулах
- •Классификация химических реакций. Химические свойства алканов, алкенов и алкадиенов
- •Реакционная способность алканов
- •Реакционная способность алкенов
- •Химические свойства алкенов
- •Общий механизм реакций электрофильного присоединения
- •Реакции электрофильного присоединения к несимметричным алкенам
- •Реакции присоединения к алкадиенам
- •Сопряжённые системы. Ароматичность. Электронные эффекты. Реакции электрофильного замещения в бензоле и его производных
- •Химические свойства бензола
- •Взаимное влияние атомов в молекулах органических соединений. Электронные эффекты
- •Реакции электрофильного замещения в нафталине
- •Реакции окисления гомологов бензола
- •Химические свойства галогеналканов, спиртов и фенолов
- •Медико-биологическое значение галогеналканов
- •Спирты и фенолы
- •Медико-биологическое значение спиртов и фенолов
- •Кислотные и основные свойства органических соединений. Реакционная способность аминов
- •Кислоты Бренстеда
- •Основания Бренстеда
- •Реакционная способность оксосоединений
- •Классификация и номенклатура оксосоединений
- •Названия алифатических альдегидов
- •Реакционные центры в молекулах оксосоединений
- •Примеры реакций нуклеофильного присоединения
- •Медико-биологическое значение альдегидов и кетонов
- •Химические свойства карбоновых кислот и их функциональных производных
- •Названия предельных алифатических монокарбоновых кислот
- •Реакционные центры в молекулах карбоновых кислот
- •Кислотные свойства карбоновых кислот
- •Реакции нуклеофильного замещения
- •Реакции карбоновых кислот по радикалу
- •Названия насыщенных алифатических дикарбоновых кислот
- •Медико-биологическое значение карбоновых кислот и их производных
- •Гетерофункциональные соединения алифатического ряда – метаболиты и биорегуляторы
- •Аминоспирты
- •Аминокислоты
- •Гидроксикислоты (оксикислоты)
- •Оксокислоты
- •Медико-биологическое значение гетерофункциональных производных карбоновых кислот
- •Оптическая изомерия
- •Стереоизомерия молекул с несколькими центрами хиральности
- •Стереоизомерия и биологическая активность
- •Гетерофункциональные производные бензольного ряда
- •Производные сульфаниловой кислоты
- •Сульфаниламидные препараты
- •Салициловая кислота и ее производные
- •Гетероциклические соединения. Производные пятичленных гетероциклов
- •Пятичленные гетероциклы с одним гетероатомом
- •Свойства пиррола и его производных
- •Свойства фурана и его производных
- •Пятичленные гетероциклы с двумя гетероатомами
- •Шестичленные гетероциклические соединения
- •Шестичленные гетероциклы с двумя гетероатомами
- •Углеводы. Моносахариды
- •Цикло-оксо-таутомерия моносахаридов
- •Углеводы. Ди- и полисахариды
- •Природные α-аминокислоты. Пептиды, белки
- •Строение и классификация природных α-аминокислот
- •Стереоизомерия α-аминокислот
- •Химические свойства
- •Реакции α-аминокислот in vivo
- •Нуклеиновые кислоты
- •Нуклеиновые основания
- •Нуклеозиды
- •Названия нуклеозидов
- •Нуклеотиды
- •Нуклеиновые кислоты
- •Омыляемые липиды
- •Фосфолипиды
- •Неомыляемые липиды
- •Алкалоиды
- •Литература
- •Оглавление
- •305041, Г. Курск, ул. К. Маркса, 3.
- •305041, Г. Курск, ул. К. Маркса, 3. Заказ № 313.
Основания Бренстеда
Основания, по Бренстеду, это нейтральные молекулы и ионы, способные присоединять протон водорода. Для образования ковалентной связи с протоном основания Бренстеда должны предоставлять или неподелённую электронную пару, или электроны π-связи. В соответствии с этим основания Бренстеда делятся на n-основания и π-основания.
n-Основания – это анионы или нейтральные молекулы, имеющие атом с неподелённой электронной парой. Их классифицируют по центрам основности следующим образом:
-
 оксониевые основания: спирты R-ÖH,
простые эфиры
R-Ö-R,
сложные эфиры , альдегиды и
кетоны
оксониевые основания: спирты R-ÖH,
простые эфиры
R-Ö-R,
сложные эфиры , альдегиды и
кетоны
![]()
-![]() аммониевые основания: амины ,
гетероциклические соединения, например,
пиридин
аммониевые основания: амины ,
гетероциклические соединения, например,
пиридин
![]()
![]()
- сульфониевые основания: тиоспирты , тиоэфиры .
π-Основания – соединения, имеющие π-связи, т.е. алкены, алкадиены, алкины, арены. Это очень слабые основания, т.к. протонируемые электронные пары несвободны. Например, этен проявляет π-основные свойства при образовании π-комплекса с протоном водорода:

Для количественной характеристики основности используют величину pKa сопряжённой с данным основанием кислоты (BH+). Эту величину обозначают pKBH+. Чем pKBH+ больше, тем сильнее основание.
Влияние природы атома в основном центре и связанных с ним заместителей на основность противоположно рассмотренному ранее их влиянию на кислотность:
-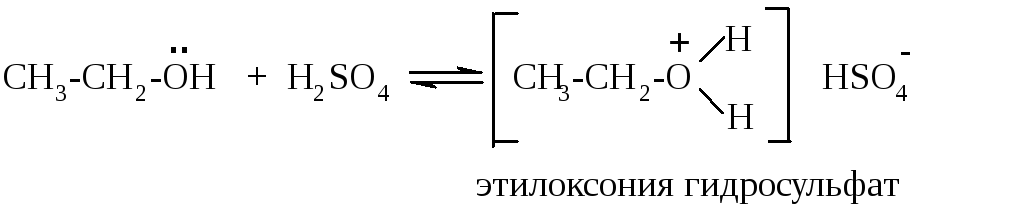 с увеличением электроотрицательности
атома основного центра основность
уменьшается (атом труднее отдаёт свою
неподелённую электронную пару для
присоединения протона), т.е. аммониевые
основания сильнее оксониевых. Так,
этанол способен взаимодействовать
только с концентрированными минеральными
кислотами:
с увеличением электроотрицательности
атома основного центра основность
уменьшается (атом труднее отдаёт свою
неподелённую электронную пару для
присоединения протона), т.е. аммониевые
основания сильнее оксониевых. Так,
этанол способен взаимодействовать
только с концентрированными минеральными
кислотами:
,
а этиламин проявляет основные свойства
даже при взаимодействии с водой:
этиламин проявляет основные свойства
даже при взаимодействии с водой:
.
- с увеличением поляризуемости атома основного центра основность уменьшается, т.е. оксониевые основания сильнее сульфониевых;
- электронодонорные заместители повышают основность, а электроноакцепторные – понижают (чем выше электронная плотность на основном центре, тем легче он предоставит свою электронную пару протону). Так, в ряду п-нитроанилин, анилин, п-толуидин основность повышается: нитро-группа является электроноакцепторным заместителем, а метильная группа – электронодонорным. Это подтверждают и значения pKBH+.

pKBH+=1,00 pKBH+=4,60 pKBH+=5,10
Итак, самыми сильными основаниями являются аммониевые. Основность различных типов аминов мы обсудим, рассматривая химические свойства аминов в целом.
АМИНЫ
Амины – это производные аммиака, в молекуле которого один, два или три атома водорода замещены углеводородными радикалами. Отсюда первый тип классификации аминов: по количеству радикалов амины подразделяют на первичные, вторичные и третичные.

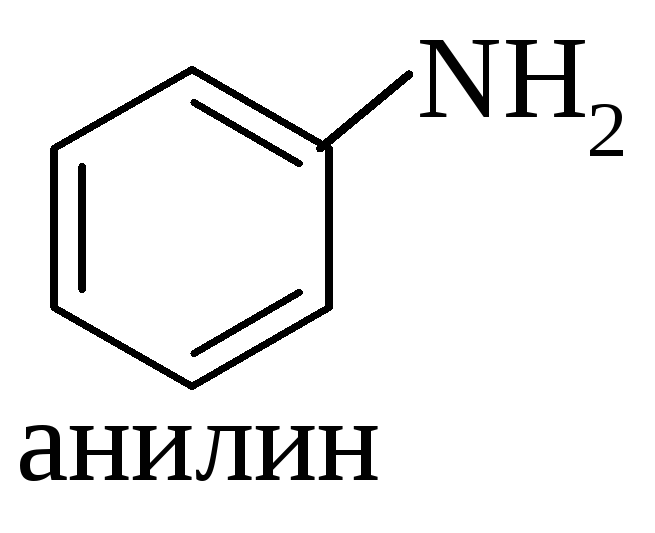
Другой вид классификации аминов – по природе радикалов. Амины подразделяют на алифатические и ароматические. Например, приведенные выше амины являются алифатическими, а анилин (аминобензол) – ароматическим:
Для названия аминов применяют радикало-функциональную и заместительную номенклатуру IUPAC. По радикало-функциональной номенклатуре называют радикал или радикалы, если их несколько (в алфавитном порядке), и добавляют слово «амин», например, метиламин, метилэтиламин, диметиламин и т.д. Те амины, которые нельзя назвать по радикало-функциональной номенклатуре (сложные радикалы), называют по заместительной номенклатуре, например:

Ароматические амины обычно рассматривают как производные анилина, например:

За счёт неподелённой электронной пары азота амины проявляют основные и нуклеофильные свойства.
Сравним основные свойства различных групп аминов.
Алифатические амины являются более сильными основаниями, чем ароматические. Это связано с тем, что неподелённая электронная пара азота в ароматических аминах участвует в p,π-сопряжении и менее доступна для атаки протона водорода. В алифатических же аминах электронная плотность на атоме азота аминогруппы повышена за счёт электронодонорного влияния алкильных групп:

А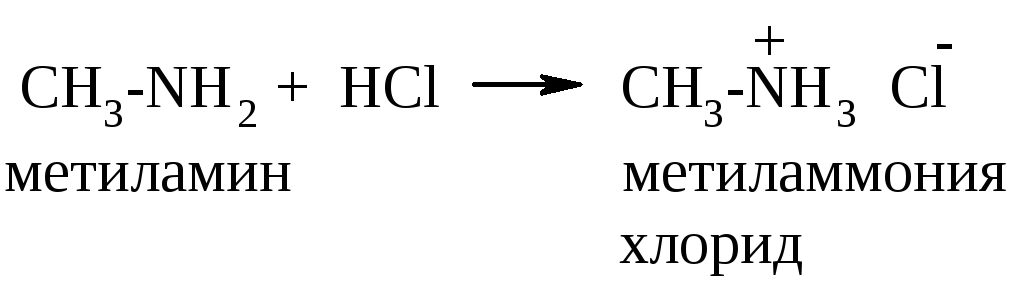 лифатические
амины взаимодействуют с минеральными
кислотами, карбоновыми кислотами и даже
с водой (очень слабой кислотой):
лифатические
амины взаимодействуют с минеральными
кислотами, карбоновыми кислотами и даже
с водой (очень слабой кислотой):
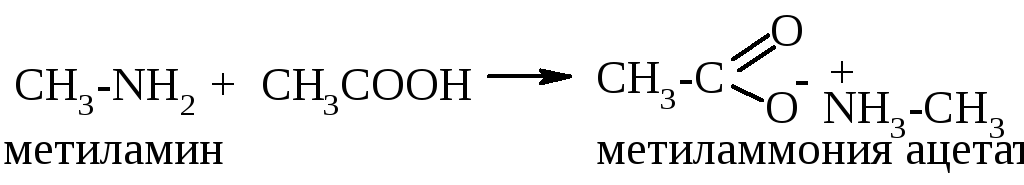

А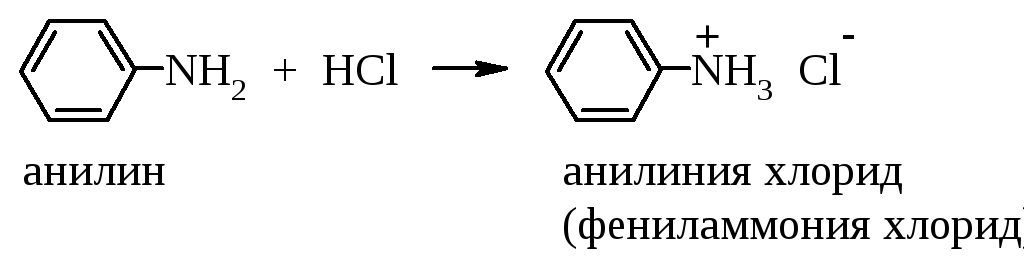 роматические
амины как слабые основания взаимодействуют
с минеральными кислотами:
роматические
амины как слабые основания взаимодействуют
с минеральными кислотами:
Заместители в ароматическом кольце влияют на основные свойства аминов: электронодонорные заместители повышают основные свойства, а электроноакцепторные – понижают (см. стр.71).
Сравним основные свойства различных типов алифатических аминов – первичных, вторичных и третичных, например, метиламина, диметиламина и триметиламина.
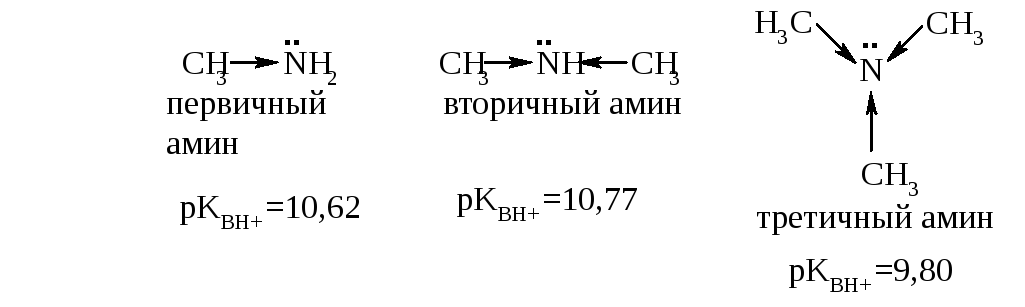
Чем выше электронная плотность на атоме азота, тем выше основные свойства амина. Каждая метильная группа смещает электронную плотность к атому азота, поэтому можно было бы предположить, что самым сильным основанием является третичный амин. Однако, сравнивая значения pKBH+, можно увидеть, что это не так: самым сильным основанием является вторичный амин. Этот факт можно объяснить с позиций пространственной доступности неподелённой электронной пары азота: в триметиламине три крупных заместителя «прикрывают» её. Таким образом, ряд убывания основности алифатических аминов:
вторичные > первичные > третичные.
За счет неподелённой электронной пары азота амины проявляют также нуклеофильные свойства. Амины являются нуклеофилами, например, в реакциях алкилирования и ацилирования.
Алкилирование – это введение в молекулу алкила (метил, этил, пропил и т.п.). В качестве алкилирующих реагентов обычно используют алкилгалогениды (этилхлорид, метилбромид, например). Так, в реакции этиламина с метилхлоридом образуется метилэтиламин:

Э то
реакция нуклеофильного замещения. Она
позволяет получить вторичный амин из
первичного и третичный – из вторичного.
то
реакция нуклеофильного замещения. Она
позволяет получить вторичный амин из
первичного и третичный – из вторичного.
Ароматические амины также вступают в реакции алкилирования, но менее активно, т.к. их нуклеофильные свойства понижены (неподелённая электронная пара, отвечающая за них, участвует в p,π-сопряжении).

Ацилированием называют введение в молекулу ацила – остатка карбоновой кислоты (например, ацетил – это остаток уксусной кислоты, пропионил – пропионовой). Для ацилирования аминов обычно используют ангидриды соответствующих кислот.

Подробнее мы будем рассматривать эти реакции, изучая тему «Карбоновые кислоты и их функциональные производные».
Для ароматических аминов характерны также реакции, протекающие за счёт ароматического кольца – реакции электрофильного замещения. Ранее мы уже рассматривали влияние аминогруппы на ход реакций SE (см. стр.44,45): аминогруппа, являясь электронодонорным заместителем (+MNH2 >> -INH2), облегчает эти реакции в сравнении с бензолом и является орто-, пара-ориентантом. Например, бромирование анилина бромной водой приводит к образованию белого осадка 2,4,6-триброманилина:

Эту реакцию используют для качественного обнаружения анилина.
