
- •Введение
- •Электронное строение элементов-органогенов. Химическая связь в органических молекулах
- •Химическая связь в органических молекулах
- •Классификация химических реакций. Химические свойства алканов, алкенов и алкадиенов
- •Реакционная способность алканов
- •Реакционная способность алкенов
- •Химические свойства алкенов
- •Общий механизм реакций электрофильного присоединения
- •Реакции электрофильного присоединения к несимметричным алкенам
- •Реакции присоединения к алкадиенам
- •Сопряжённые системы. Ароматичность. Электронные эффекты. Реакции электрофильного замещения в бензоле и его производных
- •Химические свойства бензола
- •Взаимное влияние атомов в молекулах органических соединений. Электронные эффекты
- •Реакции электрофильного замещения в нафталине
- •Реакции окисления гомологов бензола
- •Химические свойства галогеналканов, спиртов и фенолов
- •Медико-биологическое значение галогеналканов
- •Спирты и фенолы
- •Медико-биологическое значение спиртов и фенолов
- •Кислотные и основные свойства органических соединений. Реакционная способность аминов
- •Кислоты Бренстеда
- •Основания Бренстеда
- •Реакционная способность оксосоединений
- •Классификация и номенклатура оксосоединений
- •Названия алифатических альдегидов
- •Реакционные центры в молекулах оксосоединений
- •Примеры реакций нуклеофильного присоединения
- •Медико-биологическое значение альдегидов и кетонов
- •Химические свойства карбоновых кислот и их функциональных производных
- •Названия предельных алифатических монокарбоновых кислот
- •Реакционные центры в молекулах карбоновых кислот
- •Кислотные свойства карбоновых кислот
- •Реакции нуклеофильного замещения
- •Реакции карбоновых кислот по радикалу
- •Названия насыщенных алифатических дикарбоновых кислот
- •Медико-биологическое значение карбоновых кислот и их производных
- •Гетерофункциональные соединения алифатического ряда – метаболиты и биорегуляторы
- •Аминоспирты
- •Аминокислоты
- •Гидроксикислоты (оксикислоты)
- •Оксокислоты
- •Медико-биологическое значение гетерофункциональных производных карбоновых кислот
- •Оптическая изомерия
- •Стереоизомерия молекул с несколькими центрами хиральности
- •Стереоизомерия и биологическая активность
- •Гетерофункциональные производные бензольного ряда
- •Производные сульфаниловой кислоты
- •Сульфаниламидные препараты
- •Салициловая кислота и ее производные
- •Гетероциклические соединения. Производные пятичленных гетероциклов
- •Пятичленные гетероциклы с одним гетероатомом
- •Свойства пиррола и его производных
- •Свойства фурана и его производных
- •Пятичленные гетероциклы с двумя гетероатомами
- •Шестичленные гетероциклические соединения
- •Шестичленные гетероциклы с двумя гетероатомами
- •Углеводы. Моносахариды
- •Цикло-оксо-таутомерия моносахаридов
- •Углеводы. Ди- и полисахариды
- •Природные α-аминокислоты. Пептиды, белки
- •Строение и классификация природных α-аминокислот
- •Стереоизомерия α-аминокислот
- •Химические свойства
- •Реакции α-аминокислот in vivo
- •Нуклеиновые кислоты
- •Нуклеиновые основания
- •Нуклеозиды
- •Названия нуклеозидов
- •Нуклеотиды
- •Нуклеиновые кислоты
- •Омыляемые липиды
- •Фосфолипиды
- •Неомыляемые липиды
- •Алкалоиды
- •Литература
- •Оглавление
- •305041, Г. Курск, ул. К. Маркса, 3.
- •305041, Г. Курск, ул. К. Маркса, 3. Заказ № 313.
Кислоты Бренстеда
С![]() ила
кислот количественно выражается
константой равновесия реакции (К),
заключающейся в переносе протона
водорода от кислоты к основанию –
молекуле воды.
ила
кислот количественно выражается
константой равновесия реакции (К),
заключающейся в переносе протона
водорода от кислоты к основанию –
молекуле воды.
Используя значение константы равновесия этой реакции и учитывая, что концентрация воды практически постоянна, можно определить произведение K.[H2O], называемое константой кислотности (Ka) (от слова acid – кислота).
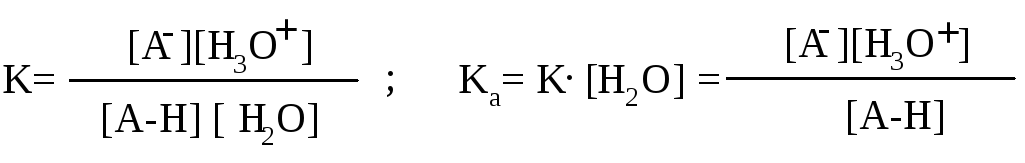
Чем больше Ka, тем сильнее кислота. Но величины Ka очень малы (например, Ka уксусной кислоты 1,75. 10-5 ), пользоваться ими неудобно, поэтому введено понятие «показатель константы кислотности» (её отрицательный логарифм) - pKa. pKa=-lg Ka. Например, для уксусной кислоты pKa=4,75. Чем меньше величина pKa, тем сильнее кислота.
В зависимости природы кислотного центра (атома, отщепляющего протон водорода) различают следующие типы кислот:
- OH-кислоты (вода, спирты, фенолы, карбоновые кислоты);
- SH-кислоты (тиоспирты, тиофенолы, тиокислоты);
- NH-кислоты (аммиак, амины, амиды кислот, пиррол);
- CH-кислоты (углеводороды и их производные).
Сила кислот определяется стабильностью сопряжённых оснований – чем стабильнее сопряжённое основание (анион кислоты), тем сильнее кислота.
Стабильность сопряжённого основания определяется степенью делокализации заряда, которая зависит от следующих факторов: природа атома в кислотном центре, влияние радикала, степень сольватации.
Рассмотрим каждый из этих факторов.
Природа атома в кислотном центре. Для делокализации отрицательного заряда наибольшее значение имеют электроотрицательность атома и его поляризуемость.
Ч
 ем
выше электроотрицательность атома,
получившего отрицательный заряд после
отщепления протона, тем сильнее он этот
отрицательный заряд удерживает и труднее
предоставляет протону, а значит равновесие
A-H
А-
+ H+
смещается вправо.
ем
выше электроотрицательность атома,
получившего отрицательный заряд после
отщепления протона, тем сильнее он этот
отрицательный заряд удерживает и труднее
предоставляет протону, а значит равновесие
A-H
А-
+ H+
смещается вправо.
В периодах слева направо электроотрицательность возрастает. Поэтому OH-кислоты сильнее NH-кислот, а NH-кислоты сильнее CH-кислот (при прочих равных условиях).
Так как электроотрицательность атомов зависит от типа гибридизации, то среди CH-кислот при переходе от алканов к алкенам и далее к алкинам кислотность возрастает:
CH3-CH3 < CH2=CH2 < CH≡CH.
Т![]() ак,
этан и этилен не реагируют с амидом
натрия, а ацетилен – реагирует:
ак,
этан и этилен не реагируют с амидом
натрия, а ацетилен – реагирует:
В группах сверху вниз увеличивается поляризуемость. Это связано с тем, что увеличивается число энергетических уровней, т.е. объем электронных оболочек. Чем выше поляризуемость, тем более делокализован заряд, тем стабильнее анион, а значит, выше сила кислоты. Поэтому SH-кислоты сильнее, чем OH-кислоты. Например, спирты не реагируют со щелочами, а тиолы – реагируют:
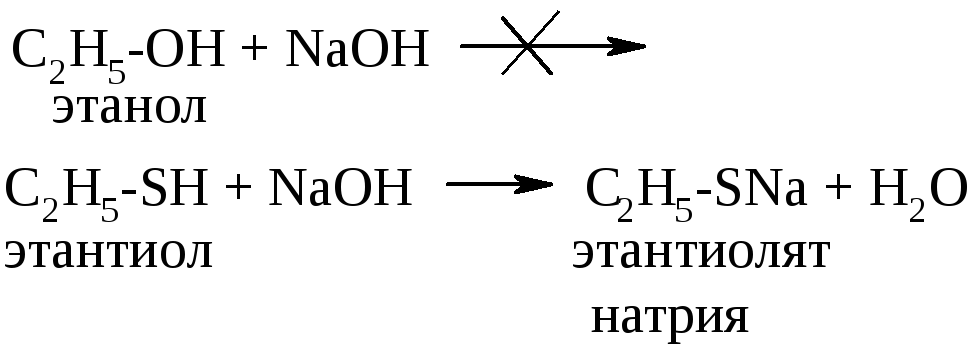
Влияние радикала (заместителя). Кислотность органических соединений в значительной степени зависит от природы заместителя, связанного с реакционным центром. Особенно сильно повышает кислотные свойства наличие сопряженной системы в анионе.
С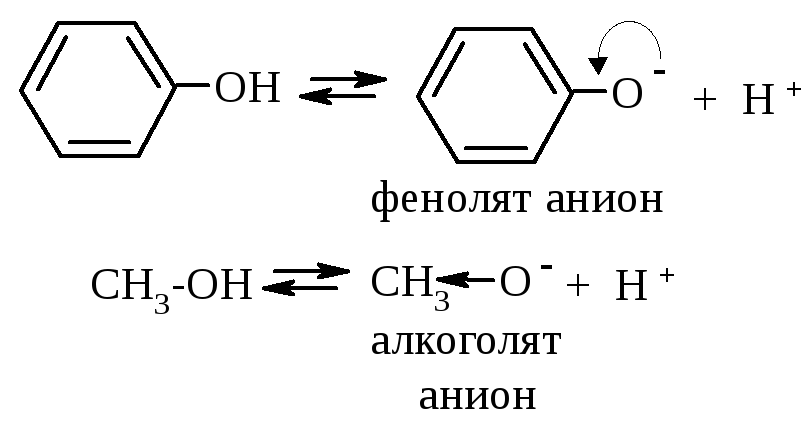 равним
кислотные свойства спиртов
и фенолов.
равним
кислотные свойства спиртов
и фенолов.
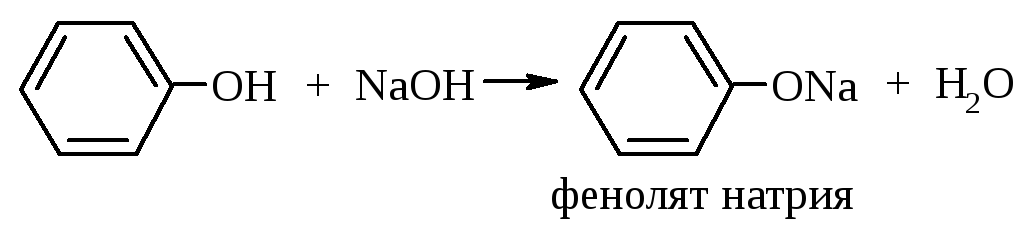
В случае фенолят-аниона (p,π-сопряженная система) степень делокализации заряда гораздо выше, поэтому фенолы более сильные OH-кислоты, чем спирты. Например, фенолы в отличие от спиртов реагируют с щелочами:
Разницу в кислотных свойствах можно подтвердить и величинами pKa: для фенола pKa=10,00; для метанола pKa=16,00.
Фенолы – более сильные кислоты, чем спирты, но и они являются слабыми: фенол не вытесняет угольную кислоту из её солей, т.е. является более слабой кислотой, чем угольная.
Сравнивая кислотные свойства фенолов и карбоновых кислот, нужно отметить, что и фенолят-, и ацилат-анион являются p,π-сопряженными системами, но в ацилат-анионе наблюдается более полная делокализация отрицательного заряда за счёт двух электроотрицательных атомов кислорода:
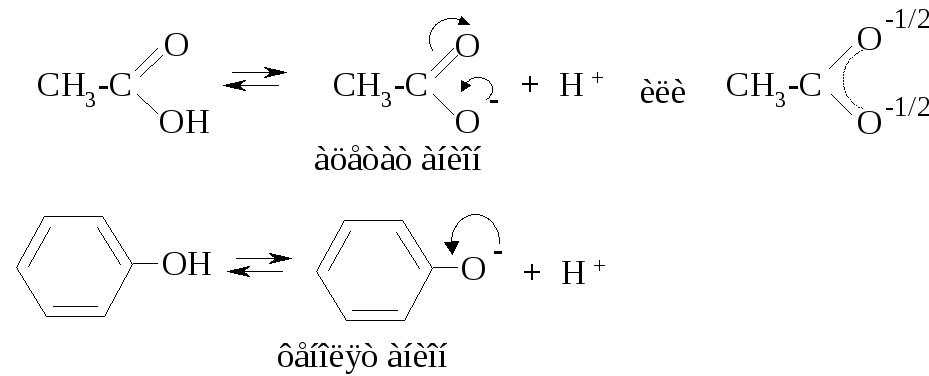
В отличие от фенолов карбоновые кислоты взаимодействуют с гидрокарбонатом натрия:
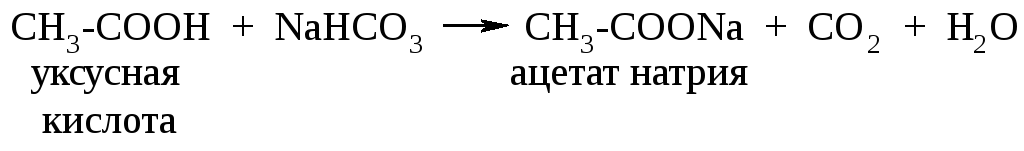 ,
т.е. они явля-
,
т.е. они явля-
ются более сильными кислотами, чем угольная кислота.
Заместители в радикале также влияют на кислотные свойства. Если заместитель способствует делокализации отрицательного заряда в анионе (электроноакцепторный заместитель), то кислотность будет выше. И наоборот, электронодонорные заместители затрудняют делокализацию заряда и поэтому понижают кислотные свойства.
Сравним кислотные свойства следующих соединений: масляная кислота, α-хлормасляная и β-хлормасляные кислоты.
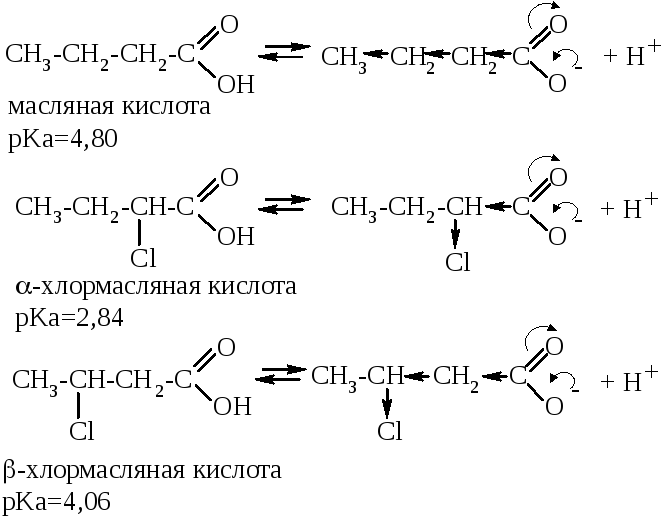
Анион масляной кислоты стабилизируется только за счёт слабого индуктивного эффекта углеводородного радикала. Атом хлора проявляет сильный отрицательный индуктивный эффект, поэтому гораздо более сильно стабилизирует анион кислоты. Так как индуктивный эффект передается с затуханием, влияние хлора в α-положении проявляется сильнее. Итак, самой сильной является α-хлормасляная кислота, затем – β-хлормасляная и, наконец, самая слабая кислота – масляная. Это подтверждается и значениями pKa данных кислот.
В ароматическом ряду электроноакцепторные заместители также способствуют делокализации заряда, таким образом увеличивая кислотные свойства. Электронодонорные заместители оказывают обратное влияние.
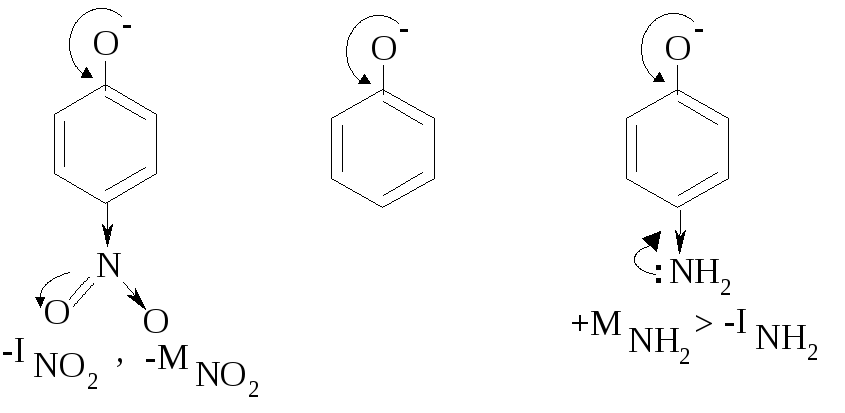
pKa=7,16 pKa=10,0 pKa=10,68
Суммируя все наши рассуждения, можно выстроить ряд убывания кислотных свойств OH-кислот:
карбоновые кислоты > угольная кислота > фенолы > спирты.
(Причем в каждой группе электронодонорные заместители понижают кислотность, а электроноакцепторные – повышают).
