
- •Н.В. Лисицын
- •Содержание
- •1 Ресурсы и ресурсосберегающие технологии
- •1.1 Устойчивое развитие, жизненный цикл
- •1.2 Критерии оценки больших систем
- •1.3 Ресурсосбережение
- •2 Основные термодинамические приложения для анализа химико-технологических систем
- •2.1 Энтропия и ее производство
- •2.2 Первый и второй законы термодинамики. Производство энтропии.
- •2.3 Изменение состава систем. Энтропия процессов смешения и химического превращения
- •2.4 Коэффициент полезного действия систем
- •3 Эффективность карно и потери полезной работы систем
- •3.1 Потребление полезной работы
- •3.2 Уравнение Гюи – Стодолы
- •3.3 Задача производства энтропии в общем виде
- •4. Причины и следствия увеличения энтропии систем
- •4.1 Движущие силы и потоки
- •4.2 Феноменологические законы
- •4.3 Принцип симметрии кинетических коэффициентов
- •4.4 Ограниченность применения линейных законов тепло – и массопереноса
- •5. Энергетические потери и неравновесность
- •5.1 Внутренне обратимый двигатель Карно
- •5.2 Принцип равномерного распределения энергии
- •5.3 Прямоточный и противоточный процессы теплообмена
- •6 Эксергия и эксергетический баланс процесса
- •6.1 Эксергия, энергия Гиббса и полезность
- •6.2 Эксергетический баланс
- •6.3 Физическая эксергия. Эксергия смешения
- •6.4 Качество источников энергии
- •7. Физическая и химическая эксергия
- •7.1 Эксергия компонентов воздуха
- •7.2 Химическая эксергия соединений
- •7.3 Энергия Гиббса образования и химическая эксергия
- •8 Эксергетический и энергетический анализ и балансы
- •8.1 Основные недостатки энергетического анализа систем
- •8.2 Уравнения баланса массы, энергии, эксергии и энтропии
- •9 Анализ процессов производства электроэнергии
- •9.1 Основные процессы производства энергии
- •9.2 Сжигание угля и газа
- •9.3 Термодинамическая эффективность газового цикла
- •9.4 Эффективности парового цикла
- •9.5 Эффективность объединенного цикла
- •10 Анализ процессов разделения
- •10.1 Однократная равновесная перегонка бинарной смеси
- •10.2 Термодинамический анализ идеальной дистилляционной колонны
- •10.3 Анализ реальной колонны
- •11 Анализ химико-технологических систем. Основные правила ресурсосбережения
- •11.1 Процедура анализа систем
- •11.2 Эвристические правила экономии материальных и энергетических ресурсов
- •4. Если химическая реакция протекает с выделением тепла, необходимо ее начинать при повышенной (не при пониженной) температуре (рис.49).
- •12 Методические рекомендации по выполнению контрольных работ
- •13 Контрольные работы
- •13.1 Контрольная работа №1
- •13.2 Контрольная работа №2
- •13.3 Контрольная работа №3
- •Кафедра ресурсосберегающих технологий
- •Теоретические основы энерго- и ресурсосбережения
- •190013, Санкт-Петербург, Московский пр., 26
4. Причины и следствия увеличения энтропии систем
4.1 Движущие силы и потоки
Равновесная термодинамика основана на фундаментальных соотношениях между функциями состояния, такими как температура, давление, состав, объем, внутренняя энергия и т.д. Рассматриваются четко определенные – равновесные состояния и перемещения между ними. Макроскопические потоки энергии и массы, потоки движущих сил, а также потенциальные изменения, такие как изменение давления, температуры или химического потенциала, строго говоря, отсутствуют. Существование неравновесных ситуаций разрешается, т.е. по сути нестабильных, пребывающих вне состояния равновесия, но изменения в них кинетически запрещены. Движущие силы присутствуют, но потоки движущих сил практически равны нулю.
Некоторое непонимание может возникнуть при обсуждении обратимых процессов.
Обратимые процессы имеют место при стремлении всех движущих сил к нулю. Это понятие аналогично, например, изотермическому переносу теплоты, которого в реальности не существует. В ежедневной инженерной практике перенос теплоты требует градиента температуры, перенос вещества – градиента термодинамического потенциала, а химическое превращение – ненулевого сродства между продуктами и реагентами. Действительно, все теплообменники, разделительные колонны, химические реакторы и т.п. работают благодаря движущим силам, которые могут быть определены термодинамически.
Задачей неравновесной термодинамики является расширение результатов равновесной термодинамики в связи с необходимостью определения скоростей процессов, рассматриваемых в технологии.
Скорость
производства энтропии в случае переноса
теплоты в теплообменнике есть простое
произведение термодинамической движущей
силы Х=Δ(1/Т), т.е. естественной причины,
и результирующего потока J
= , т.е. расхода или скорости. Производство
энтропии зависит и от других движущих
сил, таких как разность химического
потенциала или сродства.
Рассмотрим изолированную ХТС, отделенную от окружающей среды жесткой адиабатической стенкой (рис.13). Система состоит из двух разделенных мембраной различных частей, проницаемой для одного из компонентов. В этом случае скорость производства энтропии задается выражением:
 (1)
(1)
|
|
или:
 (2)
(2)
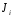 – скорость
потока (расход) теплоты, объема и вещества,
а
– скорость
потока (расход) теплоты, объема и вещества,
а
 – соответствующее сродство или движущая
сила, т.е. Δ(1/Т),
Δ(Р/Т),
Δ(-μ/Т).
– соответствующее сродство или движущая
сила, т.е. Δ(1/Т),
Δ(Р/Т),
Δ(-μ/Т).

Рисунок 13 - Изолированная химико – технологическая система, разделенная мембраной на две части
Постепенно при стремления движущих сил к нулю макроскопических процессов в системе происходить не будет и установится равновесие.
Существование движущих сил автоматически не подразумевает наличия потоков. Существование физических или химических барьеров может исключить образование потока, даже если движущая сила не равна нулю. Это нестабильные положения. Говорят о метастабильной системе в случае, если она локально стабильна, но в более глобальном масштабе нестабильна, или о нестабильной системе в случае локальной нестабильности (рис.14).

Рисунок 14 - Примеры стабильной (а), метастабильной (b) и нестабильной (с) систем
В химической термодинамике рассматривается движущая сила, более известная как химическое сродство. Считается, что условие химического равновесия при заданном давлении Р и температуре Т определяется выражением:
|
|
(3) |
В
этом уравнении
 и
и – стехиометрический коэффициент и
термодинамический потенциалi-ого
компонента, участвующего в химической
реакции, соответственно.
– стехиометрический коэффициент и
термодинамический потенциалi-ого
компонента, участвующего в химической
реакции, соответственно.
 считается положительным для продукта
реакции и отрицательным для реагента.
Химическая реакция будет протекать в
прямом направлении (вправо), если сумма
считается положительным для продукта
реакции и отрицательным для реагента.
Химическая реакция будет протекать в
прямом направлении (вправо), если сумма отрицательна, и в обратном направлении
(влево), если сумма положительна.
Следовательно, химическое сродство
выражается зависимостью:
отрицательна, и в обратном направлении
(влево), если сумма положительна.
Следовательно, химическое сродство
выражается зависимостью:
|
|
(4) |
Если А положительно, то химическая реакция протекает в прямом направлении (вправо). Когда А = 0, наблюдается химическое равновесие.
Другое свойство характеризует глубину протекания реакции и называется степень полноты реакции ξ. Скорость химической реакции и ее степень полноты связаны соотношением:
|
|
(5) |
Вклад
в скорость производства энтропии
 за счет протекания химической реакции
задается выражением:
за счет протекания химической реакции
задается выражением:
|
|
|
или
|
|
(6) |
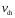 будет
положительно, если А
положительно,
будет
положительно, если А
положительно,
 стремится к нулю приА,
стремящемся к нулю, и при
стремится к нулю приА,
стремящемся к нулю, и при
 устанавливается химическое равновесие
иА=0.
устанавливается химическое равновесие
иА=0.
Движущая сила А/Т соответствует химическим превращениям и дополняет движущие силы, рассмотренные ранее: Δ(1/Т), Δ(Р/Т), Δ(-μ/Т).
Если
одновременно протекают несколько
химических реакций, то суммарное
производство энтропии
 задается уравнением:
задается уравнением:
|
|
(7) |
Каждый вклад в общую скорость должен быть положительным до тех пор, пока реакции не станут сопряженными. В случае сопряженных химических реакций один из вкладов может быть отрицательным (эта реакция перемещается вверх по потенциальной кривой), пока другая из двух сопряженных реакций идет вниз и вносит положительных вклад, достаточный, чтобы сделать положительной всю сумму. Этот случай представляет собой иллюстрацию решения одной из важнейших задач химической промышленности – уменьшение потребления энергии.






