
- •Н.В. Лисицын
- •Содержание
- •1 Ресурсы и ресурсосберегающие технологии
- •1.1 Устойчивое развитие, жизненный цикл
- •1.2 Критерии оценки больших систем
- •1.3 Ресурсосбережение
- •2 Основные термодинамические приложения для анализа химико-технологических систем
- •2.1 Энтропия и ее производство
- •2.2 Первый и второй законы термодинамики. Производство энтропии.
- •2.3 Изменение состава систем. Энтропия процессов смешения и химического превращения
- •2.4 Коэффициент полезного действия систем
- •3 Эффективность карно и потери полезной работы систем
- •3.1 Потребление полезной работы
- •3.2 Уравнение Гюи – Стодолы
- •3.3 Задача производства энтропии в общем виде
- •4. Причины и следствия увеличения энтропии систем
- •4.1 Движущие силы и потоки
- •4.2 Феноменологические законы
- •4.3 Принцип симметрии кинетических коэффициентов
- •4.4 Ограниченность применения линейных законов тепло – и массопереноса
- •5. Энергетические потери и неравновесность
- •5.1 Внутренне обратимый двигатель Карно
- •5.2 Принцип равномерного распределения энергии
- •5.3 Прямоточный и противоточный процессы теплообмена
- •6 Эксергия и эксергетический баланс процесса
- •6.1 Эксергия, энергия Гиббса и полезность
- •6.2 Эксергетический баланс
- •6.3 Физическая эксергия. Эксергия смешения
- •6.4 Качество источников энергии
- •7. Физическая и химическая эксергия
- •7.1 Эксергия компонентов воздуха
- •7.2 Химическая эксергия соединений
- •7.3 Энергия Гиббса образования и химическая эксергия
- •8 Эксергетический и энергетический анализ и балансы
- •8.1 Основные недостатки энергетического анализа систем
- •8.2 Уравнения баланса массы, энергии, эксергии и энтропии
- •9 Анализ процессов производства электроэнергии
- •9.1 Основные процессы производства энергии
- •9.2 Сжигание угля и газа
- •9.3 Термодинамическая эффективность газового цикла
- •9.4 Эффективности парового цикла
- •9.5 Эффективность объединенного цикла
- •10 Анализ процессов разделения
- •10.1 Однократная равновесная перегонка бинарной смеси
- •10.2 Термодинамический анализ идеальной дистилляционной колонны
- •10.3 Анализ реальной колонны
- •11 Анализ химико-технологических систем. Основные правила ресурсосбережения
- •11.1 Процедура анализа систем
- •11.2 Эвристические правила экономии материальных и энергетических ресурсов
- •4. Если химическая реакция протекает с выделением тепла, необходимо ее начинать при повышенной (не при пониженной) температуре (рис.49).
- •12 Методические рекомендации по выполнению контрольных работ
- •13 Контрольные работы
- •13.1 Контрольная работа №1
- •13.2 Контрольная работа №2
- •13.3 Контрольная работа №3
- •Кафедра ресурсосберегающих технологий
- •Теоретические основы энерго- и ресурсосбережения
- •190013, Санкт-Петербург, Московский пр., 26
2.2 Первый и второй законы термодинамики. Производство энтропии.
Первый закон – это закон сохранения энергии.
Для
закрытой системы, которая получает
теплоту из окружающей среды
 и выполняет работу над средой
и выполняет работу над средой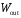 изменение внутренней энергии будет
равно:
изменение внутренней энергии будет
равно:
|
|
(1) |
Теплота и работа – это формы передачи энергии между системой и окружающей средой. Если в систему поступает большее количество теплоты, чем она совершает работы по отношению к среде, то разность между этими величинами накапливается в системе в виде дополнения к внутренней энергии системы U – ее функции состояния. Говоря более обобщенно, первый закон определяет фундаментальную термодинамическую функцию состояния – внутреннюю энергию U.
Уравнение (1) в дифференциальной форме может быть записано в виде:
|
|
(2) |
Для обозначения малых количеств Q и W используется символ δ, так как теплота и работа не являются функциями состояния и зависят от пути перехода процесса между двумя различными положениями.
Если
процесс обратим, и единственным видом
работы, которую система может совершить,
является расширение объема, то изменение
обратимой работы будет равно:
 .
.
Если,
кроме того, процесс изобарный, то
 и
и
|
|
(3) |
Энтальпия
Н
определяется,
как
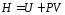 и
представляет собой функцию состояния,
которая выводится из фундаментальной
функции U.
Если теплота обратимо и изобарно
накапливается в системе, то это происходит
в виде роста величины Н
системы. Энтальпия Н
вводится для удобства; эта величина не
имеет фундаментального смысла, кроме
того, что при определенных условиях ее
изменение связано с изменением теплоты,
поглощенной системой.
и
представляет собой функцию состояния,
которая выводится из фундаментальной
функции U.
Если теплота обратимо и изобарно
накапливается в системе, то это происходит
в виде роста величины Н
системы. Энтальпия Н
вводится для удобства; эта величина не
имеет фундаментального смысла, кроме
того, что при определенных условиях ее
изменение связано с изменением теплоты,
поглощенной системой.
Теплоемкость
при постоянном объеме
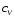 или
давлении
или
давлении
 может быть выражена, соответственно,
через внутреннюю энергию и энтальпию:
может быть выражена, соответственно,
через внутреннюю энергию и энтальпию:
|
|
(4) |
Для расчета и проектирования технологического процесса важно знать, каким образом энтальпия зависит от давления, температуры и состава. В случае давления и температуры дифференциал Н может быть выражен как функция Т и Р:
|
|
(5) |
Первое слагаемое зависит от того, что иногда называют калорическим уравнением состояния, описывающим зависимость внутримолекулярных свойств (свойств внутри молекул), от переменных величин макросостояния. Выражения в скобках основано на уравнении состояния, определяющего зависимость свойства, например, объема V от межмолекулярных взаимодействий, т.е. взаимодействий между молекулами.
Интерес
представляет не абсолютная величина
Н,
а ее изменение
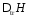 .
Нижний индексtr
обозначает
природу изменения. Если изменение
включает температуру и/или давление
для однофазной системы, индекс не
используется. Однако, в случае фазового
перехода, смешения или химической
реакции используют индексы vap
(исп) для испарения, mix
(см) для смешения или r
(реак) для химической реакции и т.д.
.
Нижний индексtr
обозначает
природу изменения. Если изменение
включает температуру и/или давление
для однофазной системы, индекс не
используется. Однако, в случае фазового
перехода, смешения или химической
реакции используют индексы vap
(исп) для испарения, mix
(см) для смешения или r
(реак) для химической реакции и т.д.
Если
появляется верхний индекс, как, например,
в случае записи
 ,
то это указывает, что изменениеН
рассматривается для переходов при
стандартном
давлении, которое обычно выбирается
равным 1 бар. В случае химической реакции
верхний индекс 0 относится к стандартному
давлению, а также реагентам и продуктам
в виде чистых веществ или, при другой
точке отсчета; стандартное состояние
определяется как бесконечно разбавленный
раствор соединений.
,
то это указывает, что изменениеН
рассматривается для переходов при
стандартном
давлении, которое обычно выбирается
равным 1 бар. В случае химической реакции
верхний индекс 0 относится к стандартному
давлению, а также реагентам и продуктам
в виде чистых веществ или, при другой
точке отсчета; стандартное состояние
определяется как бесконечно разбавленный
раствор соединений.
Рассмотрим
химико-технологическую систему из
теплообменника и турбины (рис. 4).
Рисунок 4 - Схема химико-технологической системы из теплообменника и турбины
Первый закон термодинамики для открытых систем как в случае потоков, протекающих через определенный контролируемый объем (рис.4), находящийся в состоянии покоя, имеет вид:
|
|
(6) |
Для единственного входящего и выходящего потока в устойчивом состоянии это уравнение можно упростить:
|
|
(7) |
где
 –
масса рассматриваемого потока вещества,u
– скорость потока, z
– высота. Точка над переменной означает
ее изменение в единицу времени.
–
масса рассматриваемого потока вещества,u
– скорость потока, z
– высота. Точка над переменной означает
ее изменение в единицу времени.
Второй закон термодинамики связан с направлением процесса. Он определяет фундаментальную функцию энтропии S и утверждает, что любой реальный процесс протекает в направлении увеличения ее общего значения. Иными словами, изменение энтропии системы и окружающей среды в конечном итоге должно быть положительным:
|
|
(8) |
|
|
(9) |
Любой процесс производит энтропию. Наилучшую интерпретацию второго закона дает постулат Больцмана:
|
|
(10) |
Данное уравнение выражает соотношение между энтропией и термодинамической вероятностью Ω, где k – это постоянная Больцмана. Если в изолированном сосуде, заполненном газом, при Т=0 половину молекул от общего объема составляют молекулы азота, а вторую половину – молекулы кислорода, и при этом все молекулы азота сосредоточены в левой половине сосуда, в то время как все молекулы кислорода – в правой, то подобное распределение является чрезвычайно маловероятным.
С течением времени система постепенно придет к такому состоянию, при котором все молекулы будут равномерно распределены в пространстве. Это новое состояние имеет сравнительно высокую термодинамическую вероятность Ω, а производство энтропии будет равно:
|
|
(11) |
Следует обратить внимание, что направление процесса косвенно определено и было названо стрелой времени. Время движется в направлении увеличения энтропии, т.е. по направлению к состоянию с большей термодинамической вероятностью системы и окружающей ее среды, которая, в более широком смысле, составляет вселенную. Необходимо также указать на следствие уравнения (10): если вещество находится при температуре Т=0 К в виде идеального кристалла, то термодинамическая вероятность для него равна Ω=1, а энтропия, S=0.
Согласно классической термодинамики, в противоположность анализу термодинамических циклов Клаузиуса, который увязывает работу и доступное тепло, существует соотношение между энтропией S и теплотой, обратимо привнесенное в систему при температуре Т:
|
|
(12) |
Это соотношение играет важную роль при выводе универсального и фундаментального термодинамического уравнения:
|
|
(13) |
которое часто называют уравнением Гиббса. Из него может быть выражен дифференциал dS в виде функции дифференциалов давления и температуры:
|
|
(14) |
где Р, Т и состав являются переменными, которые наиболее часто используются для определения состояния системы, так как их легко измерить и проконтролировать.
Аналогично уравнению (6) для первого закона для открытых систем, второй закон записывается в виде:
|
|
(15) |
и может быть сведен к уравнению (8) для одного входящего и выходящего потока в контролируемом объеме в уравновешенном состоянии.













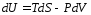 ,
, ,
, ,
,