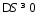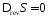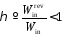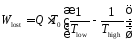- •Н.В. Лисицын
- •Содержание
- •1 Ресурсы и ресурсосберегающие технологии
- •1.1 Устойчивое развитие, жизненный цикл
- •1.2 Критерии оценки больших систем
- •1.3 Ресурсосбережение
- •2 Основные термодинамические приложения для анализа химико-технологических систем
- •2.1 Энтропия и ее производство
- •2.2 Первый и второй законы термодинамики. Производство энтропии.
- •2.3 Изменение состава систем. Энтропия процессов смешения и химического превращения
- •2.4 Коэффициент полезного действия систем
- •3 Эффективность карно и потери полезной работы систем
- •3.1 Потребление полезной работы
- •3.2 Уравнение Гюи – Стодолы
- •3.3 Задача производства энтропии в общем виде
- •4. Причины и следствия увеличения энтропии систем
- •4.1 Движущие силы и потоки
- •4.2 Феноменологические законы
- •4.3 Принцип симметрии кинетических коэффициентов
- •4.4 Ограниченность применения линейных законов тепло – и массопереноса
- •5. Энергетические потери и неравновесность
- •5.1 Внутренне обратимый двигатель Карно
- •5.2 Принцип равномерного распределения энергии
- •5.3 Прямоточный и противоточный процессы теплообмена
- •6 Эксергия и эксергетический баланс процесса
- •6.1 Эксергия, энергия Гиббса и полезность
- •6.2 Эксергетический баланс
- •6.3 Физическая эксергия. Эксергия смешения
- •6.4 Качество источников энергии
- •7. Физическая и химическая эксергия
- •7.1 Эксергия компонентов воздуха
- •7.2 Химическая эксергия соединений
- •7.3 Энергия Гиббса образования и химическая эксергия
- •8 Эксергетический и энергетический анализ и балансы
- •8.1 Основные недостатки энергетического анализа систем
- •8.2 Уравнения баланса массы, энергии, эксергии и энтропии
- •9 Анализ процессов производства электроэнергии
- •9.1 Основные процессы производства энергии
- •9.2 Сжигание угля и газа
- •9.3 Термодинамическая эффективность газового цикла
- •9.4 Эффективности парового цикла
- •9.5 Эффективность объединенного цикла
- •10 Анализ процессов разделения
- •10.1 Однократная равновесная перегонка бинарной смеси
- •10.2 Термодинамический анализ идеальной дистилляционной колонны
- •10.3 Анализ реальной колонны
- •11 Анализ химико-технологических систем. Основные правила ресурсосбережения
- •11.1 Процедура анализа систем
- •11.2 Эвристические правила экономии материальных и энергетических ресурсов
- •4. Если химическая реакция протекает с выделением тепла, необходимо ее начинать при повышенной (не при пониженной) температуре (рис.49).
- •12 Методические рекомендации по выполнению контрольных работ
- •13 Контрольные работы
- •13.1 Контрольная работа №1
- •13.2 Контрольная работа №2
- •13.3 Контрольная работа №3
- •Кафедра ресурсосберегающих технологий
- •Теоретические основы энерго- и ресурсосбережения
- •190013, Санкт-Петербург, Московский пр., 26
2.4 Коэффициент полезного действия систем
В инженерной практике термодинамику используют при решении следующих задач:
– вычисление количества теплоты, выделяющейся или затрачиваемой при проведении процесса,
– определение положения химического или фазового равновесия,
– определение термодинамической эффективности процесса.
Поясним их на конкретном примере. В качестве объекта изучения рассмотрим компрессор (рис.7), для которого требуется вычислить количество работы, необходимой для сжатия газа от давления Р1 и температуры Т1 до давления Р2.
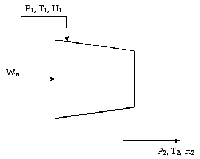
Рисунок 7 - Схема процесса сжатия газа
Согласно первому закону, записанному в виде уравнения (7), которое позволяет перевести первоначальный технический вопрос в один из вопросов термодинамики, следует:
|
|
(39) |
Пусть
сжатие является адиабатическим, т.е. не
происходит теплообмена с окружающей
средой,
 .
.
Следовательно,
работа
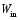 будет известна, если известно изменение
энтальпии газа. Чтобы определить
изменение энтальпии газа, необходимо
знать ее зависимость от давления и
температуры.
будет известна, если известно изменение
энтальпии газа. Чтобы определить
изменение энтальпии газа, необходимо
знать ее зависимость от давления и
температуры.
Примем для простоты, что газ является идеальным. Его энтальпия не зависит от давления. Изменение энтальпии газа вычисляется по формуле:
|
|
(40) |
в которой величину теплоемкости при постоянном давлении считаем не зависящей от температуры. Конечная температура не известна. Чтобы найти ее следует обратиться ко второму закону термодинамики. Так как процесс адиабатический, уравнение (8) можно записать в виде:
|
|
(41) |
Примем, что процесс протекает обратимо, и, следовательно:
|
|
(42) |
Учитывая, что газ ведет себя как идеальный, а теплоемкость не зависит от температуры, можно записать:
|
|
(43) |
Данные
уравнения позволяют вычислить значение
 и
и – работу, необходимую для проведения
процесса, если сжатие происходит
обратимо. Однако, в реальном процессе
– работу, необходимую для проведения
процесса, если сжатие происходит
обратимо. Однако, в реальном процессе и в соответствии с уравнением (43)
температураТ2
должна быть больше чем
и в соответствии с уравнением (43)
температураТ2
должна быть больше чем
 ,
а
,
а .
Следовательно,
.
Следовательно,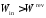 .
Величина отклонения от идеализированного
представления обычно выражается с
помощь коэффициента полезного действия,
в данном случае–
КПД компрессора:
.
Величина отклонения от идеализированного
представления обычно выражается с
помощь коэффициента полезного действия,
в данном случае–
КПД компрессора:
|
|
(44) |
Как было отмечено, второй закон термодинамики для реальных процессов выражает положительное изменение энтропии. Реальное количество работы, необходимое для проведения процесса, больше, чем вычисленное для обратимого или идеального (идеализированного) процесса. Это предполагает наличие связи между ростом энтропии и избыточной работой. Данная гипотеза имеет фундаментальное значение для теоретических основ энерго- и ресурсосбережения.
3 Эффективность карно и потери полезной работы систем
3.1 Потребление полезной работы
Согласно закону сохранения, энергия не потребляется и не исчезает, а может быть преобразована из одного вида в другой. Потребляется не энергия, а ее свойство, которое подразумевает под собой степень доступности энергии для выполнения работы. Так, например, для самопроизвольного горения пригодного газа соблюдаются законы сохранения массы и энергии, но накопленная работа, заключенная в химических связях газа, будет в значительной степени потеряна.
Под потреблением энергии понимается уменьшение полезной работы.
Потери
полезной работы
 обусловлены
ростом энтропии системы.
обусловлены
ростом энтропии системы.
Известный
французский физик и математик Сади
Карно в своей работе «Размышления о
движущей силе огня и о машинах, способных
развивать эту силу» позволил ответить
на вопрос: какая часть теплоты Q,
доступной при
 ,
может быть в конечном итоге переведена
в полезную работу? Он установил, что в
циклическом обратимом процессе (рис.8)
максимальное количество полезной работы
задается уравнением:
,
может быть в конечном итоге переведена
в полезную работу? Он установил, что в
циклическом обратимом процессе (рис.8)
максимальное количество полезной работы
задается уравнением:
|
|
(1) |

Рисунок 8 - Схема идеального теплового двигателя Карно
Множитель
 позднее был назван термодинамической
эффективностьюq
или фактором Карно. Так, например, если
в системе теплота подводится при
температуре 600 К, а температура окружающей
среды равна 300 К, то фактор Карно равен
1/2. Иными словами величина q
на каждый Джоуль теплоты составляет
0,5 Дж/Дж, или, по меньшей мере, половина
подведенных Джоулей теплоты может быть
переведена в полезную работу (в
соответствии с температурой окружающей
среды
позднее был назван термодинамической
эффективностьюq
или фактором Карно. Так, например, если
в системе теплота подводится при
температуре 600 К, а температура окружающей
среды равна 300 К, то фактор Карно равен
1/2. Иными словами величина q
на каждый Джоуль теплоты составляет
0,5 Дж/Дж, или, по меньшей мере, половина
подведенных Джоулей теплоты может быть
переведена в полезную работу (в
соответствии с температурой окружающей
среды
 ):
):
|
|
(2) |
Из
подведенной теплоты в зависимости от
значения температуры
 создается максимально возможная доля
полезной работы, которую может совершить
система. Байер назвал эту часть теплотыэксергией
теплоты. Оставшаяся часть энергии
недоступна для совершения полезной
работы и называется анергией.
Это минимальная часть начальной теплоты,
которая будет передана в окружающую
среду в виде теплоты
создается максимально возможная доля
полезной работы, которую может совершить
система. Байер назвал эту часть теплотыэксергией
теплоты. Оставшаяся часть энергии
недоступна для совершения полезной
работы и называется анергией.
Это минимальная часть начальной теплоты,
которая будет передана в окружающую
среду в виде теплоты
 .
Пользуясь терминологией Байера, можно
сказать, что в этом случае для идеального
теплового двигателя будет достигнуто
следующее разделение полезной энергии
и анергии (Джоуль):
.
Пользуясь терминологией Байера, можно
сказать, что в этом случае для идеального
теплового двигателя будет достигнуто
следующее разделение полезной энергии
и анергии (Джоуль):
|
|
(3) |
Полный
цикл требует количества энергии Q,
при этом совершается работу
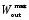 и при температуре
и при температуре выделяется в окружающую среду количество
теплоты, равное:
выделяется в окружающую среду количество
теплоты, равное:

Уравнение (3) представляет собой выражение первого закона термодинамики для случая разделения полезной энергии и анергии, получаемой в виде теплоты.
Следует заметить, что уравнение (1) не является выражением первого закона термодинамики, а представляет собой следствие второго закона.
Стоит также отметить формулировки Байера для первого и второго законов:
1. Сумма эксергии и анергии всегда постоянна.
2. Анергия никогда не может быть обращена в эксергию.
Замечание.
Здесь и далее термодинамическая
эффективность систем рассматривается
при условии
 .
В случае, когда это условие не выполняется,
т.е. при передачи теплоты при температурах
ниже температуры окружающей среды (т.е.T
< T0),
эффективность формально будет
отрицательной
q
<
0, что подразумевает разнонаправленность
потоков эксергии и энергии. При q
< –1
величина потока эксергии превышает
величину потока энергии, что соответствует
Т
< Т0/2
(рис. 9)
.
В случае, когда это условие не выполняется,
т.е. при передачи теплоты при температурах
ниже температуры окружающей среды (т.е.T
< T0),
эффективность формально будет
отрицательной
q
<
0, что подразумевает разнонаправленность
потоков эксергии и энергии. При q
< –1
величина потока эксергии превышает
величину потока энергии, что соответствует
Т
< Т0/2
(рис. 9)

Рисунок 9 - График зависимости термодинамической эффективности q от отношения температур T/T0
Рассмотрим потребление полезной работы на примере анализа теплообменника.
Пусть
теплообмен происходит между конденсирующейся
жидкостью при температуре Thigh
и испаряющейся жидкостью при температуре
 при этомThigh
>Tlow
>T0
(рис.10). Скорости потоков вещества таковы,
что внутри теплообменника вся нагретая
до более высокой температуры жидкость
конденсируется, а вся жидкость, находящаяся
при более низкой температуре, испаряется.
Предполагается, что теплообменник не
обменивается теплотой с окружающей
средой, т.е. процесс адиабатический. Для
установившегося процесса, если изменения
кинетической и потенциальной энергии
малы по сравнению с изменением энтальпии,
энергетический баланс может быть записан
следующим образом:
при этомThigh
>Tlow
>T0
(рис.10). Скорости потоков вещества таковы,
что внутри теплообменника вся нагретая
до более высокой температуры жидкость
конденсируется, а вся жидкость, находящаяся
при более низкой температуре, испаряется.
Предполагается, что теплообменник не
обменивается теплотой с окружающей
средой, т.е. процесс адиабатический. Для
установившегося процесса, если изменения
кинетической и потенциальной энергии
малы по сравнению с изменением энтальпии,
энергетический баланс может быть записан
следующим образом:
|
|
(4) |
Количество теплоты, вовлеченной в процесс обмена и поглощаемой испаряющейся жидкостью в единицу времени, при потоке теплоты Q, является положительной величиной и задается уравнением:
|
|
(5) |
Этот поток теплоты движется самопроизвольно от Thigh к Tlow.
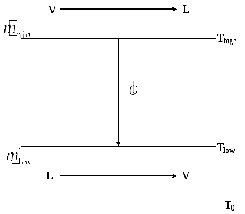
Рисунок
10
- Схема теплообменника,
в котором теплота конденсации жидкости
при Thigh
переходит к испаряющейся жидкости при
температуре
 .
.
Thigh
>Tlow
>T0
, V
и L
–
соответственно газ и жидкость,
 –
массовый расход.
–
массовый расход.
При более высокой температуре эксергия, или полезная работа, задается уравнением:
|
|
(6) |
При более низкой температуре она уменьшается, и полезная работа становится меньше:
|
|
(7) |
Следовательно, теплообмен протекает со скоростью, равной скорости уменьшения полезной работы:
|
|
(8) |
Если выражение привести к единице массы, а не к единице времени, оно примет вид:
|
|
(8a) |
Фактор Карно отложен на графике (рис.11) как функция количества переданной теплоты. Потери полезной работы показаны заштрихованной площадью.
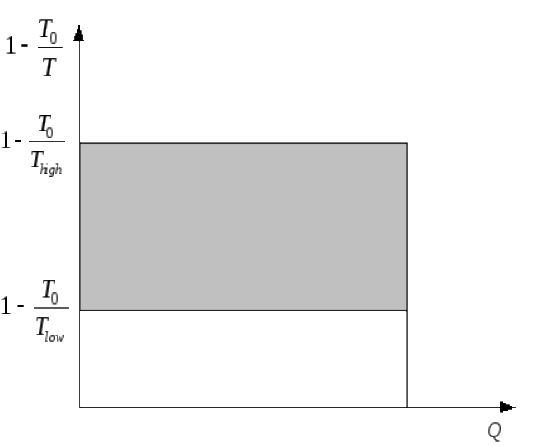
Рисунок 11 - Зависимости фактора Карно от подведенной теплоты
Величина в скобках в уравнении (8) может быть определена как «движущая сила» теплопереноса, но вместо известного соотношения для движущей силы
|
|
|
предполагается, что термодинамическая движущая сила равна
|
|
|
Таким
образом, потери полезной работы
представляют собой произведение
 ,Q
и
,Q
и
 ,
т.е. фактически произведение потока
теплоты и его движущей силы.
,
т.е. фактически произведение потока
теплоты и его движущей силы.