
- •Н.В. Лисицын
- •Содержание
- •1 Ресурсы и ресурсосберегающие технологии
- •1.1 Устойчивое развитие, жизненный цикл
- •1.2 Критерии оценки больших систем
- •1.3 Ресурсосбережение
- •2 Основные термодинамические приложения для анализа химико-технологических систем
- •2.1 Энтропия и ее производство
- •2.2 Первый и второй законы термодинамики. Производство энтропии.
- •2.3 Изменение состава систем. Энтропия процессов смешения и химического превращения
- •2.4 Коэффициент полезного действия систем
- •3 Эффективность карно и потери полезной работы систем
- •3.1 Потребление полезной работы
- •3.2 Уравнение Гюи – Стодолы
- •3.3 Задача производства энтропии в общем виде
- •4. Причины и следствия увеличения энтропии систем
- •4.1 Движущие силы и потоки
- •4.2 Феноменологические законы
- •4.3 Принцип симметрии кинетических коэффициентов
- •4.4 Ограниченность применения линейных законов тепло – и массопереноса
- •5. Энергетические потери и неравновесность
- •5.1 Внутренне обратимый двигатель Карно
- •5.2 Принцип равномерного распределения энергии
- •5.3 Прямоточный и противоточный процессы теплообмена
- •6 Эксергия и эксергетический баланс процесса
- •6.1 Эксергия, энергия Гиббса и полезность
- •6.2 Эксергетический баланс
- •6.3 Физическая эксергия. Эксергия смешения
- •6.4 Качество источников энергии
- •7. Физическая и химическая эксергия
- •7.1 Эксергия компонентов воздуха
- •7.2 Химическая эксергия соединений
- •7.3 Энергия Гиббса образования и химическая эксергия
- •8 Эксергетический и энергетический анализ и балансы
- •8.1 Основные недостатки энергетического анализа систем
- •8.2 Уравнения баланса массы, энергии, эксергии и энтропии
- •9 Анализ процессов производства электроэнергии
- •9.1 Основные процессы производства энергии
- •9.2 Сжигание угля и газа
- •9.3 Термодинамическая эффективность газового цикла
- •9.4 Эффективности парового цикла
- •9.5 Эффективность объединенного цикла
- •10 Анализ процессов разделения
- •10.1 Однократная равновесная перегонка бинарной смеси
- •10.2 Термодинамический анализ идеальной дистилляционной колонны
- •10.3 Анализ реальной колонны
- •11 Анализ химико-технологических систем. Основные правила ресурсосбережения
- •11.1 Процедура анализа систем
- •11.2 Эвристические правила экономии материальных и энергетических ресурсов
- •4. Если химическая реакция протекает с выделением тепла, необходимо ее начинать при повышенной (не при пониженной) температуре (рис.49).
- •12 Методические рекомендации по выполнению контрольных работ
- •13 Контрольные работы
- •13.1 Контрольная работа №1
- •13.2 Контрольная работа №2
- •13.3 Контрольная работа №3
- •Кафедра ресурсосберегающих технологий
- •Теоретические основы энерго- и ресурсосбережения
- •190013, Санкт-Петербург, Московский пр., 26
6.2 Эксергетический баланс
Если
поток переводится от условий
 и
и к условиям
к условиям и
и без изменения состава, изменение эксергии
равно:
без изменения состава, изменение эксергии
равно:
|
|
(16) |
ΔEx
– минимальное количество работы, которое
необходимо совершить для осуществления
этого изменения в термодинамических
условиях. Причем величины в правой части
уравнения (16) представляют собой
наибольшую работу, которую единица
массы потока может совершить, если поток
обратимо переводится из
состояния 1 и из
состояния
2, к
температуре
 и давлению
и давлению окружающей
среды. Каждый из них к условиям окружающей
среды, а не один к другому!
окружающей
среды. Каждый из них к условиям окружающей
среды, а не один к другому!
Поскольку эксергия определена в понятиях работы, эксергический баланс процесса, включая его взаимодействие с окружающей средой, позволяет найти источники потерь эксергии, которые точно соответствуют энергетическим потерям, связанным с неравновесностью. Таким образом:
|
|
(17) |
Следует заметить, что определение количества энергии, потерянной в связи с неравновесностью процесса, не требует понятия эксергии. В соответствии с уравнения (10), общая величина ΔН и ΔS зависит от наименьшего количества энергии, необходимой для изменения условий. Большее количество энергии, приложенной к процессу, чем строго необходимое, согласно уравнению (10), должно представлять собой энергию, которая рассеивается на преодоление сил трения.
Уравнение
(10) приводит к определению эксергии, в
то время как аналогичное выражение
 – нет.
– нет.
Оба уравнения внешне одинаковы и выражают наименьшее количество энергии, необходимое для изменения условий определенного количества вещества из состояния 1 в состояние 2. Однако, если выбрано состояние 1 как состояние окружающей среды, то именно эта окружающая среда становится точкой отсчета для рассматриваемого свойства определенного количества вещества.
6.3 Физическая эксергия. Эксергия смешения
Теперь рассмотрим, как эксергия рассчитывается. Для начала попробуем выполнить расчет эксергии среды, которая нас окружает, а именно эксергию воздуха.
Воздух
при условии окружающей среды
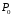 и
и не в состоянии совершить какую бы то ни
было работу. В соответствии с уравнением
(12), его эксергия равна нулю. Однако, при
параметрах отличных от параметров
окружающей среды воздух работу совершать
уже может. Так, например, при при давлении
в 10 бар и той же температуре окружающей
среды, он обладает эксергией отличной
от нуля, так как, хотя
не в состоянии совершить какую бы то ни
было работу. В соответствии с уравнением
(12), его эксергия равна нулю. Однако, при
параметрах отличных от параметров
окружающей среды воздух работу совершать
уже может. Так, например, при при давлении
в 10 бар и той же температуре окружающей
среды, он обладает эксергией отличной
от нуля, так как, хотя (идеальный газ), но
(идеальный газ), но и
соответственно,
и
соответственно, .
Действительно, 1 моль воздуха при 10 бар
потенциально может совершить работу,
перемещаясь в окружающую среду,
находящуюся при атмосферном давлении.
Его максимально вожможная работа
называется эксергией воздуха при 10 бар
и температуре окружающей среды. С другой
стороны, требуется затратить по меньшей
мере точно такое же количество энергии
(6 кДж/моль), чтобы перевести воздух от
условий окружающей среды
.
Действительно, 1 моль воздуха при 10 бар
потенциально может совершить работу,
перемещаясь в окружающую среду,
находящуюся при атмосферном давлении.
Его максимально вожможная работа
называется эксергией воздуха при 10 бар
и температуре окружающей среды. С другой
стороны, требуется затратить по меньшей
мере точно такое же количество энергии
(6 кДж/моль), чтобы перевести воздух от
условий окружающей среды
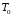 к воздуху при давлении в 10 бар и температуре
окружающей среды.
к воздуху при давлении в 10 бар и температуре
окружающей среды.
Теперь
попробуем понять, обладает ли эксергией
хорошо всем знакомый природный газ. Для
простоты будем считать его состоящим
полностью из метана. На основании
предыдущих рассуждений можно предпожить,
что эксергия некоторого количества
природного газа при условиях окружающей
среды, равна нулю. Действительно,
используя уравнение (12), мы получим
значение эксергии, равное нулю. Но этот
расчет учитывает различия только
физических
параметров состояния метана и окружающей
его среды – давления и температуры.
Химический состав метана отличен от
состава окружающей среды. Говоря более
корректно, метан – это источник эксергии
химического происхождения. Взаимодействуя
с одним из компонентов воздуха –
кислородом, он может быть преобразован
в два других компонента окружающей
среды –
 и
и .
.
Следовательно, существует разница между физической и химической эксергией и справедливо выражение:
|
|
(18) |
Первое слагаемое правой части уравнения (18) – физическая составляющая эксергии (или просто физическая эксергия) – выражает количество энергии, доступное в связи с разностью в значениях температуры и давления по сравнению с окружающей средой. Второе слагаемое – химическая эксергия – выражает количество энергии, доступное из–за разности состава по сравнению с окружающей средой. Верхний индекс свидетельствует о том, что эксергия относится к условиям окружающей среды.
В таблице 2 представлены величины эксергии метана. Из приведенных данных видно, что метан содержит внушительное количество эксергии в виде ее химической составляющей. Прослеживается влияние роста давления и температуры на физическую эксергию, хотя вклад физической составляющей в значение эксергии метана примерно на два порядка меньше химической эксергии.
Таблица 2 - Значения эксергии метана, кДж/моль
|
P,бар |
Т,оС |
|
|
|
|
1 |
25 |
0.0 |
831.6 |
831.6 |
|
100 |
25 |
11.0 |
831.6 |
842.6 |
|
100 |
100 |
11.3 |
831.6 |
842.9 |
Рассмотрим далее, что происходит с эксергией при проведении технологических процессов. Начнем с процесса, который используется во всех ХТС – процесса смешения, в связи с чем, в качестве примера, выполним анализ адиабатического смешивания двух потоков жидкой воды со скоростями и температурами, соответственно, 1 кг/с при 0°С и 1 кг/с при 100°С, в результате которого образуется поток жидкой воды со скоростью 2 кг/с. Процесс проводится при температуре окружающей среды, равной 25°С (рис. 25).

Рисунок 25 - Схема смешивания горячего и холодного потоков
Анализ требует расчета скоростей потоков эксергии при 0°С, 50°С и 100°С. Так как по условиям задачи передача теплоты не происходит, изменение энтальпии системы в соответствие с уравнением (1) равно нулю:
|
|
(19) |
при этом выполняется следующий массовый (материальный) баланс:
|
|
(20) |
Умножая
уравнение (20) на
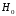 – энтальпию жидкой воды при температуре
– энтальпию жидкой воды при температуре ,
и вычитая полученный результат из
уравнения (19), будем иметь:
,
и вычитая полученный результат из
уравнения (19), будем иметь:
|
|
(21) |
Для простоты расчетов будем считать, что теплоемкость жидкой воды постоянна, а изменением энтальпии от давления можно пренебречь. Тогда:
|
|
(22) |
С
учетом формулы (22) из уравнения (21),
вычисляем температуру потока, выходящего
из смесителя:
 =323,15 К.
=323,15 К.
Расчет скоростей потоков эксергии выполняем по уравнению:
|
|
(23) |
Неизвестные значения энтропий вычисляем по формуле
 (24)полученной, исходя
из решения известного уравнения
(24)полученной, исходя
из решения известного уравнения
|
|
|
|
|
|
в котором принимаем те же допущения, что и при выводе выражения для энтальпии (уравнение (22)). Результаты расчетов в виде диаграммы Грасманна приведены на рис.26.
 Рисунок
26
- Диаграмма потоков эксергии смешения
горячей и холодной воды
Рисунок
26
- Диаграмма потоков эксергии смешения
горячей и холодной воды
Диаграмма показывает «ценность» каждого потока с точки зрения его способности, или потенциала, к совершению работы. Она также показывает, что значительное количество эксергии, поступающее в систему, в результате процесса смешения рассеивается.
Следует заметить, что для определения энергетических потерь необязательно использовать эксергию. Другой путь вычисления потерь основан на решении уравнения Гюи – Стодолы:
|
|
(25) |
и расчета величины производства энтропии. В нашем случае – по формуле:
|
|
(26) |
или:
|
|
(27) |
Расчет
потерь полезной работы не определяет
ход приведения процесса, в то время, как
эксергический анализ дает ясное
представление о величине потоков и
эффективности процесса
 в понятиях эксергии:
в понятиях эксергии:
|
|
(28) |
Для
рассматриваемого примера
 ,
откуда можно сделать вывод о том, что
около 80% исходной эксергии в ходе процесса
смешения теряется, а сам процесс возможен
только благодаря разнице температур
исходных потоков (100°С), которая в ходе
процесса уменьшается до нуля.
,
откуда можно сделать вывод о том, что
около 80% исходной эксергии в ходе процесса
смешения теряется, а сам процесс возможен
только благодаря разнице температур
исходных потоков (100°С), которая в ходе
процесса уменьшается до нуля.
Известное уравнение
|
|
|
позволяет также указать на причины итоговой величины потерь.

















