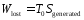- •Н.В. Лисицын
- •Содержание
- •1 Ресурсы и ресурсосберегающие технологии
- •1.1 Устойчивое развитие, жизненный цикл
- •1.2 Критерии оценки больших систем
- •1.3 Ресурсосбережение
- •2 Основные термодинамические приложения для анализа химико-технологических систем
- •2.1 Энтропия и ее производство
- •2.2 Первый и второй законы термодинамики. Производство энтропии.
- •2.3 Изменение состава систем. Энтропия процессов смешения и химического превращения
- •2.4 Коэффициент полезного действия систем
- •3 Эффективность карно и потери полезной работы систем
- •3.1 Потребление полезной работы
- •3.2 Уравнение Гюи – Стодолы
- •3.3 Задача производства энтропии в общем виде
- •4. Причины и следствия увеличения энтропии систем
- •4.1 Движущие силы и потоки
- •4.2 Феноменологические законы
- •4.3 Принцип симметрии кинетических коэффициентов
- •4.4 Ограниченность применения линейных законов тепло – и массопереноса
- •5. Энергетические потери и неравновесность
- •5.1 Внутренне обратимый двигатель Карно
- •5.2 Принцип равномерного распределения энергии
- •5.3 Прямоточный и противоточный процессы теплообмена
- •6 Эксергия и эксергетический баланс процесса
- •6.1 Эксергия, энергия Гиббса и полезность
- •6.2 Эксергетический баланс
- •6.3 Физическая эксергия. Эксергия смешения
- •6.4 Качество источников энергии
- •7. Физическая и химическая эксергия
- •7.1 Эксергия компонентов воздуха
- •7.2 Химическая эксергия соединений
- •7.3 Энергия Гиббса образования и химическая эксергия
- •8 Эксергетический и энергетический анализ и балансы
- •8.1 Основные недостатки энергетического анализа систем
- •8.2 Уравнения баланса массы, энергии, эксергии и энтропии
- •9 Анализ процессов производства электроэнергии
- •9.1 Основные процессы производства энергии
- •9.2 Сжигание угля и газа
- •9.3 Термодинамическая эффективность газового цикла
- •9.4 Эффективности парового цикла
- •9.5 Эффективность объединенного цикла
- •10 Анализ процессов разделения
- •10.1 Однократная равновесная перегонка бинарной смеси
- •10.2 Термодинамический анализ идеальной дистилляционной колонны
- •10.3 Анализ реальной колонны
- •11 Анализ химико-технологических систем. Основные правила ресурсосбережения
- •11.1 Процедура анализа систем
- •11.2 Эвристические правила экономии материальных и энергетических ресурсов
- •4. Если химическая реакция протекает с выделением тепла, необходимо ее начинать при повышенной (не при пониженной) температуре (рис.49).
- •12 Методические рекомендации по выполнению контрольных работ
- •13 Контрольные работы
- •13.1 Контрольная работа №1
- •13.2 Контрольная работа №2
- •13.3 Контрольная работа №3
- •Кафедра ресурсосберегающих технологий
- •Теоретические основы энерго- и ресурсосбережения
- •190013, Санкт-Петербург, Московский пр., 26
3.2 Уравнение Гюи – Стодолы
Если
тело или газ изотермически поглощает
положительное количество теплоты
 при температуреТ,
тогда изменение его энтропии задается
уравнением:
при температуреТ,
тогда изменение его энтропии задается
уравнением:
|
|
(9) |
Используя это выражение, можно переписать правую часть уравнения (8а) следующим образом:
|
|
(10) |
где
∆S
– изменение энтропии теплообменника.
При адиабатическом процессе одновременного
изменения энтропии окружающей среды
не происходит
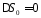 ,
и, следовательно, второй закон может
быть формально представлен так:
,
и, следовательно, второй закон может
быть формально представлен так:
|
|
(11) |
что, в свою очередь, позволяет представить уравнения (10) в виде:
|
|
(12) |
Последнее достаточно простое соотношение между величиной потерь полезной работы и увеличением энтропии в ходе процесса носит название уравнения Гюи – Стодолы.
Из
инженерной практики известно, что
количество передаваемой в теплообменнике
теплоты пропорционально разности
температур и поверхности теплообмена.
Но, как только что установлено, ,
а не ∆Т,
является движущей силой потока теплоты.
Поэтому в первом приближении можно
записать:
,
а не ∆Т,
является движущей силой потока теплоты.
Поэтому в первом приближении можно
записать:
|
|
(13) |
где
 – общий термодинамический коэффициент
теплопереноса,А
– поверхность теплообменника. Подставив
данное выражение в уравнение (8), можно
получить:
– общий термодинамический коэффициент
теплопереноса,А
– поверхность теплообменника. Подставив
данное выражение в уравнение (8), можно
получить:
|
|
(14) |
Последнее
уравнение свидетельствует о том, что
величина потерь пропорционально
квадрату движущей силы. С другой стороны,
из уравнения (13) следует, что в случае
передачи теплоты Q,
стремление инженера уменьшить движущую
силу (чтобы уменьшить потери) должно
компенсироваться или материалом
теплообменника с более высокой
теплопроводностью (т.е. большим значением
 ),
или большей поверхностью теплообменника.
Указанные зависимости отражают
экономическую необходимость одновременного
проведения оптимизации стоимости
оборудования и стоимости энергии.
),
или большей поверхностью теплообменника.
Указанные зависимости отражают
экономическую необходимость одновременного
проведения оптимизации стоимости
оборудования и стоимости энергии.
3.3 Задача производства энтропии в общем виде
Рассмотрим
задачу производства энтропии в более
общем виде, для чего представим
установившийся поток, который выполняет
работу
 (рис. 12). Теплообмен происходит только
с окружающей средой при температуре
(рис. 12). Теплообмен происходит только
с окружающей средой при температуре .
Принимается, что поток не подвергается
значительным изменениям скорости или
высоты, т.е. макроскопическими изменениями
кинетической и потенциальной энергии
можно пренебречь.
.
Принимается, что поток не подвергается
значительным изменениям скорости или
высоты, т.е. макроскопическими изменениями
кинетической и потенциальной энергии
можно пренебречь.

Рисунок 12 - Выполнение работы и обмен теплотой с окружающей средой при переходе рабочей жидкости из состояния 1 в состояние 2.
Первый закон термодинамики для рассматриваемой системы имеет вид:
|
|
(15) |
Второй закон представлен, как и ранее:
|
|
(16) |
Объединив эти уравнения, используя известное соотношение:
|
|
(17) |
а
также, исключая
 и
и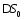 ,
выведем следующее уравнение:
,
выведем следующее уравнение:
|
|
(18) |
где ∆H и ∆S выражают изменения энтальпии и энтропии потока при переходе из состояния 1 в состояние 2, например:
|
|
(19) |
Очевидно, что минимальное количество работы, необходимое для совершения данного изменения в указанных условиях, задается уравнением:
|
|
(20) |
Согласно
второму закону,
 ;
тогда реальное количество затраченной
работы будет больше:
;
тогда реальное количество затраченной
работы будет больше:
|
|
(21) |
Количество потерь определяется так:
|
|
(22) |
что приводит к тому же уравнению Гюи – Стодолы:
|
|
(23) |
Соотношение (23), выполняется для общего обмена теплотой и работой между средой потока и ее окружением. Обобщенная формулировка второго закона
|
|
(24) |
находит здесь ясную и недвусмысленную формулировку с позиции хорошо известных переменных – давления и температуры.
Фактор Карно количественно выражает, какая доля теплоты превращается в полезную работу. Теплота самопроизвольно переходит от более нагретой зоны к менее нагретой и доля теплоты, способной превратиться в полезную работу, падает. Качество теплоты определяется как ее наибольший потенциал для совершения работы по отношению к определенной окружающей среде. Обычно это среда, внутри которой протекает процесс. Полностью теплота теряет способность совершать работу при температуре, равной температуре окружающей среды.