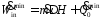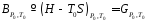- •Н.В. Лисицын
- •Содержание
- •1 Ресурсы и ресурсосберегающие технологии
- •1.1 Устойчивое развитие, жизненный цикл
- •1.2 Критерии оценки больших систем
- •1.3 Ресурсосбережение
- •2 Основные термодинамические приложения для анализа химико-технологических систем
- •2.1 Энтропия и ее производство
- •2.2 Первый и второй законы термодинамики. Производство энтропии.
- •2.3 Изменение состава систем. Энтропия процессов смешения и химического превращения
- •2.4 Коэффициент полезного действия систем
- •3 Эффективность карно и потери полезной работы систем
- •3.1 Потребление полезной работы
- •3.2 Уравнение Гюи – Стодолы
- •3.3 Задача производства энтропии в общем виде
- •4. Причины и следствия увеличения энтропии систем
- •4.1 Движущие силы и потоки
- •4.2 Феноменологические законы
- •4.3 Принцип симметрии кинетических коэффициентов
- •4.4 Ограниченность применения линейных законов тепло – и массопереноса
- •5. Энергетические потери и неравновесность
- •5.1 Внутренне обратимый двигатель Карно
- •5.2 Принцип равномерного распределения энергии
- •5.3 Прямоточный и противоточный процессы теплообмена
- •6 Эксергия и эксергетический баланс процесса
- •6.1 Эксергия, энергия Гиббса и полезность
- •6.2 Эксергетический баланс
- •6.3 Физическая эксергия. Эксергия смешения
- •6.4 Качество источников энергии
- •7. Физическая и химическая эксергия
- •7.1 Эксергия компонентов воздуха
- •7.2 Химическая эксергия соединений
- •7.3 Энергия Гиббса образования и химическая эксергия
- •8 Эксергетический и энергетический анализ и балансы
- •8.1 Основные недостатки энергетического анализа систем
- •8.2 Уравнения баланса массы, энергии, эксергии и энтропии
- •9 Анализ процессов производства электроэнергии
- •9.1 Основные процессы производства энергии
- •9.2 Сжигание угля и газа
- •9.3 Термодинамическая эффективность газового цикла
- •9.4 Эффективности парового цикла
- •9.5 Эффективность объединенного цикла
- •10 Анализ процессов разделения
- •10.1 Однократная равновесная перегонка бинарной смеси
- •10.2 Термодинамический анализ идеальной дистилляционной колонны
- •10.3 Анализ реальной колонны
- •11 Анализ химико-технологических систем. Основные правила ресурсосбережения
- •11.1 Процедура анализа систем
- •11.2 Эвристические правила экономии материальных и энергетических ресурсов
- •4. Если химическая реакция протекает с выделением тепла, необходимо ее начинать при повышенной (не при пониженной) температуре (рис.49).
- •12 Методические рекомендации по выполнению контрольных работ
- •13 Контрольные работы
- •13.1 Контрольная работа №1
- •13.2 Контрольная работа №2
- •13.3 Контрольная работа №3
- •Кафедра ресурсосберегающих технологий
- •Теоретические основы энерго- и ресурсосбережения
- •190013, Санкт-Петербург, Московский пр., 26
6 Эксергия и эксергетический баланс процесса
6.1 Эксергия, энергия Гиббса и полезность
Каждая химико-технологическая система несет энергетические потери. Это верно для процессов, в ходе которых энергия выделяется, точно так же, как и для процессов, в ходе которых энергия поглощается. Задача заключается в том, чтобы понять природу потерь и применить правильный подход для их уменьшения.
Исследуем
процесс с установившимися потоками, в
ходе которого теплота передается
окружающей среде со скоростью
 и рассмотрим поток, изначально находящийся
при некоторых условиях
и рассмотрим поток, изначально находящийся
при некоторых условиях и
и и потребляемый энергию со скоростью
и потребляемый энергию со скоростью ,
чтобы достичь состояния с параметрамиР
и Т
(рис.24). Макроскопическими изменениями
кинетической и/или потенциальной энергии
потока будем пренебрегать.
,
чтобы достичь состояния с параметрамиР
и Т
(рис.24). Макроскопическими изменениями
кинетической и/или потенциальной энергии
потока будем пренебрегать.

Рисунок
24
- Обмен работой (энергией) и теплотой с
окружающей средой при изменении
параметров потока от
 ,
, доР
и Т.
доР
и Т.
Для исследуемого потока, используя первый и второй законы термодинамики, можно записать:
|
|
(1) |
|
|
(2) |
где
|
|
(3) |
|
|
(4) |
 – скорость
изменения энтропии окружающей среды,
– скорость
изменения энтропии окружающей среды,
Минимально
необходимое количество энергии, для
изменения состояния потока (от
 ,
, доР
и Т),
будет равно:
доР
и Т),
будет равно:
|
|
(5) |
или даже
|
|
(6) |
Вводя
 (вместо
(вместо ),
будем полагать, что теплота, передаваемая
в окружающую среду, потенциально не
должна исчезать с целью достижения
истинного минимума величины
),
будем полагать, что теплота, передаваемая
в окружающую среду, потенциально не
должна исчезать с целью достижения
истинного минимума величины .
Минимальная скорость поступления
энергии связана с наименьшей отдачей
теплоты, так как величина
.
Минимальная скорость поступления
энергии связана с наименьшей отдачей
теплоты, так как величина зафиксирована выбором определенной
скорости потока вещества и термодинамическими
условиями начального и конечного
состояний. Используя соотношение:
зафиксирована выбором определенной
скорости потока вещества и термодинамическими
условиями начального и конечного
состояний. Используя соотношение:
|
|
(7) |
и объединяя уравнения (2) и (6) находим:
|
|
(8) |
Истинный минимум будет, конечно, требовать отсутствия в процессе движущих сил:
|
|
(9) |
Следовательно, наименьшее количество энергии, необходимое для перевода системы к требуемым условиям, будет равно:
|
|
(10) |
Если
работу
 привести
кединице
массы, получим выражение:
привести
кединице
массы, получим выражение:
|
|
(11) |
где Ех – эксергия.
Эксергия, таким образом, – это работа, которую единица массы потока может совершить, если она обратимо приводится к условиям окружающей среды.
Уравнение (11) может быть записано в виде:
|
|
(12) |
Иногда
разность
 называют полезностью,
называют полезностью, ,
что исходит из названия «полезная
работа». Однако, эксергия и полезность
не одно и то же. Из уравнения (12) следует,
что эксергия равна:
,
что исходит из названия «полезная
работа». Однако, эксергия и полезность
не одно и то же. Из уравнения (12) следует,
что эксергия равна:
|
|
(13) |
В
соответствии с определением эксергия
при
 и
и будет равна нулю, но это не означает,
что
будет равна нулю, но это не означает,
что также равно нулю, поскольку
также равно нулю, поскольку
|
|
(14) |
т.е. полезность в условиях окружающей среды представляет собой энергию Гиббса при этих условиях.
Если эксергия при нулевых параметрах окружающей среды равна нулю, то функция (14) точно неопределима, так как содержит в себе энтальпию Н и, следовательно, внутреннюю энергию U как функцию неизвестной абсолютной величины. В термодинамике нулевой уровень часто выбирают произвольно. Так, в случае воды температура плавления является нулевой точкой для энтальпии жидкой воды.
За
исключением нулевых начальных условий
 ,
, ,
выражение для полезности при условияхР
и Т
можно записать в виде:
,
выражение для полезности при условияхР
и Т
можно записать в виде:
|
|
(15) |
что не будет ошибочным и для энергии Гиббса при условиях Р и Т.