
Алемасова - Лекции по аналитической химии
.pdfион оказывает значительно более существенное влияние на растворимость, чем ионная сила. При этом растворимость снижается в тысячу раз.
6.2. Произведение растворимости при неполной диссоциации малорастворимого соединения
До этого мы рассматривали малорастворимые сильные электролиты. Но ряд соединений, образованных неорганическими ионами с органическими реагентами, а также ряд сульфидов, галогенидов диссоциируют не
полностью:
MAтв Ù MAр-р Ù М+ + А– Тогда растворимость S = [M+] + [MA]
Константа устойчивости соединения М+ + А– Ù МА
β = |
[MA] |
|
|
[M + ] [A− ] |
|
Отсюда [MA] = β·[M+]·[A–] = β·ПРМА.
Тогда растворимость S = |
ПРMA |
+ β ПРМА |
− |
||
|
[A ] |
|
Если концентрация осадителя [A–] стремиться к бесконечности, то растворимость стремится к величине β·ПРМА. Т.е. растворимость не полностью диссоциированного соединения МА не может быть меньше, чем произведение β·ПРМА. К этой величине, как к нижнему пределу, стремится растворимость при увеличении концентрации одноименного иона в растворе.
Например, оксихинолинат железа(ІІІ) FeL3 (ПР = 3·10-44, β = 8·1036). B любых насыщенных растворах растворимость оксихинолината железа
S≥2,5 10-7моль/л.
6.3.Факторы, влияющие на полноту осаждения
Вприроде нет абсолютно нерастворимых веществ. Поэтому осаждение не может быть совершенно полным. Необходимо было ввести какой-то единый критерий полноты осаждения. Договорились условием практиче-
ски полного осаждения считать концентрацию осаждаемых ионов в растворе над осадком 1·10-6моль/л.
Рассмотрим факторы, влияющие на полноту осаждения.
1. Растворимость осаждаемого соединения
При прочих равных условиях всякое отделение будет тем более полным, чем менее растворимо то соединение, в виде которого осаждается данный ион.
2. Количество осадителя
81
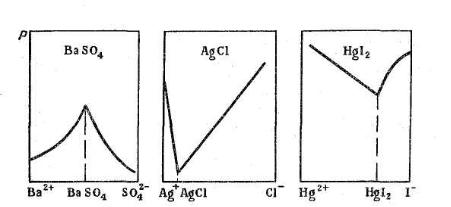
Добавление избытка осадителя повышает полноту осаждения (действие одноименного иона). Для достижения полного осаждения определяемых ионов к исследуемому раствору прибавляют избыток осадителя. Однако при очень большом избытке осадителя может наступить обратное явление вследствие солевого эффекта или протекания реакций комплексооб-
разования ионов осадка с ионами осадителя. Например: Bi3+ + 3I– Ù BiI3↓
BiI3↓ + I– Ù [BiI4]–
HgI2↓ + 2I– Ù [HgI4]2–
AgCl↓ + HCl Ù HAgCl2
Таким образом, избыток осадителя не всегда способствует более полному осаждению. В ряде случаев растворимость осадка увеличивается, как это показано на рис. 6.1.
Рис. 6.1. Зависимость растворимости осадков от избытка осадителя В аналитической практике обычно используют избыток осадителя
50% от его эквивалентного количества, т.е. полуторакратный избыток осадителя.
3. Степень ионизации электролита-осадителя
Например, осаждение Mg2+ происходит более полно, если в качестве осадителя используют раствор NaOH, а не NH3·H2O. Концентрация OH– – ионов в первом растворе в 100 раз больше, чем во втором (степень диссоциации гидроксида натрия 100%, а гидроксида аммония – около 1%).
4. Влияние рН
Практически полное осаждение сульфидов происходит при определенном значении рН. Причем для сульфидов катионов IV группы по сероводородной классификации – это рН=0,5, а для сульфидов катионов ІІІ
группы – 9,25, что обусловлено их растворимостью. Выведем условие практически полного осаждения сульфидов катионов двухвалентных ме-
таллов.
Me2+ + S2– Ù MeS↓
Осадок выпадает, когда [Me2+]·[S2–] ≥ ПРMeS
Как осадитель используют сероводородную кислоту. В растворе она диссоциирует ступенчато:
82

H2S Ù H+ + HS–
HS– Ù H+ + S2–
Kобщ = К1·К2 = |
[H + ]2 [S 2− ] |
|
[H 2 S] |
||
|
Отсюда концентрацию ионов водорода можно выразить
[H + ] = |
Kобщ[H 2 S] |
|
[S 2− ] |
[S 2− ] = ПРMeS
[Me2+ ]
[H + ] = |
K |
общ |
[H |
2 |
S] [Me2+ ] |
|
|
|
|||
|
|
|
ПРMeS |
||
Концентрация сероводорода в насыщенном растворе 0,1 моль/л, тогда [H2S] ≈ 0,1моль/л; [Me2+] = 10-6моль/л (условие практически полного осаждения). Подставив числовые значения, получаем:
+ |
] = |
1,2 |
10− 20 0,1 10−6 |
[H |
|
|
ПРMeS
pH = 13,5 + 1/2·lgПРMeS
6.4.Растворение осадков
Входе анализа необходимо не только получить осадок, осадив определяемый компонент в виде малорастворимого соединения, но и вновь растворить его. Для растворения осадков необходимо, чтобы произведение концентраций ПК осадка стало меньше произведения растворимости (ПК< ПР). Достигнуть этого можно следующим образом.
1. Сильно разбавить раствор
Разбавляют до тех пор, пока концентрация осадка не станет равной его растворимости.
2. Связывание ионов осадка в слабо ионизирующее соединение, хорошо растворимое в воде. Например, гидроксид магния легко растворяется в кислотах вследствие связывания гидроксильных ионов с ионами водорода в
очень слабо диссоциирующее соединение – воду. Mg(OH)2↓ + 2H+ Ù Mg2+ + 2H2O
Но ведь OH–-ионы можно также связывать путем введения в раствор ионов аммония, причем образуется сравнительно мало диссоциированное
соединение – гидроксид аммония:
Mg(OH)2↓ + 2NH4+ Ù Mg2+ + 2NH4OH
Т.е. гидроксид магния растворяется в солях аммония. Однако NH4OH ионизирован гораздо сильнее, чем вода. Поэтому не происходит такого сильного понижения концентрации гидроксильных ионов в растворе, как
83
при добавлении кислоты. Следовательно, растворяющее действие солей аммония значительно слабее действия кислот. В солях аммония растворяются только некоторые, наиболее растворимые основания (Mg(OH)2, Mn(OH)2). Наоборот, Fe(OH)3, Cr(OH)3, Al(OH)3 не растворяются в солях аммония и в уксусной кислоте, а растворяются в сильных минеральных кислотах. Т.е. чем меньше константа диссоциации образующегося электролита, тем легче протекает растворение осадка.
Малорастворимые кислые соли растворяются и в кислотах, и в щелочах. Например, ион калия обнаруживают в растворах реакцией с гидротартратом натрия. Происходит реакция и выпадает белый кристаллический
осадок:
K+ + HC4H4O6– Ù KHC4H4O6↓
Осадок выпадает только в нейтральной или слабощелочной среде (рН 4 –7) при достаточно большой концентрации K+ в растворе. И в щелочной, и в кислой среде осадок растворяется:
KHC4H4O6↓ + H+ Ù H2C4H4O6 + K+
KHC4H4O6↓ + OH– Ù K+ + C4H4O62– + H2O (в уксусной кислоте не растворяется).
Малорастворимые соли слабых кислот растворяются в кислотах вследствие связывания аниона соли с Н+-ионами в недиссоциированные
молекулы слабой кислоты:
ZnS↓ + H+ Ù Zn2+ + HS–
HS– + H+ Ù H2S
3. Протекание реакций комплексообразования
Например:
AgCl↓ + 2NH3 Ù [Ag(NH3)2]Cl
В то же время аммиак не растворяет менее растворимые галогениды серебра AgBr и AgI.
Свежеосажденный фторид кальция не растворим в кислотах, но растворим в солях алюминия вследствие образования прочных фторидных
комплексов:
CaF2↓ + Al3+ Ù [AlF2]+ + Ca2+
Фторид кальция растворим также в ЭДТА вследствие образования
комплексоната кальция:
CaF2↓ + H2Y2– Ù [CaY]2– + 2H+ + 2F–
4. Протекание реакций окисления-восстановления
Сульфиды IV группы не растворяются в соляной кислоте, но растворяются в кислоте-окислителе – азотной кислоте:
3CuS↓ + 8HNO3 Ù 3Cu(NO3)2 + 3S + 2NO +4H2O
5. Комбинированное растворение
Когда осадок не растворяется ни в одном из приведенных случаев, применяют комбинированное растворение, в котором сочетают несколько
84

факторов, способствующих растворению – окисление-восстановление, образование малодиссоциирующих соединений и др.
Например, HgS не растворим в кислотах, но хорошо растворяется в смеси KI + HCl;
HgS↓ + 4KI + 2HCl Ù K2[HgI4] + H2S + 2KCl
6. Превращение одних малорастворимых соединений в другие
При осаждении сульфатов катионов III аналитической группы возникают трудности с растворением осадка, т.к. сульфат бария не растворим в кислотах. Для решения этой проблемы сульфаты бария, стронция и кальция вначале переводят в карбонаты обработкой насыщенным раствором
карбоната натрия:
BaSO4↓ + CO32– Ù BaCO3↓ + SO42–
Карбонаты легко растворяются в кислотах. Константа равновесия этой реакции
= [SO2− ]
K [CO42− ]
3
Домножим и разделим это выражение на одну и ту же величину – равновесную концентрацию ионов бария
K = |
[SO2− ] [Ba2+ ] |
= |
ПРBaSO |
= 0,02 |
||
4 |
|
4 |
||||
[CO2− ] [Ba2+ ] |
ПР |
BaCO3 |
||||
|
|
|
||||
|
3 |
|
|
|
||
Из значения константы равновесия следует, что обработку карбонатом натрия следует проводить несколько раз при кипячении, удаляя каждый раз надосадочную жидкость. Это позволит сдвинуть равновесие реакции вправо.
1.Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В 2-х книгах. – М.: Химия, 1990.
–Кн. 1.– С. 158-188.
2.Пономарев В.Д. Аналитическая химия. В 2- х частях. – М.: Высшая школа, 1982. – Ч. 1. –
С. 109-124.
3.Харитонов Ю.Я. Аналитическая химия. Аналитика. В 2-х книгах. – М.: Высшая школа, 2001. – Кн. 1. – С. 84-101.
4.Основы аналитической химии. В 2-х книгах
/Под ред. Ю.А.Золотова. – М.: Высш.шк., 2004. – Кн. 1. – С. 188-204.
5.Васильев В.П. Аналитическая химия. В 2-х книгах. – М.: Дрофа, 2002. –
Кн. 1. – С. 252-274.
6.Алексеев В.Н. Курс качественного химического полумикроанализа. –
М.:Химия, 1973. – С. 148-184.
85
Раздел 7
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ В АНАЛИЗЕ. МАСКИРОВАНИЕ И ДЕМАСКИРОВАНИЕ
7.1. Диссоциация и устойчивость комплексов в растворах. Функции образования и закомплексованности
Существует множество определений комплексных соединений. Комплексные соединения – это соединения, состоящие из иона металла, обладающего вакантными орбиталями, и частиц с неподелёнными парами электронов.
Основными признаками комплексного соединения является:
–наличие координационной связи;
–сохранение структуры в растворе;
–частичная диссоциация.
Примеры комплексных соединений, уже упоминавшихся нами в раз-
деле 2: [Cu(NH3)4]SO4, [Ag(NH3)2]Cl2, Na3[Co(NO2)6], Na[Fe(SCN)4] и др.
Образование комплекса в общем виде можно представить уравнением: Mn+ + :L Ù [M:L]n+
где Mn+ – центральный ион металла, он называется комплексообразователь; L – лиганд.
Центральный ион может взаимодействовать с несколькими лигандами, образуя ковалентные связи. Более точно уравнение образования ком-
плексного соединения следовало бы записать так: [M(H2O)m]n+ + L Ù [M(H2O)m-1L]n+ + H2O,
т.е. лиганд замещает одну или несколько молекул воды (растворителя), окружающие катион металла.
Можно представить дальнейшее протекание реакции
[M(H2O)m-1L]n+ + L Ù [M(H2O)m-2L2]n+ и т.д.
Центральный атом с окружающими его лигандами образуют внутреннюю сферу комплекса MLn. Помимо лигандов в состав комплекса могут входить другие частицы Х, непосредственно не связанные с центральным атомом. Частицы Х образуют внешнюю сферу комплекса. Центральный атом координирует лиганды, геометрически правильно располагая их в пространстве. Поэтому комплексные соединения часто называют координационными.
Основной характеристикой центрального атома является координационное число (КЧ). Координационное число – число лигандов, содержащих один донорный атом, во внутренней сфере комплекса.
Координационное число определяет конфигурацию комплекса:
86

КЧ |
Конфигурация комплекса |
2 |
линейная |
3 |
равносторонний треугольник |
4 |
плоский квадрат или тетраэдр |
6 |
равносторонний пятиугольник, октаэдр или плоский шести- |
|
угольник |
7 |
семиугольник |
8 |
куб или равносторонний восьмиугольник |
Например, при лечении ревматизма применяют лекарственный препарат золота(І) хризолан Na3[Au(S2O3)2]. Это координационное соединение типа ML2 с линейной конфигурацией аниона L–M–L. Комплексы с координационным числом 6 характерны для ионов Fe2+, Fe3+, Co2+, необходимых для жизнедеятельности и распространены в живой природе.
Основной характеристикой лигандов является дентатность. Дентатность – способность лиганда к образованию координационной связи, или количество связей, которые лиганд способен образовать с центральным атомом.
Различают лиганды:
–монодентатные (образуют одну связь): NH3, CO, Cl–, CN–, H2O, OH–, F– и др.;
–полидентатные (способны к образованию двух связей и более):
C2O42–, SO42–, CO32–.
|
|
O O |
O |
||||||||
-O |
|
|
|
|
|
|
|
|
|
O- |
-O C O- |
C |
|
C |
|
||||||||
|
|
|
|||||||||
Полидентатные лиганды при реакции с ионом металла обычно образуют координационные соединения, содержащие цикл – замкнутую группировку атомов. Нередко в молекуле координационного соединения насчитывается два, три и более циклов. Координационные соединения с одним или несколькими циклами стали называть хелатными (от англ. chelate
– клешня) или просто хелатами. В этой терминологии нашла отражение несложная аналогия полидентатного лиганда с клешней краба, прочно захватывающей ион металла при образовании координационного соединения. Биоорганические молекулы могут иметь большое число донорных атомов. Такие молекулы являются полидентатными лигандами. К ним относятся в первую очередь белки (в частности, ферментные) и нуклеиновые кислоты. Первостепенную роль в жизнедеятельности растений и животных играют бионеорганические соединения с макроциклическими лигандами. В таких лигандах донорные атомы связаны в единое кольцо – цикл. Наиболее распространены в живой природе тетрадентатные макроциклы – порфирины и близкие им по структуре корриноиды. Схематически тетрадентатный макроцикл может быть представлен в виде
87

R1
N::N
R4 |
R2 |
N::N
R3
где дуги обозначают однотипные углеродные цепи, соединяющие донорные атомы азота в замкнутый цикл; R1, R2, R3, R4 – различные углеводородные радикалы.
Донорные атомы азота расположены по углам квадрата (обозначен пунктиром), т.е. жестко скоординированы в пространстве. Поэтому порфирины и корриноиды образуют прочные координационные соединения с катионами различных элементов и даже щелочно-земельных металлов. Так, в качестве центрального атома может выступать ион магния(ІІ). В результате образуется активный центр хлорофилла – зеленого пигмента растений. Если используются ионы Fe2+, образуются активные центры гемо-
глобина:
R1 R1
N |
N |
|
N |
N |
R4 Mg2+ |
R2 |
R4 |
Fe2+ |
R2 |
N |
N |
|
N |
N |
R3 |
|
|
R3 |
|
Активный центр |
Активный центр ге- |
|||
хлорофилла |
|
моглобина |
||
Порфириновые комплексы железа и кобальта входят в состав важ-
нейших бионеорганических соединений гемоглобина, каталазы, цитохромов, витамина В12. Последний, например, обеспечивает кроветворение. Дефицит этих веществ в организме человека и животных приводит к серьезным заболеваниям. Все эти комплексы имеют тетраэдрическую структуру.
Различают кинетическую и термодинамическую устойчивость комплексов.
1. Кинетическая устойчивость определяется скоростью обмена лигандов во внутренней сфере комплекса. В зависимости от скорости обмена комплексы делят на инертные и лабильные.
Лабильные комплексы – если обмен лигандов происходит за время
меньше 1 минуты в 0,1 М растворе при 25ºС. Примером лабильных ком-
плексов являются [Cu(NH3)4]2+, [Fe(H2O)6]3+, [Cu(H2O)6]2+.
Инертные комплексы – обмен лигандов происходит при меньшей скорости. Примером инертных комплексов являются [Co(NH3)6]2+, [Fe(CN)6]3-, [Cr(H2O)6]3+, гетерополикислоты, комплексы с платиновыми металлами.
88

2. Термодинамическая устойчивость определяется энергией связи иона-комплексообразователя с лигандом и выражается константой равновесия реакции комплексообразования (константа устойчивости β).
По значению константы устойчивости с помощью уравнения изотермы реакции нетрудно рассчитать стандартную энергию Гиббса образования комплекса:
∆G° = – RT ln β
Эта величина является энергетической характеристикой реакции образования комплексных соединений. Образование устойчивых комплексов связано со значительным (по абсолютной величине) изменением свободной энергии. Для малопрочных комплексов это изменение невелико. Т.е. константа устойчивости – это наиболее объективная количественная характеристика устойчивости комплекса или, по-сути, энергии химической связи между частицами, образующими комплекс.
Различают общую βn и ступенчатую Kn константы устойчивости.
Запишем в общем виде процесс комплексообразования (опустим для простоты заряды, молекулы растворителя и примем, что µ → 0). При рассмотрении процессов в растворах комплексных соединений используется концепция ступенчатого комплексообразования, т.е. процесс образования и диссоциации комплексного соединения протекает ступенчато:
1 ступень M + L Ù ML
K1 = [M[ML] []L] −ступенчатая константа устойчивости
β1 = [M[ML] []L] −общаяконстанта устойчивости
|
|
|
|
[ML2 ] |
2 ступень ML + L Ù ML2 |
||
K2 |
= |
|
|
−ступенчатаяконстанта устойчивости |
|||
[ML] [L] |
|||||||
|
|
|
|
||||
β2 = |
|
|
|
[ML2 ] |
−общая константа устойчивости и т.д. |
||
[M ] [L]2 |
|||||||
|
|
|
|||||
Видно, что β2 = К1·К2 или в общем случае βn = K1·K2·….·Kn . Иногда равновесие характеризуют константой нестойкости, т.е. кон-
стантой диссоциации комплексного соединения:
βнест = 1/βуст
Как и любое другое равновесие в зависимости от условий комплексообразования может быть описано термодинамической константой равновесия, которая выражена через активности и приводится в справочнике, концентрационной константой, которая выражается через равновесные концентрации, и условной константой. Чаще в аналитической химии пользуются концентрационными константами. При этом следует помнить, что концентрационные константы зависят от ионной силы раствора. В растворах с постоянной ионной силой концентрационные константы устойчиво-
89

сти сохраняют постоянство, что позволяет рассчитывать в растворах непосредственно равновесные концентрации.
Для нахождения констант устойчивости обычно используют специальные функции, легко вычисляемые из опытных данных и связанные простыми математическими зависимостями с константами устойчивости.
Функция образования (функция Бьеррума или среднее лигандное число):
n = CL −[L] , CM
где СL и СМ – общие концентрации лиганда и иона металлакомплексообразователя; [L] – равновесная концентрация лиганда. По физическому смыслу функция образования является своеобразным средним координационным числом и может изменяться от нуля, когда в растворе нет комплексообразования, до предельного максимального значения координационного числа.
Связь функции образования с константами устойчивости. Концен-
трация лиганда, связанного в комплексы ML, ML2,…..MLn, будет равна СL – [L] = [ML] + 2[ML2] + ……+ n[MLn] = β1[M]·[L] + 2β2[M]·[L]2 + ……+
nβn[M]·[L]n
Общую концентрация металла можно выразить из условия материального баланса:
CM = [M] + [ML] + [ML2] +…..+ [MLn] = [M] + β1[M]·[L] + β2[M]·[L]2 +……+ βn[M]·[L]n
Отсюда
n = |
|
β |
[L] + 2β |
2 |
[L]2 |
+...... + nβ |
n |
[L]n |
||
|
|
1 |
|
|
|
|
||||
1 |
+ β1[L] + β2 [L]2 +..... + βn [L]n |
|||||||||
|
||||||||||
Существует несколько методов расчета констант устойчивости по функции образования и другим экспериментальным данным. Наиболее точными являются распространенные в последнее время компьютерные методы расчета, основанные на статистическом принципе максимального правдоподобия.
При решении некоторых вопросов возникает необходимость найти долю данного комплекса MLm, т.е. его относительную концентрацию. Для этого используют функцию закомплексованности:
Ф = СМ
[MLm ]
Значение функции закомплексованности изменяется от 1 до ∞. Однако удобнее использовать обратную величину – мольную долю α:
α = 1 = [MLm ]
Ф CM
Мольная доля меняется от 0 до 1. Для расчета мольных долей используют условие материального баланса.
90
