
Алемасова - Лекции по аналитической химии
.pdf–COOH |
карбоксильная |
|
|
–OH |
гидроксильная |
–SO3H |
сульфогруппа (или сульфоновая) |
–NH2 |
первичная аминогруппа |
=NH |
вторичная аминогруппа |
|
|
–SH |
гидросульфидная |
–AsO3H2 |
арсоновая |
=NOH |
оксимная |
–PO3H2 |
фосфоновая |
Все эти группировки содержат ионы водорода, которые при взаимодействии замещаются катионами металлов.
2. Примеры комплексообразующих группировок:
=CO |
карбонильная |
|
|
–OH |
гидроксильная спиртовая |
=S |
тиоэфирная |
–NH2 |
первичная аминогруппа |
=NH |
вторичная аминогруппа |
≡N |
третичная аминогруппа |
–CN |
цианидная |
=NOH |
оксимная |
–SCN |
роданидная |
––N=N– |
диазогруппа |
Все комплексообразующие группировки содержат в своем составе атомы, имеющие неподеленные пары электронов. Именно поэтому комплексообразующие группировки взаимодействуют с ионами металлов с образованием донорно-акцепторной связи.
Молекулы органического реагента чаще всего имеют и ту, и другую группировки и именно благодаря этому являются полидентатными лигандами. Металл-комплексообразователь связан с органическим лигандом двумя и более связями.
Накопленный экспериментальный материал позволил провести классификацию большого числа атомных группировок, которые способны давать селективные реакции с определенными ионами. Атомные группировки, способные давать селективные реакции на катионы металлов, представлены в табл. 8.1.
101

Таблица 8.1. Характерные комплексообразующие группировки аналитических реагентов
Ион металла |
Аналитическая функциональная группировка |
|||||||||||||||||||||||||||||||||||||||||||||||
Ag(I) |
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
NH |
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
Bi(III) |
|
|
|
|
|
HN |
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
|
|
|
C |
|
|
NH |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
S |
(А = S, NH) |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
Cd(II) |
–N=N–NH– |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
Co(III) |
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
NOH |
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
Cu(II) |
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
OH |
NOH |
|
||||||||||||||||||||||||||||||||||||||
Fe(II) |
|
|
|
|
C |
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NOH |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Fe(III) |
|
|
|
|
C |
|
CH2 |
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
Ni(II) |
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
(N) |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RN |
|
|
|
|
NOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
Sb(III) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
Ti(IV) |
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
OH |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
OH |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
Ru(III) |
S |
|
|
|
C |
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Zr(IV) |
–N=N–, –AsO3H2 |
|
||||||||||||||||||||||||||||||||||||||||||||||
Рассмотрим отдельные аналитические реагенты.
1. α-Нитрозо-β-нафтол
Реактив используют для открытия и гравиметрического определения кобальта. При взаимодействии с солями кобальта(ІІ) образуется интенсив- но-красный осадок хелата трехвалентного кобальта СоL3.
В молекуле α-нитрозо-β-нафтола солеобразующая группировка –ОН (отмечена буквой C), комплексообразующая группировка –NO (отмечена буквой К). Реакцию комплексоообразования схематично можно записать следующим образом:
102

|
K |
|
|
NO |
C |
N O |
Co/3 |
|
|
||
Co2+ + |
OH O2 |
|
O |
|
|
+ H+ |
Этот реагент с ионами Со(ІІІ) образует хелатные комплексы состава CoL3. При взаимодействии реагента с ионами Со(ІІ) он вначале окисляет Со(II) до Со(III), и потому в комплексе кобальта(III) с α-нитрозо-β- нафтолом содержатся примеси продуктов от восстановления реагента.
2. Диметилглиоксим (реактив Чугаева)
Это лучший реактив для обнаружения, отделения и количественного определения никеля(П). В аммиачной среде диметилглиоксим, который можно условно записать как H2Dm, образует с ионами Ni2+ розово-красный
осадок кислой соли – диметилглиоксимата никеля: [Ni(NH3)6]2+ + 2H2Dm Ù Ni(HDm)2 ↓ + 2NH4+ + 4NH3
Реактив образует также малорастворимое соединение с ионами палладия(П) и растворимый комплекс с ионами железа(II).
В молекуле диметилглиоксима две одинаковые функциональные группы =NOH (оксимные). Одна из них – солеобразующая (отмечена буквой С), а другая – комплексообразующая (отмечена буквой К).
H3C |
C |
|
N |
OH |
C |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|||||||
H3C |
C |
|
N |
OH |
K |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
H3C |
C |
N |
OH |
NH |
|
|||||
[Ni(NH3)4]2+ |
+ 2 |
|
|
|
|
|
|
3 |
|
||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
H3C |
C |
N |
OH |
|
|
|
|
|||
|
|
|
O |
OH |
|
|
|
|
|
|
|
|
|||
H C |
C |
|
|
N |
|
C |
CH3 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||||||
|
N |
|
|
|
|
|
|
|
|||||||
3 |
|
|
|
|
Ni |
|
|
|
+ 2NH |
|
+ + 4NH |
||||
|
|
|
|
|
|
|
|
|
|||||||
H C |
C |
|
N |
N |
|
C |
CH3 |
4 |
|
3 |
|||||
|
|
|
|
|
|
|
|
||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O H O
По данным рентгеноструктурного анализа структура диметилглиоксимата никеля плоская. Атом водорода гидроксильной группы одной молекулы образует водородную связь с оксимной группой другой молекулы реагента, уменьшая гидрофильный характер молекулы хелата никеля(II).
103
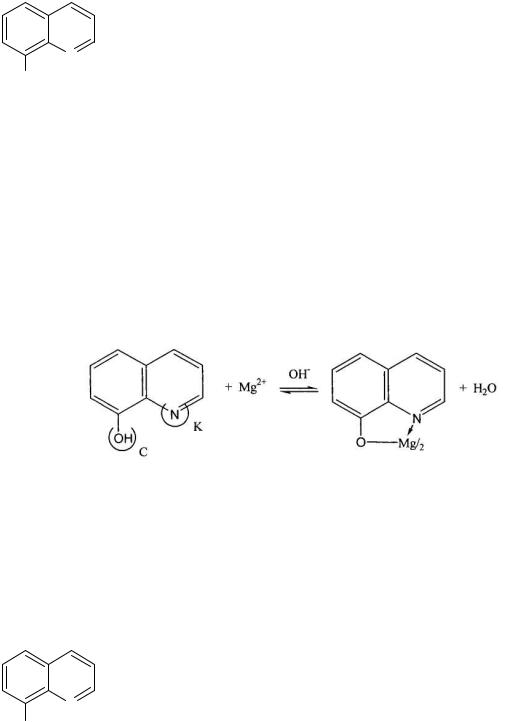
3. 8-Оксихинолин
N
OH
Этот органический реагент взаимодействует примерно с 40 катионами металлов, которые образуют малорастворимые гидроксиды или растворимые аминокомплексы. рН взаимодействия реагента с ионами некоторых
металлов составляет соответственно: Al3+ – 5; Cu2+ – от 5 до 14; Fe3+ – от 3
до 11; Ca2+ – 9; Mg2+ – 9; Ni2+ – 5.
В молекуле реагента солеобразующая группировка –ОН (отмечена буквой C), комплексообразующая группировка ≡N (отмечена буквой К). 8- Оксихинолин взаимодействует с катионами большинства металлов с образованием малорастворимых соединений – оксихинолинатов. Например, реакцию образования 8-оксихинолината магния можно схематически представить следующим образом:
Изменяя рН раствора, с использованием 8-оксихинолина можно осадить ионы одних металлов в присутствии других. С применением этого реактива металлы определяют гравиметрическим, титриметрическим и фотометрическим методами.
4. 8-Меркаптохинолин
N
SH
Реагент взаимодействует с катионами металлов, которые образуют
малорастворимые сульфиды или растворимые аминокомплексы: Hg2+, Cu2+, Fe3+, Ni2+, Co2+, Mn2+, Bi3+, Pb2+, Sb(III), Zn2+ и др. Этот реагент взаи-
модействует также с катионами рения, золота, серебра, платины, осмия, молибдена и др.
Солеобразующая группа – SН, комплексообразующая ≡N.
104

Реакцию взаимодействия 8-меркаптохинолина с катионами висмута(Ш) условно можно записать следующим образом:
+
8.3. Правило циклов
Чтобы вступить в реакцию комплексообразования с катионом металла, органический лиганд должен иметь функциональные аналитические группировки, расположенные определенным образом. При этом образуются комплексные соединения, имеющие в своей структуре циклы.
Правило циклов:
устойчивые комплексные соединения катионы металлов с органическими лигандами образуют тогда, когда в молекуле находятся 5-ти или 6- тичленные циклы, включая катион металла. Чем больше таких циклов в молекуле, тем более устойчиво соединение.
Отмеченное Л.А. Чугаевым увеличение прочности комплексных соединений, образовавших пяти- и шестичленные циклы, получило дальнейшее развитие в концепции хелатного эффекта, которая отражает увеличение устойчивости циклического соединения (в данном случае хелата) по сравнению с аналогичным комплексом с монодентатным лигандом. Понятие “хелатный эффект” введено Шварценбахом, который предложил в качестве характеристики эффекта увеличение константы устойчивости хелатного комплекса по сравнению с нециклическим соединением с таким же числом монодентатных лигандов такой же природы, что и донорные атомы хеланта (реагента). Так, например, хелатный эффект (βChel) в случае простейшего этилендиаминового комплекса (en) представляет собой разность:
lg βChel = lg βMen2+ −lg βM ( NH3 )22+ ,
что, в сущности характеризует реакцию M(NH3)22+ + en = Men2+ + 2NH3. В табл. 8.2 приведены термодинамические характеристики этой реак-
ции (изменение энтальпии ∆H и энтропии ∆S).
Таблица 8.2. Термодинамические характеристики хелатного эффекта реакции M(NH3)22+ + en = Men2+ + 2NH3
M2+ |
lg βChel |
–∆HChel, кДж/моль |
∆SChel, кДж/моль |
Ni2+ |
2,49 |
5,9 |
27,8 |
Cu2+ |
3,07 |
11,4 |
20,5 |
105

Как видно, при протекании реакции M(NH3)22+ + en = Men2+ + 2NH3 наблюдается довольно большое увеличение энтропии, связанное, очевидно, с увеличением числа частиц в растворе, т.е. с ростом беспорядка. Именно это обстоятельство было привлечено в первую очередь для объяснения природы хелатного эффекта. Впоследствии было установлено, что имеет значение и энтальпия хелатного эффекта и ряд других факторов, в частности, размер и число циклов.
Рассмотрим правило циклов на примере определения Fe3+ c салициловой кислотой. Функциональные группы в молекуле салициловой кислоты могут быть расположены в орто-, мета- и параположении:
Салициловая кислота реагирует с катионами Fe3+ только если заместители расположены в орто-положении. При этом образуется шестичленный цикл. В случае пара-салициловой кислоты образуется восьмичленный цикл и реакция не идет.
Исключение из правила циклов:
исключением являются дитиокарбаматы и дитиофосфаты общей формулы
R1 |
S |
R1 |
S |
N |
C |
|
P |
R2 |
S- |
R2 |
S- |
106

Эти реагенты образуют очень устойчивые комплексы с d-элементами
Ag(I), Hg(II), Cd(II), Zn(II), Bi(III), Cu(II), Co(II), Pd(II) и др., содержащие четырехчленные циклы.
Например, при образовании диэтилдитиокарбамата свинца(II) молекула хелата содержит четырехчленные циклы:
Остановимся на растворимости хелатов. Имея большую гидрофобную часть, практически все рассмотренные нами хелаты мало растворимы в воде, но хорошо растворимы в органических растворителях. Экстракционное извлечение хелатов используют для отделения и концентрирования элементов. Например, экстракция комплексов тяжелых металлов с дитизоном в органический растворитель может служить тестом на сумму тяжелых металлов в воде.
Для молекулы дитизона характерна кето-енольная таутомерия:
кето-форма |
енольная форма |
Енольная (точнее, тиольная) форма представляет собой слабую двухосновную кислоту, способную отщеплять ионы водорода, в первую очередь – от группы SH, и образовывать комплексы с ионами металловкоплексообразователей. Наличие щелочи способствует смещению равновесия вправо.
Впервые дитизон был предложен в качестве реагента на катионы цинка(2+), с которыми он образует комплекс малинового цвета – дитизонат цинка Zn(HDz)2, растворимый в органических растворителях и содержащий пятичленный цикл:
107

Дитизон используется также для определения Cu(II), Ag(I), Au(III), Cd(II), Hg(II), In(III), Tl(I), Pb(II), Bi(III), Co(II), Ni(II), Pd(II), Pt(II) и неко-
торых других ионов.
Однако среди органических аналитических полидентатных лигандов есть и такие, которые образуют растворимые в воде внутрикомплексные соединения. Это аминополикарбоновые и аминополифосфоновые кислоты или комплексоны. Самый известный среди них – это этилендиаминтетрауксусная кислота (ЭДТА):
Динатриевая соль этой кислоты Na2Н2ЭДТА называется трилон Б или комплексон III (гексадентатный лиганд). В индивидуальном кристаллическом состоянии существует в форме дигидрата Na2Н2ЭДТА·2Н2О.
Комплексы, образуемые ионами металлов с комплексонами, называются комплексонаты. Комплексонаты – координационные соединения металлов с анионами комплексонов.
Структурную формулу комплексоната кальция можно записать следующим образом:
В структуре комплекса 3 цикла. Комплексон ІІІ образует устойчивые комплексные соединения с двух-, трех- и четырехзарядными ионами металлов при различном значении рН.
Другой класс органических реагентов, способных связывать ионы и малые молекулы, включая их во внутреннюю полость и удерживая за счет взаимодействия с несколькими гетероатомами, называются макроцикла-
ми.
Это циклические соединения с девятью или более членами кольца (включая все атомы) и с тремя или более связывающими (донорными) атомами – O, N, S, P или другими. Например, дибензо-18-краун-6:
108

O O O
O O O
При образовании комплекса молекула реагента, подобно короне (crown), венчает связываемый катион металла или катион металла входит внутрь цикла. Макроциклические соединения образуют наиболее прочные комплексы с теми катионами, ионный радиус которых наилучшим образом соответствует радиусу полости кольца (по завершении комплексообразования). Химия макроциклических соединений началась с открытия нового антибиотика валиномицина. Валиномицин задерживает обмен калия в живых организмах, вследствие чего болезнетворные микроорганизмы в его присутствии не развиваются.
Структурная формула валиномицина условно может быть записана следующим образом:
Жесткий лиганд этого криптанда (в его макроциклической структуре имеется внутримолекулярная полость – крипта) проявляет “пик селективности”, он способен различать катионы, размеры которых либо меньше, либо больше размера их полости. Валиномицин “складывается”, образуя за счет внутримолекулярных связей почти октаэдрическую координационную сферу, к которой легко подходят ионы калия или рубидия. Его координирующие карбонильные кислородные атомы располагаются при этом в уже готовом для комплексообразования положении; такая конформация валиномицина характерна для комплекса с калием и в твердой фазе, и в растворе. Аналитики использовали валиномицин в качестве электродного вещества и создали на его основе ион-селективный электрод на калий.
Краун-эфиры способствуют транспорту катионов через мембраны в живых организмах, катализируют реакции, увеличивают растворимость солей, даже таких “безнадежных” как сульфат бария, являются экстрагентами. В биологических процессах макроциклы служат защитой от супер-
оксидных радикалов OH˙, HO2˙, представляющих опасность для живых организмов. Некоторые макроциклы непосредственно взаимодействуют с
109

ферментами. Структуру макроциклов имеют циклодекстрины (природные вещества олигосахариды). Они обладают каталитической активностью. Реагирующая молекула входит в полость циклодекстринов по типу “хозяин – гость”. Для циклодекстринов наиболее характерна способность связывать незаряженные малополярные молекулы: такое комплексообразование очень напоминает специфическое связывание в фермент-субстратном комплексе, поэтому циклодекстрины широко используются для моделирования биохимических реакций.
Краун-эфиры, как и ЭДТА, используются в хелатотерапии. Хелатирующий агент должен достаточно прочно связывать металл и быть очень селективным, т.е. не выводить из организма цинк, кальций и другие биометаллы. Разумеется, сам макроцикл должен быть нетоксичным. Например, радиоактивный изотоп Sr-85 может быть удален из организма с помощью краун-эфиров. Макроциклические соединения способны доставить целенаправленно в определенное место организма молекулу лекарственного вещества за счет нетоксичного молекулярного капсулирования. Введение внутрь животным комплекса сульфомонометаксина в смеси с краунэфиром в несколько раз увеличивает уровень свободного сульфаниламида в крови. Это объясняется тем, что облегчается его транспорт через стенки желудочно-кишечного тракта.
Существуют и анионоактивные макроциклы. Их используют в специфическом растворении камнеобразований в различных органах (карбонатные, оксалатные, фосфатные, цистеиновые и др. камни).
Макроциклы используют для обезвреживания сточных вод (выделяют металлы и токсичные примеси). Они способны улавливать токсичные вещества (метилртуть, бензол, фенол) из газовой и паровой фаз. Макроциклические соединения при обработке кислых высокоактивных ядерных отходов экстрагируют 99,9% цезия и стронция.
1.Пономарев В.Д. Аналитическая химия. В 2- х частях. – М.: Высшая школа, 1982. – Ч. 1. –
С. 76-85.
2.Харитонов Ю.Я. Аналитическая химия. Аналитика. В 2-х книгах. – М.: Высшая школа, 2001. – Кн. 1. – С. 179-224.
3.Основы аналитической химии. В 2-х книгах/ Под ред. Ю.А.Золотова. М.: Высш.шк., 2004. –
Кн. 1. – С. 160-174.
4.Пилипенко А.Т. Органічні реактиви в неорганічному аналізі. – Київ: Вища школа, 1972. –
216с.
110
