
Ushkac_Mehanika
.pdf
2.3. Другий закон термодинаміки. Рідини |
151 |
|
|
нагріванні тіла δQ > 0 і його ентропія збільшується dS > 0, при охолодженні δQ < 0 й ентропія тіла зменшується dS < 0. Ізоентропійним називається процес, який протікає при постійній ентропії (S = const). В оборотному адіабатичному процесі δQ = TdS = 0, так що dS = 0 і S = = const, томуадіабатичнийпроцесєізоентропійним.
Розглянемодляприкладуідеальнийгаз, якийздійснюєрівноважний перехід зі стану 1 у стан 2. Зміна його ентропії
2 2
∆S1→2 = S2 − S1 = ∫ δTQ = ∫ dUT+ δA.
1 1
|
ВикористовуючиdU = m C dT; |
δA = pdV = m RT dV ; |
R = C |
p |
− C |
; |
|||||||||||||||
|
|
|
|
|
|
|
|
µ |
V |
|
|
|
|
|
µ |
V |
|
V |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
T2V1 |
= |
p2 |
, отримуємо: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
T V |
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
1 |
2 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∆S1→2 = mµ CV ∫2 dTT + mµ R ∫2 dVV = |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
T1 |
|
|
V1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T2 |
|
V2 |
|
|
|
p2 |
|
V2 |
|
|
|
|||
|
|
|
|
|
m |
|
|
m |
|
|
|
|
|
|
|||||||
|
|
|
|
= |
|
CV ln |
|
+ R ln |
|
= |
|
CV |
ln |
|
+ C p ln |
|
. |
|
|
|
|
|
|
|
|
µ |
T |
V |
µ |
p |
V |
|
|
|
|||||||||
|
|
|
|
|
|
|
1 |
|
1 |
|
|
|
1 |
|
1 |
|
|
|
|
||
Змінаентропіївпроцесахідеальногогазунаведенанижче:
Ізохорний |
|
Ізобарний |
|
Ізотермічний |
Адіабатичний |
|||||||
(V = const) |
|
(р = const) |
|
(Т = const) |
(S = const) |
|||||||
∆S = |
m |
CV ln |
T2 |
∆S = |
m |
Cp ln |
V2 |
∆S = |
m |
R ln |
V2 |
∆S = 0 |
|
T1 |
|
|
|
V1 |
|||||||
|
|
|
|
V1 |
|
|
|
|||||
Статистичне тлумачення ентропії
Термодинамічна ймовірність W стану тіла чи системи – це число способів, якими може бути реалізований даний конкретний термодинамічнийстан(макростан). Інакшекажучи, цечисловсіхможливихмікророзподілівчастинокзакоординатамиташвидкостями(мікростанів), які відповідають даному термодинамічному стану.
152 |
Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА |
|
|
Формула Больцмана записується у вигляді S = k ln W + const, де k – стала Больцмана.
Ентропія системи є логарифмом числа мікростанів, за допомогою яких може бути реалізовано даний макростан. Ентропія є мірою невпорядкованості системи: чим більше число мікростанів, які реалізують даний макростан, тим більше ентропія.
Усіпроцесивзамкненійсистеміприводятьдозбільшенняїїентропії. Узамкненійсистеміпроцесипротікаютьунапрямкувідменшімовірних станів до більш імовірних до того часу, доки його імовірність не стане максимальною. Устанірівноваги– найбільшімовірногостанусистеми– число мікростанів максимальне, при цьому максимальна й ентропія.
Другий закон термодинаміки
Будь-який необоротний процес у замкненій системі відбувається так, щоентропіясистемиприцьомузбільшується(законзбільшенняентропії).
Перший закон термодинаміки є законом збереження та перетворенняенергіївідноснотермодинамічнихпроцесів. Другийзаконтермодинаміки визначає напрямок протікання термодинамічних процесів, вказуючи, якіпроцесивприродіможливі, аякі– ні.
Існують ще два визначення другого закону термодинаміки, еквівалентнихзаконузбільшенняентропії:
за Кельвіном (неможливий круговий процес, єдиним результатом якого є перетворення теплоти, одержаної від нагрівача, на еквівалентну їйроботу);
за Клаузіусом (неможливий круговий процес, єдиним результатом якого є передача теплоти від менш нагрітого тіла до більш нагрітого).
Третій закон термодинаміки
Третій закон термодинаміки – теорема Нернста–Планка – постулює поведінку термодинамічних систем при нулі Кельвіна (абсолютному нулі): ентропія всіх тіл у стані рівноваги спрямована до нуля по мірі наближеннятемпературидонуляКельвіна:
lim S = 0.
T →0
Теплоємності CV та Cp при T = 0 К дорівнюють нулю.
Реальні гази, рідини та тверді тіла
Для опису реальних газів необхідно враховувати власний об'єм молекултасилиміжмолекулярноївзаємодії.
2.3. Другий закон термодинаміки. Рідини |
153 |
|
|
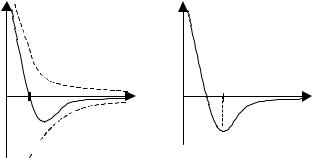
Силиміжмолекулярноївзаємодії– короткодіючі; вонипроявляються навідстані, меншійза10–9 м. Силавзаємодіїмолекул(F) – церівнодійна силпритяганняFП (маютьперевагунавеликихвідстанях) тасилвідштовхування FВ (домінують на малих відстанях). На відстані r = r0 ці сили дорівнюють одна одній таF = 0 (рис. 2.7). Таким чином, відстань r0 – це рівноважна відстань між молекулами, на якій би вони знаходилися за відсутностітепловогоруху.
F |
|
|
U |
|
|
|
F |
FВ |
|
|
|
|
|
|
|
||
0 |
r0 |
|
0 |
r0 |
|
r |
r |
||||
|
|
Umin




 FП
FП
Рис. 2.7
ПотенціальнаенергіявзаємодіїмолекулU мінімальнавстаністійкої рівноваги при r = r0. Співвідношення між Umin і kT є критерієм різних агрегатнихстанів: Umin визначаєроботу, якутребаздійснитипротисилпритягання, щоб роз'єднати молекули, що знаходяться в рівновазі (r = r0); kT визначаєподвоєнусереднюенергію, якаприходитьсянаодинстепінь вільностітепловогорухумолекул.
ЯкщоUmin << kT, речовиназнаходитьсявгазоподібномустані, оскількитепловийрухмолекулперешкоджаєз'єднанню(конденсації) молекул. За умови Umin >> kT речовина знаходиться в твердому стані, тому що теплової енергії недостатньо, щоб "відірвати" молекули одну від іншої. При Umin ≈ kT речовина знаходиться в рідкому стані, оскільки в результаті теплового руху молекули переміщуються в просторі, обмінюються місцями, але не розходяться на відстані, яка перевищує r0.
Рівняння Ван-дер-Ваальса
Внесемо в рівняння стану ідеального газу pV = RT поправки, які враховуютьвласнийоб'єммолекулісилиміжмолекулярноївзаємодії.
Фактичний об'єм реального газу буде V – b, де b – об'єм, який займають самі молекули. Дві молекули радіуса r не можуть зблизитися

154 |
|
|
Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА |
|||||||||
навідстаніменшевід2r, відповіднодляцентрівдвохмолекулнедоступ- |
||||||||||||
ний сферичний об'єм радіуса 2r. Цей об'єм b у вісім разів більше від |
||||||||||||
об'ємуоднієїмолекулиіврозрахункунаоднумолекулудорівнюєчотирьом |
||||||||||||
об'ємам молекули. |
|
|
|
|
|
|
|
|
||||
|
Урахуваннясилміжмолекулярногопритяганняздійснюєтьсявведен- |
|||||||||||
ням допоміжного тиску p' на газ, який називається внутрішнім тиском: |
||||||||||||
p' = a V 2, де а – стала Ван-дер-Ваальса. |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рівняння Ван-дер-Ваальса для моля газу – рівняння стану реальних |
|||||||||||
газів: ( p + a V 2 )(V |
− b) = RT . Для довільної маси газу |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ν2a |
|
|
|
|
||
|
|
|
|
|
p + |
|
2 |
(V − νb) = νRT , |
|
|||
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
де v = m/ ; V = vV . |
|
|
|
|
|
|
|
|
||||
|
Ізотерми реального газу – це залежність молярного об'єму газу від |
|||||||||||
тискуприпостійнійтемпературі(рис. 2.8). |
|
|
|
|||||||||
|
T1 |
T2 T3 |
|
|
|
|
|
Привисокихтемпературах(Т> Ткр) |
||||
p |
|
|
|
|
ізотерма реального газу відрізняється |
|||||||
6 |
|
|
|
|
|
від ізотерми ідеального газу тільки де- |
||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
якимперекрученням форми. |
||||
|
|
|
К |
|
|
|
|
|
При критичній температурі Ткр на |
|||
|
|
Р |
Г |
|
|
|
ізотерміз'являєтьсяточкавигинуК– кри- |
|||||
|
|
3 2 |
|
|
|
|
тичнаточка. Відповідніційточціоб'єм |
|||||
|
|
|
|
|
|
|
||||||
|
|
5 |
|
|
|
|
V |
ітискp |
кр |
називаютьсякритичними. |
||
|
|
|
|
|
|
|
кр |
|
|
називається критич- |
||
|
|
4 |
|
|
Tкр |
|
|
Ізотерма при Ткр |
||||
|
|
Р + П |
П |
|
|
ною ізотермою. |
|
|||||
0 |
|
|
1 |
|
|
|
При Т < Ткр |
рівнянню Ван-дер- |
||||
|
|
|
|
|
V |
|
||||||
|
|
|
|
|
|
|
||||||
|
|
|
Рис. 2.8 |
|
|
|
Ваальса відповідає крива 1–2–3–4–5–6. |
|||||
|
|
|
|
|
|
Однак на ділянці 3–4 стискання речо- |
||||||
|
|
|
|
|
|
|
|
|||||
винисупроводжуєтьсязменшеннямтиску, вційобластіречовинарозпа- |
||||||||||||
дається на дві фази – рідину та пару. Фаза – сукупність усіх частин си- |
||||||||||||
стеми, які мають однаковий хімічний склад і знаходяться в однаковому |
||||||||||||
термодинамічному стані. |
|
|
|
|
|
|
|
|||||
|
Експериментальні докритичні ізотерми реального газу мають ви- |
|||||||||||
гляд1–2–5–6 ієкривиминеперервногопереходуречовинизгазоподібно- |
||||||||||||

2.3. Другий закон термодинаміки. Рідини |
155 |
|
|
го стану (Г) (ділянка 1–2) у рідину (Р) (ділянка 5–6). Ділянка 2–5 відповідаєрівноважномуспівіснуваннюрідинитагазу.
Рідина в газоподібному стані при температурі нижче від критичної називаєтьсяпарою(П), апара, яказнаходитьсяурівновазізісвоєюрідиною, називається насиченою (Р+П). Пара під час ізотермічного стискання може скраплюватися. Газ при температурах Т > Ткр не може бутиперетворенимурідинуніприякомутиску(Г).
Придеякихумовахможутьбутиреалізованіметастабільністани2–3 та 4–5. Ділянка 2–3 відповідає пересиченій парі, а 4–5 відповідно перегрітійрідині.
Внутрішня енергія реального газу
Внутрішня енергія реального газу складається з кінетичної енергії тепловогорухумолекул(СVТ) тапотенціальноїенергіїміжмолекулярної взаємодії (–α/V ):
U = CV T − α . V
Якщо газ розширюється без теплообміну з навколишнім середовищем (адіабатично, тобто δQ = 0) і не здійснює роботу (так зване розширення газу у вакуумі, тобто δA = 0), із першого закону термодинаміки
(δQ = (U2 – U1) + δA) виходить, що U1 = U2.
При адіабатичному розширенні без здійснення зовнішньої роботи внутрішня енергія газу не змінюється.
Для ідеального газу це означає Т1 = Т2 (температура не змінюється).
|
α |
|
1 |
|
|
1 |
|
Для реального газу U = CVT – α/V, тому T1 − T2 = |
|
|
|
||||
C |
|
− V . |
|||||
V |
|
||||||
|
V |
1 |
|
2 |
|
||
Реальнийгазприадіабатичномурозширенніувакууміохолоджується.
Рідини та їх опис
Рідинаєагрегатнимстаномречовини, проміжнимміжгазоподібним і твердим. У газах відсутня закономірність у взаємному розташуванні молекул (хаотичне розташування). У твердих тілах спостерігається далекийпорядок: молекулистворюютькристалічнурешітку. Урідинахдалекий порядок відсутній, а має місце близький порядок у розташуванні молекул: їх упорядковане розташування повторюється на відстанях, які можна порівняти з міжатомними. Тепловий рух молекули рідини – це її
156 |
Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА |
|
|
коливання в околі визначеного положення рівноваги протягом деякого часу, післячогомолекуластрибкомпереходитьуновеположення, віддалене від попереднього на відстань порядку міжатомного.
Радіусr молекулярноїдії– відстань(≈10–9 м), приякійможливознехтувати силами тяжіння між молекулами рідини. Сфера радіусом r називається сферою молекулярної дії.
Сили, які діють на молекулу всередині об'єму рідини зі сторони навколишніх молекул, у середньому скомпенсовані. Для молекули, розташованої на поверхні, рівнодійна сил спрямована всередину рідини. Результативнісиливсіхмолекулповерхневогошаруздійснюютьнарідину молекулярний(внутрішній) тиск.
Поверхневий натяг
Молекули поверхневого шару рідини мають більшу потенціальну енергію, ніж молекули всередині рідини. Ця додаткова енергія, названа поверхневоюенергією, пропорційнаплощиніповерхні: ∆W = σ∆S, деσ – поверхневийнатяг.
Оскількирівноважнийстанхарактеризуєтьсямінімумомпотенціальної енергії, то рідина при відсутності зовнішніх сил буде приймати таку форму, щоб при заданому об'ємі вона мала мінімальну поверхню, тобто форму кулі. Поверхневий шар рідини аналогічний розтягнутій пружній плівці, вякійдіютьсилинатягу.
Припустимо, щопіддієюсилповерхневогонатягуповерхнярідини стягнулася, при цьому сили, діючі на елемент ∆l контуру, здійснюють роботу ∆A = f ∆l∆x, де f – сила поверхневого натягу, яка діє на одиницю довжини контуру поверхні рідини. Оскільки ця робота здійснюється за рахунокзменшенняповерхневоїенергії∆A = ∆W, тоσ = f , тобтоповерхневий натяг σ дорівнює силі поверхневого натягу, що приходиться на одиницюдовжиниконтуру, якийобмежуєповерхню.
Одиниця поверхневого натягу – ньютон на метр (Н/м) або джоуль на квадратний метр (Дж/м2).
Змочування
Змочуваннямназиваєтьсяявищескривленнявільноїповерхнірідини пристиканнірідинизповерхнеютвердоготіла. Поверхнярідини, скривлена на границі з твердим тілом, називається меніском. Лінія, по якій меніск перетинається з твердим тілом, називається периметром змочування.
2.3. Другий закон термодинаміки. Рідини |
157 |
|
|
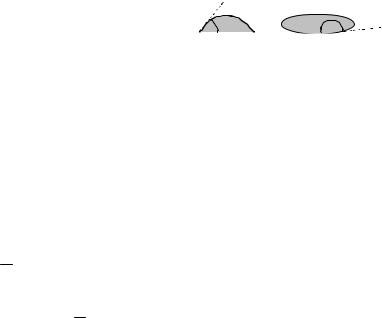
Явище змочування характеризується крайовим кутом θ (рис. 2.9) між поверхнею твердого тіла і меніском y точках їх перетинання (в точ-
ках периметрa змочування). Рідина |
θ |
|
змочуєтвердетіло, якщокрайовийкут |
θ |
|
гострий: 0 ≤ θ < π/2 танезмочує, якщо |
|
|
|
|
|
|
Рис. 2.9 |
|
π/2 < θ < π. |
|
|
|
|
Якщо θ = 0, змочування вважається ідеальним (повним). Випадок θ = π – це ідеальне (повне) незмочування.
Якщосилипритяганняміжмолекуламитвердоготілаірідинибільше, ніжсилипритяганнямолекулрідиниоднадоодної, торідинабудезмочувати поверхню твердого тіла. Якщо молекулярне притягання в рідині перевищуєсилупритяганнямолекулрідинидомолекултвердоготіла, то рідина не змочує поверхню твердого тіла.
Тиск під скривленою поверхнею рідини
Сферичнаопуклаповерхняздійснюєнарідинудодатковийтиск, який викликанийсиламивнутрішньогонатягу, спрямованимивсерединуріди-
ни, ∆p = 2 σR , де R – радіус сфери. Якщо поверхня рідини вгнута, то ре-
зультативна сила поверхневого натягу спрямована з рідини, а тиск усе-
рединірідини ∆p = − 2 σR .
НадлишковийтискусерединімильноїкулькирадіусомR викликаний дієюобохповерхневихпрошарківтонкоїсферичноїмильноїплівки: ∆p =
=4σ/R.
УзагальномувипадкунадлишковийтискдлядовільноїповерхнірідиниописуєтьсяформулоюЛапласа:
|
1 |
|
1 |
|
|
|
|
+ |
|
, |
|||
R |
R |
|||||
∆p = σ |
|
|||||
|
1 |
|
2 |
|
|
де R1 та R2 – радіуси кривизни двох будь-яких взаємно перпендикулярнихперетинівповерхнірідинивданійточці.
Радіускривизнидодатний, якщоцентркривизнивідповідногоперетинузнаходитьсявсерединірідини, івід'ємний, якщоцентркривизнизнаходитьсяпозарідиною.
158 |
|
|
Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА |
|
|
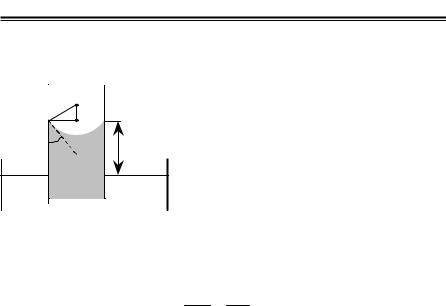
Капілярні явища |
|
||
|
Капіляраминазиваютьсявузькіциліндричнітрубкиздіаметроммен- |
|||
шим за міліметр. Капілярністю називається явище зміни рівня рідини |
||||
|
|
|
|
вкапілярах. |
|
|
R |
|
Рідина в капілярі піднімається та |
|
|
|
опускається на таку висоту h (рис. 2.10), |
|
|
|
r |
|
|
|
θ |
|
при якій тиск стовпа рідини (гідростатич- |
|
|
|
h |
||
|
|
ний тиск) ρgh yрівноважується надлишко- |
||
|
|
|
||
|
|
|
|
|
|
|
|
|
вим тиском ∆p: |
|
|
2σ |
= ρgh. |
|
Рис. 2.10 |
R |
|
|
|
Висотапідйому(глибинаопускання) рідинивкапіляріоберненопропорційнайогорадіусу:
h = ρ2gRσ = ρ2grσ cosθ,
деρ – густинарідини; r іR – радіусикапіляратакривизнименіскавідповідно; g – прискореннявільногопадіння.
Приклади розв'язування задач |
|
|
|
|
159 |
||
Приклади розв'язування задач |
|
|
|||||
Приклад 1. Кисень, маса якого 200 г, нагрівають від температури |
|||||||
27 °С до 127 °С. Знайти зміну ентропії, якщо відомо, що початковий |
|||||||
ікінцевийтискоднаковійблизькідоатмосферного. |
|
|
|||||
|
Аналіз і розв'язок |
|
|
|
|||
i = 5 |
|
Згіднозумовоюзадачікисеньєідеальним |
|||||
газом і стан його описується рівнянням стану |
|||||||
m = 200 г = 0,2 кг |
|||||||
ідеального газу. Характер процесу нагрівання |
|||||||
t1 = 27 °C |
|||||||
невідомий. Алезмінаентропіїсистемиприпе- |
|||||||
t2 = 127 °C |
|||||||
реході з одного стану в другий визначається |
|||||||
T1 = 300 К |
|||||||
T2 = 400 К |
тільки параметрами цих станів і не залежить |
||||||
p1 = p2 = p0 |
відхарактеру процесу. |
|
|
|
|||
R = 8,31 Дж/(моль К) |
|
Знайтизмінуентропіїможна, розглядаючи |
|||||
∆S – ? |
довільнийоборотнийпроцес, урезультатіякого |
||||||
|
систему(вданомувипадкуідеальнийгаз) мож- |
||||||
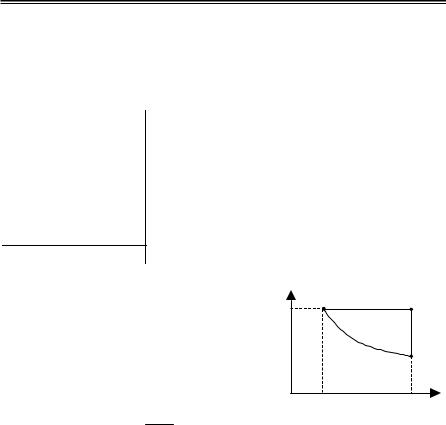
наперевестизістану1 устан2 (рис. 2.11). |
p |
1 |
2 |
|
|||
Нарис. 2.11 показанідваможливіква- |
p0 |
|
|||||
зістатичні процеси: ізобарне розширення |
|
T1 |
T2 |
|
|||
|
|
|
|
||||
1–2 та ізотермічне розширення 1–3 із по- |
|
|
|
|
|||
дальшим ізохорним нагріванням 3–2. |
|
|
T1 3 |
|
|||
Дляпроцесу1–2 |
|
|
|
|
|
|
|
2 |
|
|
0 |
V1 |
V2 |
V |
|
|
|
|
|||||
S2 – S1 = ∫ δQT p , |
(1) |
|
|
Рис. 2.11 |
|
||
1 |
|
|
|
|
|
|
|
де δQp = (m / )CpdT. |
|
|
|
|
|
|
|
Для процесів 1–3–2 |
|
|
|
|
|
|
|
S2 − S1 = |
1 |
∫3 |
δQT + ∫2 |
δQV |
, |
(2) |
T |
T |
|||||
1 |
1 |
|
|
|
||
де δQT = δA = pdV; δQV = (m/ µ)CV dT.
Знайдемозмінуентропії, розглядаючиізобарнийпроцес1–2, приякому

160 |
Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА |
|
|
молярнатеплоємністьCp = const = (i + 2)R/2. ЯкщопідставитивиразδQp під знак інтегралa у формулі (1) і враховуючи, що Cp стала величина, одержимо
|
|
|
m i + 2 |
2 dT m i + 2 |
T |
|
|||||||||||||||
∆S = S2 − S1 = |
|
+ |
|
|
|
|
|
R∫ |
|
|
= |
|
|
|
|
R ln |
2 |
= |
|||
µ |
|
|
2 |
|
T |
µ |
|
|
2 |
T |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
1 |
|
|
0,2(5 + 2) 8,31 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
= |
ln |
400 |
= 52 |
|
|
(Дж/К). |
|
|
|||||||||||||
|
|
|
|
300 |
|
|
|||||||||||||||
|
32 10−3 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Кисень – газ двохатомний (і = 5). |
|
|
|
|
|
||||||||||||||||
Перевіриморозмірністьневідомоїфізичноївеличини: |
|
||||||||||||||||||||
[∆S]= |
[m][R] |
|
= |
кг моль Дж |
|
|
= Дж/К. |
|
|
||||||||||||
|
|
|
|
|
|||||||||||||||||
[µ] |
|
|
|
|
кг моль К |
|
|
|
|
|
|||||||||||
Легко перевірити, що результат не зміниться і при переході 1–3–2. Підставляючи вирази δQT і δQV y (2) та враховуючи, що при ізотер-
мічному процесі p = p1V1/V = mRT1/(µV), одержимо
3
S2 − S1 = mµ R∫ dVV
1
|
m |
2 |
dT m |
|
V |
|
m |
T |
||||
+ |
|
CV ∫ |
|
= |
|
R ln |
3 |
+ |
|
CV ln |
2 |
. |
µ |
T |
µ |
V |
µ |
T |
|||||||
|
|
3 |
|
|
|
|
1 |
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ураховуючи, що T3 = T1; V3 = V2, а також те, що T2/T1 = V2/V1, одержимо
∆S = S |
2 |
− S = |
m |
|
i + 2 |
R ln |
T2 |
. |
|
|
|
||||||
|
1 |
µ 2 |
|
T1 |
||||
|
|
|
|
|||||
Відповідь: ∆S = S2 – S1 = 52 Дж/К.
Приклад 2. На поліровану скляну пластинку помістили 0,01 гводи іпоклализверхудругутакужпластинку. Водарозтiкласяміжнимипоплощі круга радіусом R = 3 см, не дійшовши до країв. З якою силою треба розтягуватиобидвіпластинки, щобїхроз'єднати?
