
Ushkac_Mehanika
.pdf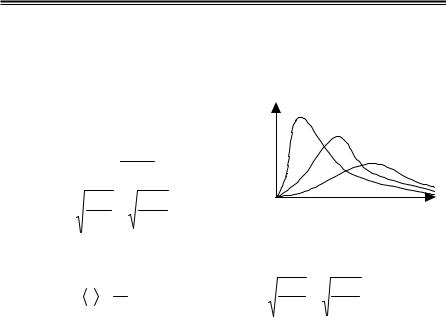
2.1. Молекулярно-кінетична теорія ідеальних газів |
101 |
||||
|
|
|
|
|
∞ |
Функціярозподілузадовольняєумовінормування ∫ f (v)dv =1. |
|||||
|
|
|
|
|
0 |
Швидкість, при якій функція роз- |
|
|
|||
поділумолекулідеальногогазузашвид- |
f(v) |
|
|||
костямимаксимальна, називаєтьсянай- |
T1 |
||||
більшімовірноюvі. |
|
|
T2 |
||
Прирівнявши |
df (v) нулю, отри- |
|
T3 |
||
|
|
|
dv |
|
|
маємо: v = |
2kT |
= |
2RT . |
0 |
v |
i |
m0 |
|
µ |
|
Рис. 2.2 |
|
|
|
|
||
Середньоарифметична швидкість |
|
|
|||
|
1 |
∞ |
∞ |
8kT = |
8RT . |
v = |
∫vdN (v) = ∫vf (v) dv = |
||||
|
N |
0 |
0 |
πm0 |
πµ |
|
|
|
|
||
Барометрична формула
Розподіл Максвелла передбачає, що на молекули газу не діють зовнішнісили. Фактичномолекулигазівперебуваютьводнорідномуполі тяжінняЗемлі. Тепловийрухмолекулприводитьдотакогостаціонарного стану газу, при якому його тиск з висотою зменшується. Рівняння, яке дозволяє визначити зміну тиску повітря з висотою, називають барометричноюформулою. Припускаючи, щоT = const таg = const, барометрична формула має вигляд
− |
µg |
(h−h0 ) |
|
RT |
|||
p = p0 exp |
, |
де p0 – тиск газу на висоті h0.
Використовуючи співвідношення p = nkT; = m0NA; R = kNA, отримуєморозподілБольцмана
− |
m0 g |
(h−h0 ) |
. |
|
|||
n = n exp |
kT |
||
0 |
|
|
|

102 |
Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА |
|
|
Оскільки m0gh = W – потенціальна енергія молекули в полі тяжіння відповідно
n = n |
exp− |
W |
n1 |
= exp− |
W1 −W2 |
|||
kT |
; |
kT |
. |
|||||
|
||||||||
|
0 |
|
|
n2 |
|
|
|
|
|
|
|
|
|
|
|
||
З розподілу Больцмана (розподілу частинок за значенням потенціальної енергії) для зовнішнього потенціального поля виходить, що при постійній температурі густина газу більша там, де менша потенціальна енергія його молекул. Якщо частинки мають однакову масу і знаходятьсявстаніхаотичноготепловогоруху, торозподілБольцманасправедли- вийубудь-якомузовнішньомупотенціальномуполі, анетількивполісил тяжіння.
Внутрішня енергія термодинамічної системи
ВнутрішняенергіяU – цеенергіяхаотичного(теплового) рухумікрочастинок системи (молекул, атомів, електронів, ядер і т. д.) та енергія взаємодії цих частинок. До неї не належать кінетична енергія руху системиякцілогоіпотенціальнаенергіясистемиузовнішніхполях.
Внутрішня енергія – однозначна функція термодинамічного стану системи. Укожномустанісистемамаєцілкомвизначенувнутрішнюенергію. Тому, внутрішня енергія не залежить від того, яким чином система перейшла в даний стан. При переході системи з одного стану в інший змінавнутрішньоїенергіївизначаєтьсятількирізницеюзначеньвнутрішньоїенергіїцихстанівінезалежитьвідшляхупереходу.
Число степенів вільності
Числостепеніввільності– цечислонезалежнихзмінних, якіповністю визначають положення системи в просторі.
Число степенів вільності для ідеального газу жорстких молекул наведено у табл. 3.
Таблиця 3
Число степенів |
|
Газ |
|
вільності |
одноатомний |
двохатомний |
багатоатомний |
Поступальні |
3 |
3 |
3 |
Обертальні |
– |
2 |
3 |
Усього |
3 |
5 |
6 |

2.1. Молекулярно-кінетична теорія ідеальних газів |
103 |
|
|
У реальних молекулах немає жорсткого зв'язку між атомами в молекулі, томунеобхідновраховуватитакожстепенівільностіколивального рухуатомівусерединімолекули.
Незалежновідзагальногочисластепеніввільностімолекулитризних завжди поступальні. На кожний з них приходиться третя частина кіне-
тичноїенергіїпоступальногорухумолекули ε0 :
ε = ε0 |
= 3/ 2kT = 1 kT. |
||
1 |
3 |
3 |
2 |
|
|||
Длясистеми, яказнаходитьсявстанітермодинамічноїрівноваги, на кожнийпоступальнийіобертальнийстепенівільностіприходитьсяусередньомукінетичнаенергія, щодорівнюєkT/2, анакожнийколивальний– енергія, яка дорівнює kT.
Енергіяколивальнихстепеніввільностівдвічібільше, оскількиколивальнасистемамаєрівнізарозміромсереднізначенняяккінетичної, так іпотенціальноїенергій.
Таким чином, середня енергія молекули
ε = 2i kT ,
де і = іпост + іоберт + 2 ікол – сума числа поступальних, числа обертальних іподвоєногочислаколивальнихстепеніввільностімолекули.
У класичній теорії розглядають молекули з жорстким зв'язком між атомами, для них і співпадає із числом степенів вільності молекули.
В ідеальному газі молекули між собою не взаємодіють та їх потенціальнаенергіядорівнюєнулю. Томувнутрішняенергіяодногомоляідеальногогазуідовільноїмасиm газувідповідно
U = ε N A = 2i kTN A = 2i RT; U = mµ 2i RT = ν 2i RT.
Перший закон термодинаміки
Перший закон термодинаміки – закон збереження і перетворення енергіївтермодинамічнихпроцесах.
Змінити внутрішню енергію системи можна двома способами: здійснюючинадсистемоюроботу(наприклад, стискаючигазуциліндрі

104 Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА
за допомогою поршня) або надаючи системі теплоту (наприклад, нагріваючигазугерметичнійпосудині).
Розглянемо замкнену, макроскопічно нерухому систему, яка не знаходиться у зовнішніх силових полях. Виконаємо аналіз з енергетичної точки зору процесу її рівноважного переходу з довільного початкового стану 1 в інший стан 2. Зміна внутрішньої енергії системи ∆U = U2 – U1 утакомупроцесідорівнюєрізниціміжкількістютеплотиQ, якуотримала система, і роботою А, яку здійснила система проти зовнішніх сил:
∆U = Q – A, або Q = ∆U + A.
Перший закон термодинаміки формулюється так: теплота, яка надаєтьсясистемі, витрачаєтьсяназмінуїївнутрішньоїенергіїтаздійснення неюроботипротизовнішніхсил.
Удиференційнійформіелементарнакількістьтеплоти
δQ = dU + δA,
деdU (повнийдиференціал) – нескінченномалазмінавнутрішньоїенергії; δA – елементарна робота (δA і δQ не є повними диференціалами).
Внутрішняенергіясистемиєоднозначноюфункцієюстанусистеми. Звідси випливає, що при здійсненні системою довільного процесу, в результаті якого вона знову повертається в початковий стан, повна зміна внутрішньоїенергіїсистемидорівнюєнулю:
∫ |
|
|
|
|
dU = 0 . |
Ні робота, ні теплота не є функціями стану системи. Усі величини, які входять у перший закон термодинаміки, можуть бути як додатними, так і від'ємними.
Якщо до системи підводиться теплота, то δQ > 0; якщо відводиться, то δQ < 0. Якщо система здійснює роботу над зовнішніми тілами, то δA > 0, якщожзовнішнісилиздійснюютьроботунадсистемою, тоδA < 0.
Інше тлумачення першого закону термодинаміки полягає у наступному: якщо система періодично повертається впочатковийстан івідповідно ∆U = 0, то A = Q, тобто вічний двигун першого роду – періодично діючийдвигун, якийздійснювавбибільшуроботу, ніжнаданайомузовні енергія, – неможливий.

2.1. Молекулярно-кінетична теорія ідеальних газів |
105 |
|
|
Теплоємність
Теплоємністьтіла– фізичнавеличина, якачисельнодорівнюєвідношенню кількості теплоти, яка надана тілу до зміни його температури врозглянутомутермодинамічномупроцесі.
Питоматеплоємністьречовинис– величина, якадорівнюєкількості теплоти, яка необхідна для нагрівання 1 кг речовини на 1 К:
c = mdTδQ .
МолярнатеплоємністьС – величина, якадорівнюєкількостітеплоти, яка необхідна для нагрівання 1 моль речовини на 1 К:
C = νδdTQ .
Зв'язок між С і с задається наступним чином:
C = cµ.
Розрізняютьтеплоємності(питомуймолярну) припостійномуоб'ємі (cV і CV) та при постійному тиску (ср і Ср), якщо в процесі нагрівання речовини його об'єм або тиск підтримується незмінним.
З першого закону термодинаміки δQ = dU + δA, з урахуванням δA =
=pdV і С = δQ/νdT, для 1 моль газу отримаємо: С dT = dU + pdV . При V = const робота зовнішніх сил δA дорівнює нулю і надана газу
ззовнітеплотайдетількиназбільшенняйоговнутрішньоїенергії:
CV = dUdT ,
деCV дорівнюєзмінівнутрішньоїенергії1 мольгазуприпідвищеннійого температури на 1 К.
Оскільки dU = i/2RdT, то CV = 2i R .
Якщо газ нагрівається при p = const, то
C |
p |
= |
δQ |
= |
dU + pdV |
= |
dU |
+ |
pdV |
, |
|
|
|
|
|||||||
|
|
νdT |
|
νdT |
|
dT |
dT |
|||
|
|
|
|
|
||||||

106 |
Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА |
|
|
де dUdT незалежитьвідвидупроцесу(внутрішняенергіяідеальногогазу
не залежить від р і V, а визначається тільки Т) та завжди дорівнює СV. Якщо диференціювати рівняння Клапейрона–Менделєєва pV = RT
поТприp = const, отримаєморівнянняМайера:
Cp = CV + R.
Молярна теплоємність при постійному тиску Ср завжди більше від молярної теплоємності при постійному об'ємі CV на величину універсальної газової постійної. Це пояснюється тим, що при нагріванні газу при постійному тиску потрібна ще додаткова кількість теплоти на здійсненняроботирозширеннягазу, оскількипостійністьтискузабезпечується збільшенням об'єму газу:
Cp = 2i R + R = i +22 R.
При розгляданні термодинамічних процесів важливу роль відіграє величина, яканазиваєтьсякоефіцієнтом Пуассона:
γ = Cp = i + 2 .
CV i
Приклади розв'язування задач |
107 |
|
|
Приклади розв'язування задач
Приклад 1. У посудині знаходиться суміш (1 кг кисню і 2 кг гелію) за нормальних умов. Знайти, який об'єм займає суміш, її молекулярну вагу, атакожгустинусумішіцихідеальнихгазів.
|
|
Аналіз і розв'язок |
m1 = 1 кг |
|
Для суміші двох ідеальних газів справед- |
|
||
µ1 = 32 10–3 кг/моль |
|
ливийзаконДальтона: |
m2 = 2 кг |
|
pc = p1 + p2 , |
µ2 = 4 10–3 кг/моль |
|
де р1 і р2 – парціальні тиски, які визначаються |
R = 8,31 Дж/(моль К) |
|
|
|
зрівнянняКлапейрона–Менделєєва pV = m RT : |
|
T0 = 273 К |
|
|
p0 = 1,013 105 Па |
|
µ |
|
|
де Т0 – температура суміші; V – об'єм посуди- |
V – ? µc – ? ρc – ? |
|
|
|
|
ни, де знаходяться змішані гази. |
|
|
Підставляючи в закон Дальтона вирази для p1 та p2, отримаємо:
|
|
|
|
|
|
|
|
m2 |
|
RT0 |
|
||||||
|
|
|
|
m1 |
|
|
|
|
|||||||||
|
|
pc |
= |
|
+ |
|
|
|
|
|
|
|
. |
||||
|
|
|
|
2 |
|
V |
|||||||||||
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
RT0 |
|
|
m1 |
|
|
m2 |
|
|
|||||
Оскільки р |
|
= р , то V = |
|
|
+ |
. |
|
||||||||||
|
|
|
|
|
|
||||||||||||
|
с |
0 |
|
p |
0 |
|
µ |
|
|
|
|
µ |
|
|
|
||
|
|
|
|
|
|
1 |
|
|
|
|
2 |
|
|||||
МолекулярнувагусумішівизначимотакожзрівнянняКлапейрона– Менделєєва:
|
mc |
|
|
|
|
m2 |
|
|
||
|
|
m1 |
|
|
|
|||||
p0V = |
|
|
RT0 |
= |
|
+ |
|
|
RT0 |
, |
µ |
c |
µ |
µ |
2 |
||||||
|
|
|
|
1 |
|
|
|
|
||
тому
µc = |
|
|
mc |
|
= |
(m1 + m2 ) 1 2 |
. |
|
||||
m1 / µ1 |
|
|
|
|
|
|||||||
|
|
+ m2 / µ2 |
(m1µ2 + m2µ1) |
|||||||||
Відповіднодовизначеннягустинисумішімаємо: |
||||||||||||
ρc = |
m1 + m2 |
|
= |
|
p0 (m1 + m2 ) 1 2 |
= |
p0 c |
. |
||||
|
RT0 (m1µ2 + m2µ1) |
|
||||||||||
|
|
V |
|
|
RT0 |
|||||||

108 Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА
Перевіриморозмірністьневідомихфізичнихвеличин:
|
[R][T ] [m2 ] |
[m2 ] |
|
Дж К м |
2 |
кг моль |
|
Н м м |
2 |
3 |
|||||||||||||||||||
[V ]= |
|
|
|
|
|
|
|
+ |
|
|
|
|
|
= |
|
|
|
|
|
|
|
= |
|
|
|
= м ; |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
[p |
] |
[ |
2 |
] |
[ |
2 |
] |
|
|
моль К Н кг |
|
|
Н |
|
|||||||||||||||
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
[µс]= |
|
([m1 |
]+ [m2 ])[µ1][µ2 ] |
= |
кг кг кг моль |
|
|
= кг/моль; |
|||||||||||||||||||||
|
[m1 |
|
|
|
|
моль моль кг кг |
|
||||||||||||||||||||||
|
|
|
][µ2 ]+ [m2 |
][µ1] |
|
|
|
|
|
|
|
||||||||||||||||||
|
[ρс]= |
[p0 |
][µc ] = |
|
|
Н кг моль К |
|
= |
Н кг |
|
|
= кг/м3. |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
[R][T0 ] |
|
|
м2 моль Дж К |
м2 Н м |
|
|
|||||||||||||||||||
ПроведемообчисленняневідомихфізичнихвеличинуСІ:
|
1 |
|
2 |
|
8,31 103 273 |
|
|
V = |
|
+ |
|
|
|
= 12 м3; |
|
32 |
4 |
1,013 105 |
|||||
|
|
|
|
c |
= |
(1 + 2)(32 4) 10−3 |
10−3 |
= 5,64 10−3 |
кг/моль; |
|||||
(1 4 + 2 32) 10−3 |
||||||||||
|
|
|
|
|
|
|
|
|||
|
1,013 105 (1 + 2) 32 4 10−3 10 |
−3 |
|
|
||||||
ρc = |
|
|
|
|
|
|
= 0,252 |
кг/м3. |
||
|
|
8,31 273(1 4 + 2 |
32) 10−3 |
|
||||||
|
|
|
|
|
|
|
||||
Відповідь: V = 12 м3; c = 5,64 10–3 кг/моль; ρc = 0,252 кг/м3.
Приклад 2. Визначити число молекул водню, які перетинають за 1 с площадкуплощею1 см2, розташовануперпендикулярноосі(воденьзнаходиться за нормальних умов).
= 2 10–3 кг/моль
∆t = 1 с
∆S = 1 см2 = 10– 4 м2 ρ0 = 1,013 105 Па T0 = 273 К
R = 8,31 Дж/(моль К) k = 1,38 10–23 Дж/К
n1 – ? n2 – ?
Аналіз і розв'язок
Наведемо два способи розв'язування цієї задачі.
Перший спосіб. Ураховуючи, що в газі немаєпереважнихнапрямківрухумолекул, приймемо, що 1/3 усіх молекул рухається вздовж осіОX, 1/3 – уздовжосіОY і1/3 – уздовжосіОZ. Відповідно в додатному напрямі осі ОX рухається1/6 усіхмолекул. Далізробимоприпущення, що швидкості всіх молекул однакові
Приклади розв'язування задач |
109 |
|
|
йдорівнюютьсереднійшвидкості<v>. Тодішуканечисломолекулскладатиме:
n1 = 16 n0 v ∆S∆t,
деся nза0 –формулоюконцентраціямолекул(їхчисловодиниціоб'єму), якавизначаєть-
|
|
n0 = |
p0 |
, |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
kT0 |
|
|
|
|
|
де k – стала Больцмана. |
|
|
|
|
|
|
|
||
Перевіриморозмірністьневідомоївеличини: |
|
|
|
||||||
[n1] = |
[ p0 ] |
[ v ][∆S][∆t]= |
Н К м м2 |
с |
= |
Н м3 |
= 1. |
||
[k][T0 ] |
|
м2 Дж К |
|
|
|||||
|
|
|
с м2 Н |
м |
|||||
Середня арифметична швидкість може бути знайдена за форму-
лою
v = 8RTπµ0 .
Підставляючи значення середньої арифметичної швидкості, отримаємо:
n = 1 p0 |
8RT0 ∆S∆t. |
|
1 |
6 kT0 |
πµ |
|
||
Проведемо обчислення в СІ:
n = |
|
1 1,013 105 |
8 8,31 273 10−4 1 = 7,2 1023. |
1 |
6 |
1,38 10−23 273 |
3,14 2 10−3 |
|
Другий спосіб. У першому випадку вважалося, що молекули рухаються з однаковою за модулем швидкістю, яка дорівнює середній арифметичній. Однак молекули розподілені за компонентами швидкостей
110 |
Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА |
|
|
згідноіззакономМаксвелла, якийдляодновимірноговипадкулегкоодержатизрозподілу
|
|
|
3 |
|
−mvx2 |
|
|
m |
2 |
|
|
||
|
2kT0 |
|
||||
|
|
|
exp |
|
dvx . |
|
dn(vx )= 4π0 |
2πkT |
|
|
|||
|
0 |
|
|
|
|
|
Отже, число молекул, яке перетинає площадку ∆S = 1 см2 за час ∆t = = 1 с, знайдемозіспіввідношення
|
∞ |
|
|
∞ |
|
|
|
|
1 |
|
|
mvx2 |
|
|
|
|
|
|
m |
|
|
2 |
|
− |
|
||||
|
|
|
|
|
|
|
|
2kT0 |
|
|||||
|
|
|
|
|
|
|
|
|
|
exp |
|
|
vxdvx = |
|
|
|
|
|
|
2πkT |
|
|
|
||||||
n2 = ∆S∆t∫vxdn(vx ) = ∆S∆t∫n0 |
|
|
|
|
||||||||||
|
0 |
|
|
0 |
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
= n0 |
α / π ∆S∆t∞ exp−αvx2 d(αvx2 ) = ∆S∆t n0 |
α / π ∞ exp−t dt = |
||||||||||||
2α |
∫ |
|
|
|
|
|
|
|
|
2α |
|
∫ |
|
|
|
|
0 |
n0 |
[−exp−t ] ∞ = n0∆S∆t |
|
0 |
|
|||||||
|
= ∆S∆t |
, |
|
|
||||||||||
|
|
2 |
απ |
|
|
0 |
|
2 |
|
απ |
|
|
|
|
де α = m/(2kT0). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ураховуючи, що |
v = |
8RT0 /(πµ) , одержимо: |
|
|
|
|||||||||
|
n |
= 1 n v ∆S∆t = |
1 p0 |
8RT0 ∆S∆t = |
||||||||||
|
2 |
4 0 |
|
|
4 kT |
|
|
πµ |
|
|
|
|||
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
= |
1,013 105 |
|
8 8,31 273 |
10−4 1 = 11,1 1023. |
||||||||||
4 1,38 10−23 273 |
3,14 2 10−3 |
|||||||||||||
Таким чином, одержані вирази для n1 і n2 різко відрізняються.
Відповідь: n1 ≈ 7,62 1023; n2 ≈ 11,1 1023.
Приклад 3. Кисень, маса якого 2 кг, знаходиться в закритій посудині об'ємом V1 = 1 м3 під тиском р1 = 2 105 Н/м2. Газ спочатку нагрівають при сталому тиску до об'єму V2 = 3 м3, а потім при сталому об'ємі дотискур3 = 5 105 Н/м2. Обчислитизмінувнутрішньоїенергіїгазу, виконану ним роботу і теплоту, яка була передана газу.
