
Ushkac_Mehanika
.pdfЗадачі для самостійної роботи |
121 |
|
|
109.Знайти питомі теплоємності сV і ср пароподібного йоду, якщо ступінь його дисоціації дорівнює 50 %. Маса 1 кмоль йоду J2 дорівнює 254 кг/кмоль.
110.Знайти, чомудорівнюєступіньдисоціаціїазоту, якщовідношення ср /сV для нього становить 1,47.
111.Знайтипитомутеплоємністьприпостійномутискугазовоїсуміші, що складається із 3 кмоль аргону та 2 кмоль азоту.
112.Знайти відношення ср /сV для газової суміші, яка складається із 8 г гелію та 16 г кисню.
113.Питоматеплоємністьприпостійномуоб'ємігазовоїсуміші, що
складається із 1 кмоль кисню і декількох кіломолей аргону, дорівнює 430 Дж/(кг К). Яка кількість аргону знаходиться в газовій суміші?
114.Знайтимолярнумасуічислостепеніввільностімолекулгазу, якщо відомійогопитомітеплоємності: сV = 0,65 Дж/(г К) таср = 0,91 Дж/(г К).
115.Різниця питомих теплоємностей ср – сV деякого двохатомного газу дорівнює 260 Дж/(кг К). Знайти масу 1 кмоль газу і його питомі теплоємності ср та сV.
116.Під дією високої температури 40 % молекул водню розпалися
наатоми. ЗнайтипитомітеплоємностісртасV такогочастководисоційованоговодню.
117.Які питомі теплоємності ср та сV суміші газів, яка вміщує у собі кисень масою 10 г і азот масою 20 г?
118.Знайтивідношення ср/сV длясумішігазів, якавміщуєусобі10 г гелію і 4 г водню.
119.Пасажирський літак здійснює польоти на висоті 8300 м. Для тогощобнепостачатипасажирівкисневимимасками, укабінахзадопомогою компресора підтримується постійний тиск, що відповідає висоті 2700 м. Знайтирізницютисківусерединійзовнікабіни. Середнютемпературузовнішньогоповітрявважати0 °С.
120.На якій висоті густина газу складає 50 % від його густини на рівні моря? Температуру вважати постійною, що дорівнює 0 °С. Задачу розв'язати для: а) повітря; 2) водню.
121.Наякійвисотітискповітряскладає60 % відйоготискунарівні моря? Вважати, щотемператураповітряскрізьоднаковаідорівнює10 °С.
122.Який тиск повітря в шахті на глибині 1 км, якщо температура
122 |
Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА |
|
|
однакова на будь-якій висоті й дорівнює 22 °С, а прискорення вільного падіння не залежить від висоти? Тиск на поверхні Землі прийняти зар0.
123. Визначитивідношеннятискуповітрянависоті1 кмдотискуна днішахтиглибиною1 км. ПовітрянаповерхніЗемлізнаходитьсяпринормальних умовах, і його температура не залежить від висоти.
124. Наякійвисотігустинаповітрявехрразівменшевідйогогустининарівніморя? Температуруповітряіприскореннявільногопадіннявважати незалежними від висоти.
125. На скільки зменшиться атмосферний тиск р = 100 кПа при піднятті спостерігача над поверхнею Землі на висоту ∆h = 100 м? Вважати, що температура Т = 290 К не змінюється з висотою.
126. На якій висоті h над поверхнею Землі атмосферний тиск удвічі менше, ніжнаповерхні? Вважати, щотемператураповітрядорівнює290 К і не змінюється з висотою.
127. У кабіні гелікоптера барометр показує тиск р = 90 кПа. На якій висоті h летить гелікоптер, якщо на злітному майданчику барометр показував тиск р0 = 100 кПа? Вважати, що температура повітря Т = 290 К не змінюється з висотою.
128. Яказмінависоти∆h відповідаєзмінітиску∆р= 100 Па: 1) поблизу поверхні Землі, де температура Т0 = 290 К, тиск р0 = 100 кПа; 2) на деякій висоті, де температура Т1 = 220 К, тиск р1 = 25 кПа?
129. Барометр у кабіні літака весь час показує однаковий тиск р = = 80 кПа, завдяки чому пілот вважає висоту h польоту незмінною. Однактемператураповітрязміниласяна∆Т= 1 К. Якупомилку∆h увизначенні висоти допустив пілот? Вважати, що температура не змінюється з висотою та на поверхні Землі тиск р0 = 100 кПа.
130. Нехайηo – відношенняконцентраціїмолекулводнюдоконцентрації молекул азоту близько до поверхні Землі, а η – відповідне відношення на висоті h = 3000 м. Знайти відношення η/ηо при Т = 280 К, прийнявши, що температура та прискорення вільного падіння не залежать від висоти.
131. У посудині об'ємом 1 л знаходиться кисень масою 1 г. Визначитиконцентраціюйогомолекулупосудині.
132. У посудині об'ємом 5 л за нормальних умов знаходиться азот. Підрахувати: 1) кількістьречовини; 2) масу азоту; 3) концентраціюйого молекулупосудині.
Задачі для самостійної роботи |
123 |
|
|
133.У посудині об'ємом V = 0,3 л при температурі Т = 290 К знаходитьсядеякийгаз. Наскількизнизитьсятискгазувпосудині, якщойого покинуть N = 1019 молекул?
134.Посудиназводнемрухаласязішвидкістюv = 50 м/с. Наскільки кельвінівнагрієтьсягаз, якщопосудинараптовозупиниться?
135.У балоні об'ємом 15 л знаходиться азот під тиском 100 кПа при температурі 27 °C. Після того, як з балону випустили 14 г азоту, темпе-
ратура газу стала t2 = 17 °C. Визначити тиск азоту, що залишився у балоні.
136.Балон об'ємом V = 20 л містить у собі суміш водню та азоту при температурі 290 К і тиску 1 МПа. Обчислити масу водню, якщо суміш важить 150 г.
137.Азот масою 7 г перебуває під тиском р = 0,1 МПа при температурі Т1 = 290 К. Унаслідок ізобарного нагрівання азот зайняв об'єм V2 =
=10 л. Визначити: а) об'єм V1 газу до розширення; б) температуру Т2 газупіслярозширення; в) густинугазудоіпіслярозширення.
138.Закрита посудина містить у собі суміш азоту масою 56 г і киснюмасою64 г. Визначитизмінивнутрішньоїенергіїсуміші, якщоїїтемпературузнизилина20 К.
139.Кисень масою 32 г знаходиться в замкненій посудині під тиском 0,1 МПа при температурі 290 К. Після нагрівання тиск у посудині збільшився в 4 рази. Визначити: 1) об'єм посудини; 2) температуру, до якоїнагрілигаз; 3) кількістьтеплоти, наданоїгазу.
140.Визначити кількість теплоти, наданої газу, якщо в процесі ізохорногонагріваннякиснюоб'ємомV = 20 лйоготискзмінивсяна100 кПа.
141.Двохатомний ідеальний газ (ν = 2 моль), температура якого Т =
=289 К, нагрівають при сталому об'ємі. Визначити кількість теплоти, яку необхідно надати газу, щоб збільшити його тиск у n = 3 рази.
142.Приізобарномунагріваннідеякогоідеальногогазу (ν = 2 моль) на90 Кйомубулонаданокількістьтеплоти2,1 кДж. Визначити: 1) роботу, виконанугазом; 2) змінувнутрішньоїенергіїгазу; 3) ср/сV.
143.Азот масою m = 280 г збільшується в об'ємі внаслідок ізобарного процесу при тиску р = 1 МПа. Визначити: 1) роботу розширення; 2) кінцевийоб'ємгазу, якщонарозширеннявитраченатеплотаQ = 5 кДж, а початкова температура азоту Т = 290 К.

124Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА
144.Кисень об'ємом 1 л знаходиться під тиском 1 МПа. Визначити, якукількістьтеплотинеобхіднонадатигазу, щоб: 1) збільшитийогооб'єм удвічі внаслідок ізобарного процесу; 2) збільшити його тиск у два рази внаслідокізохорногопроцесу.
145.Деякий газ масою m = 5 г збільшується ізотермічно від об'єму
V1 до об'єму V2 = 2V1. Робота розширення А = 1 кДж. Визначити середню квадратичну швидкість молекул газу.
146.Азот масою m = 14 г стискають ізотермічно при температурі
Т= 300 К від тиску р1 = 100 кПа до тиску р2 = 500 кПа. Визначити: 1) змінувнутрішньоїенергіїгазу; 2) роботустискання; 3) кількістьвиділеноїтеплоти.
147.Балон містить у собі 20 л водню при температурі Т = 300 К під тиском р = 0,4 МПа. Які будуть температура і тиск, якщо газу надати теплоту Q = 6 кДж.
148.Геліймасоюm = 1 гбувнагрітийна100 Кпристалому тиску р. ВизначититеплотуQ, переданугазу, роботуАрозширенняіприріствнутрішньоїенергіїгазу.
149.У циліндрі під поршнем знаходиться азот масою m = 0,6 кг, що
займає об'єм V1 = 1,2 м3 при температурі Т = 560 К. У результаті розширення газ зайняв об'єм V2 = 4,2 м3, при чому температура залишилася сталою. Визначитизмінувнутрішньоїенергіїгазу, виконанунимроботу і теплоту Q, надану газу.
150.Тискповітрявсерединіщільнозакупореноїпляшкипритемпературі7 °Сдорівнює1 атм. Принагріванніпляшкикороквилетів. Знайти, до якої температури нагріли пляшку, якщо корок вилетів при тиску повітря в пляшці 1,3 атм.
2.2. Адіабатичний процес. Робота газу при різних процесах |
125 |
|
|
2.2 Адіабатичний процес. Робота газу при різних процесах
Робота газу при його розширенні
Якщогаз, щознаходитьсяпідпоршнемуциліндричнійпосудині, розширюючись, переміщує поршень на відстань dl, то здійснює над ним роботу δA = Fdl = pSdl = pdV, де S – площина поршня.
ПовнароботаА, якуздійснює газпризміні йогооб'ємувідV1 доV2:
V2
A = ∫ pdV .
V1
Термодинамічний процес називається рівноважним, якщо в ньому система проходить неперервний ряд нескінченно близьких термодинамічно рівноважних станів. Усі реальні процеси нерівноважні, але в ряді випадків (достатньо повільні процеси) нерівноважністю реальних процесів можна знехтувати.
Рівноважніпроцесиможназображуватиграфічно, наприкладукоординатах (p, V) (рис. 2.3). Так, робота δA = pdV визначається площиноюзаштрихованоїділянки, аповнаробота– площиноюпідкривоюміж
V1 доПриV2.нерівноважнихпроцесахзначенняпараметрівурізнихчастинах системи різні та не існує (p, V)-точок, які характеризують стан усієї системи. Тому графічне зображення нерівноважного процесу неможливе.
Діаграма ізохорного процесу (V = const) у координатах (p, V) зображується прямою, яка паралельна осі ординат (рис. 2.4). Процес 3–1 – ізохорненагрівання, процес1–3 – ізохорнеохолодження.
p
p2 


















 2
2
p1 |
1 |
T3 |
||
|
|
|
||
0 |
|
|
|
|
V1 |
V V+dV V2 |
|||
|
||||
Рис. 2.3
|
p |
1 |
|
|
|
p1 |
|
|
|
|
|
|
|
|
|
p2 |
3 |
2 |
|
|
|
|
|
|
V |
0 |
V1 |
V2 |
V |
|
||||
|
|
|
Рис. 2.4 |
|

126 |
Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА |
|
|
Приізохорномупроцесігазнездійснюєроботунадзовнішнімитілами (δA = pdV = 0) і вся теплота, яка надається газу, йде на збільшення йоговнутрішньоїенергії(δQ = dU). ОскількиdUµ = CVdT, тодлядовільної маси газу
δQ = mµ CV dT .
Діаграма ізобарногопроцесу (р= const) у координатах (p, V) зображується прямою, яка паралельна осі абсцис (див. рис. 2.4). Процес 3–2 – ізобарне розширення, процес 2–3 – ізобарне стискання.
Приізобарномупроцесіроботагазупризбільшенніоб'ємувідV1 до V2 дорівнює:
V2
A = ∫ pdV = p(V2 − V ).
V1
Використовуючи рівняння Клапейрона–Менделеєва pV = mµ RT ,
отримуємо V2 − V1 = mR / p (T2 − T1 ) , звідки
A = mµ R(T2 − T ).
Фізичнезначенняуніверсальноїгазовоїсталоїполягаєунаступному: R чисельно дорівнює роботі ізобарного розширення 1 моль ідеального газупринагріваннійогона1 К.
Діаграмаізотермічногопроцесу(Т= const) укоординатах(p, V) єгіперболою(див. рис. 2.4). Процес1–2 – ізотермічнерозширення, процес2–1 – ізотермічне стискання. Ізотермічний процес описується законом Бой- ля–Маріотта (pV = const).
Робота ізотермічного розширення газу
V2 |
V2 |
m dV |
|
m |
|
V |
|
m |
p |
|
||||
A = ∫ pdV = ∫ |
|
RT |
|
= |
|
RT ln |
2 |
= |
|
RT ln |
|
1 |
. |
|
µ |
V |
µ |
V |
µ |
p |
2 |
||||||||
V1 |
V1 |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2.2. Адіабатичний процес. Робота газу при різних процесах |
127 |
|
|
ОскількиприТ= const внутрішняенергіяідеальногогазунезмінюється, то з першого закону термодинаміки виходить, що δQ = δA, тобто вся кількість теплоти, яка надана газу, витрачається на здійснення роботи протизовнішніхсил. Тому, длятогощобприрозширеннігазутемпература не знижувалася, до системи під час ізотермічного процесу необхідно підводити кількість теплоти, яка еквівалентна зовнішній роботі розширення.
Адіабатичний процес. Рівняння Пуассона
Адіабатичним називається процес, при якому відсутній теплообмін між системою і зовнішнім середовищем (δQ = 0). До таких процесів можнавіднестивсішвидкоплинніпроцеси(теплообмінневспіваєвідбутися), наприклад, робочіциклирозширенняйстисканнявдвигунахвнутрішньогозгоряння, поширеннязвукувпружномусередовищітаін.
Такимчином, зпершогозаконутермодинамікивиходить, щоприадіабатичномупроцесіδA = – δU. ВикористовуючиδA = pdV і dU = (m / )CV dT, отримаємо:
|
|
|
|
|
|
pdV = − |
m |
C dT. |
|
|
|
(1) |
|||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
µ |
|
|
V |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Зіншоїсторони, зрівнянняКлапейрона–Менделєєва pV = |
m |
RT ви- |
||||||||||||||||||
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
µ |
|
|
ходить: |
|
|
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
pdV + Vdp = |
RdT. |
|
|
|
(2) |
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
µ |
|
|
|
|
|
|
|
|
|
||
|
Розділивши(2) на(1), отримаємо: |
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
pdV + Vdp |
= − |
R |
= − |
C p |
− CV |
, |
або |
dp |
= −γ |
dV |
, |
|
|
||||
|
|
|
|
pdV |
C |
|
C |
p |
V |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
V |
|
|
|
|
V |
|
|
|
|
|
|
|
|
||
де |
γ = |
C p |
– показник адіабати, або коефіцієнт Пуассона. |
|
|
|
|||||||||||||||
C |
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Інтегрування цього рівняння дає lnV γ |
+ ln p = ln const , звідки вихо- |
|||||||||||||||||||
дитьрівнянняПуассона– рівнянняадіабатичногопроцесу:
pV γ = const.
128 |
|
|
Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА |
||||
|
ВикористовуючирівнянняКлапейрона–Менделєєва pV = (m / )RT , |
||||||
отримуємо рівняння Пуассона в координатах (T, V) та (T, p): |
|||||||
p |
|
|
TV γ −1 = const; T γ p1−γ = const. |
|
|
||
|
|
|
|
Діаграма адіабатичного процесу в ко- |
|||
|
|
|
|
|
|||
p1 |
1 |
T = const |
|
ординатах (р, V) зображується гіперболою |
|||
|
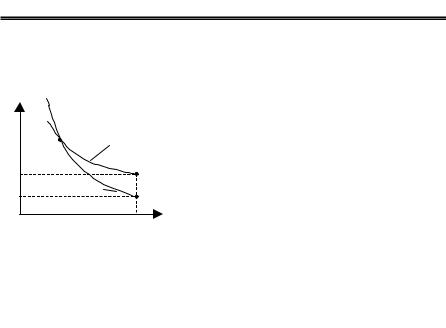
(рис. 2.5). Адіабата 1–3 (pV |
γ |
= const) про- |
||||
|
|
|
|
|
|
||
p2 |
|
|
2 |
|
ходе більш круто, ніж ізотерма 1–2 (pV = |
||
δQ = 0 |
|
= const). Цепояснюєтьсятим, щоприадіа- |
|||||
p3 |
|
|
|||||
3 |
|
батичномурозширенніроботавиконується |
|||||
|
|
|
|||||
0 |
V1 |
|
V2 |
V |
зарахунокзменшеннявнутрішньоїенергії, |
||
|
|
щопризводитьдозменшеннятемператури |
|||||
|
Рис. 2.5 |
|
|
газу. |
|
|
|
|
Робота газу в адіабатичному процесі |
|
|
||||
|
В адіабатичному процесі δA = – dU, тому δA = −(m / )CV dT . Якщо |
||||||
газ адіабатично розширюється від об'єму V1 до V2, то його температура |
|||||||
зменшується від Т1 до Т2 і робота розширення ідеального газу |
|||||||
|
|
|
m |
|
T2 |
|
|
m |
|
|
|
|
|
||||
|
A = − |
CV ∫dT = |
− T2 ). |
|
|
|
|||||||||||
|
|
CV (T1 |
|
|
|
||||||||||||
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
Звідки, використовуючи рівняння Клапейрона–Менделєєва |
|||||||||||||||||
pV = (m / )RT , отримуємо: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
p1V1 |
|
|
V1 |
|
γ −1 |
|
|
RT1 |
|
m |
|
|
|
γ−1 |
|
|
A = |
|
|
|
|
|
= |
|
|
|
V1 |
|
|
|
||||
γ −1 1− V |
|
|
|
γ −1 1 |
− V |
|
|
. |
|||||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Роботаадіабатичногорозширенняменше, ніжприізотермічномупроцесі. Цепояснюєтьсятим, щоприадіабатичномурозширеннівідбувається охолодженнягазу, тодіякприізотермічному– температурапідтримується постійноюзарахунокпритокуззовніеквівалентноїкількостітеплоти.
Політропні процеси
Узагальненням розглянутих вище процесів зміни стану ідеального газуєполітропнийпроцес, якийхарактеризуєтьсянаступнимрівнянням:

2.2. Адіабатичний процес. Робота газу при різних процесах |
129 |
|
|
pV n = const,
декоефіцієнт n = C − C p – показникполітропи.
C − CV
Підчасполітропногопроцесутеплоємністьзалишаєтьсяпостійною (C = const). Ізохорний, ізотермічний, ізобарний і адіабатичний процеси єокремимивипадкамиполітропногопроцесу.
Значення теплоємності та показника політропидлярізнихпроцесів наведенінижче:
Процес |
С |
n |
Адіабатичний |
0 |
γ |
Ізотермічний |
∞ |
1 |
Ізобарний |
Ср |
0 |
Ізохорний |
СV |
±∞ |
Теплоємністьприізотермічномупроцесінескінченновелика, оскільки dT = 0, у той час як δQ ≠ 0.
Теплоємність при адіабатичному процесі дорівнює нулю, оскільки δQ = 0, y той час як dT ≠ 0.
Середня довжина вільного пробігу молекул
Відстань, якувсередньомупроходятьмолекулиміждвомапослідовними зіткненнями, називається середньою довжиною вільного пробігу молекулλ. Величинаλ єхарактеристикоювсієїсукупностімолекулгазу, які задаються даними значеннями тиску та температури.
Мінімальнавідстань, наякузближуютьсяпризіткненніцентридвох молекул, називається ефективним діаметром молекули d.
Середнє число зіткнень, яке відбувається з однією молекулою газу за 1 с, можна виразити наступним чином:
z =  2πd 2n v .
2πd 2n v .
Звідкисереднядовжинавільногопробігумолекули
λ = |
v |
= |
1 |
, |
z |
2πd 2n |
де n – концентрація молекул газу.

130 |
Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА |
|
|
Явища переносу
Однією з умов рівноважного стану термодинамічної системи є відсутністьунійпотоківречовинитаенергії. Якщовгазііснуєпросторова неоднорідністьтемператури, густиниабошвидкостівпорядкованогоруху окремихшарів, товиникаютьнеоборотніпроцеси, спрямованінавирівнюваннявказанихнеоднорідностей.
Явищамипереносуназиваютьсянеоборотніпроцесивтермодинамічно нерівноважних системах, в яких відбувається просторовий перенос енергії(теплопровідність), маси(дифузія), імпульсу(внутрішнєтертя).
Дляспрощенняобмежимосярозглядомодномірнихвипадків, вибираючиосьOX такимчином, щобвонабуласпрямованавнапрямкупереносу. Будеморозглядатипотокиенергії, речовинитаімпульсувпорядкованогорухучастиноккрізьплощадкуодиничноївеличини, розташовану перпендикулярноосіOX, дляідеальногогазу, густинаякогоρ.
Теплопровідність
Якщоводнійобластігазусереднякінетичнаенергіямолекулбільше, ніж у другій, то протягом часу внаслідок постійних зіткнень молекул відбуваєтьсяпроцесвирівнюваннясередніхкінетичнихенергіймолекул– вирівнюваннятемператур.
Переносенергії(вформітеплоти) описуєтьсязакономФур'є:
qE = −k dTdx ,
де qE – густина потоку енергії – теплова енергія, яка переноситься за одиницю часу крізь одиничну площадку, перпендикулярну осі OX;
k = 13 cV ρ v λ – коефіцієнт теплопровідності (cV – питома теплоємність
газу при постійному об'ємі); dT/dx – градієнт температури – швидкість змінитемпературинаодиницюдовжиниOX унапрямкунормалідоцієї площадки.
Дифузія
Явище дифузії полягає в тому, що відбувається самовільне проникнення і перемішування частинок двох стичних систем у газоподібному, рідкомуаботвердомустані. Дифузіюможназобразитиякобмінчастин-
