
Ushkac_Mehanika
.pdfЗадачі для самостійної роботи |
91 |
|
|
139*. Людина, яка стояла в центрі горизонтальної платформи масою 120 кг, що обертається за інерцією навколо нерухомої вертикальної осі, переходитьдоїїкраю, післячогочастотаобертанняплатформизменшиласявдвічі. Вважаючиплатформукруглимодноріднимдиском, алюдину – матеріальною точкою, визначити масу людини.
140*. Горизонтальна платформа радіусом 1 м та масою 120 кг обертаєтьсязаінерцієюнавколонерухомоївертикальноїосіізчастотою10 хв–1. Людинамасою60 кг, якастоїтьнаїїкраю, переходитьдоцентра, здійснюючироботув60 Дж. Вважаючиплатформукруглимодноріднимдиском, а людину – матеріальною точкою, визначити масу людини.
141*. Горизонтальна платформа масою 100 кг обертається навколо вертикальноїосі, щопроходитьчерезїїцентр, роблячи10 об/хв. Людина масою 60 кг стоїть при цьому на краю платформи. Яку роботу здійснює людинаприпереходівідкраюплатформидоїїцентра? Радіусплатформи
1,5 м.
142*. Людина, яка стоїть на лаві Жуковського, тримає в руках стрижень довжиною 2,5 м і масою 8 кг, розташований вертикально вздовж осі обертання лави. Ця система (лава та людина) має момент інерції 10 кг м2 і обертається із частотою 12 хв–1. Визначити частоту обертання системи, якщостриженьповернутивгоризонтальнеположення.
143*. Людина стоїть у центрі лави Жуковського і разом з нею обертається за інерцією. Частота обертання n1 = 0,5 с–1. Момент інерції людинивідносноосіобертаннядорівнює1,6 кг м2. Увитягнутихусторони руках людина тримає гирі масою 2 кг кожна. Відстань між гирями l1 = = 1,6 м. Визначити частоту обертання n2 лави з людиною, коли вона опустить руки і відстань l2 між гирями стане 0,4 м. Моментом інерції лавизневажити.
144*. НанерухомійлавіЖуковськогосидитьлюдинаітримаєвруці велосипедне колесо, яке обертається навколо своєї осі з кутовою швидкістю ω0 = 15 с–1. Вісь колеса розташована вертикально і збігається з віссю лави. З якою швидкістю почне обертатися лава, якщо повернути колесонавкологоризонтальноїосіна180°? Моментінерціїлюдиниілави дорівнює3 кг м2, моментінерціїколесавідносносвоєїосіІ0 = 0,5 кг м2.
145*. На лаві Жуковського сидить людина і тримає на витягнутих рукахгиріпо10 кгкожна. Відстаньвідкожноїгирідоосіобертаннялави дорівнює75 см. Лаваобертається, роблячи1 об/с. Якуроботуздійснить людина, якщо вона стисне руки так, що відстань від кожної гирі до осі
92 |
Розділ1. МЕХАНІКА |
|
|
зменшиться до 20 см, а платформа почне обертатися із частотою 4,2 об/с? Момент інерції людини та лави разом відносно осі обертання дорівнює
2,5 кг м2.
146*. Горизонтальна платформа масою 25 кг і радіусом 0,8 м обертається із частотою 18 хв–1. У центрі стоїть людина й тримає у розведених руках гирі. Вважаючи платформу диском, визначити частоту обертанняплатформи, якщолюдина, опустившируки, зменшитьсвіймомент інерції від І1 = 3,5 кг м2 до І2 = 1 кг м2.
147*. Горизонтальна платформа масою 80 кг і радіусом 1 м обертається з кутовою швидкістю, що відповідає частоті 20 об/хв. У центрі платформи стоїть людина й тримає в розведених руках гирі. У скільки разівзбільшитьсякінетичнаенергіяплатформизлюдиною, якщолюдина, опустивши руки, зменшить свій момент інерції з 2,94 до 0,98 кг м2? Вважати платформу однорідним диском.
148*. На циліндр намотано тонку гнучку нерозтяжну стрічку, масоюякоївпорівняннізмасоюциліндраможназневажити. Вільнийкінець стрічкиприкріпилидокронштейнайнадалициліндруможливістьопускатисяпіддієюсиливаги. Визначитилінійнеприскоренняаосіциліндра, якщовінпорожнистийітонкостінний.
149*. На циліндр намотано тонку гнучку нерозтяжну стрічку, масоюякоївпорівняннізмасоюциліндраможназневажити. Вільнийкінець стрічкиприкріпилидокронштейнаінадалициліндруможливістьопускатися під дією сили ваги. Визначити лінійне прискорення а осі циліндра, якщовінєсуцільним.
150*. Насуцільнукулюнамотанонитку, вільнийкінецьякоїприкріпленодостелі. Кулявільнозмотуєтьсязниткипіддієювласноїваги. Знайти прискореннякулі, якщомасоюітовщиноюниткиможназневажити; початкова довжина нитки набагато більша за радіус кулі.
Розділ 2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА
2.1. Молекулярно-кінетична теорія ідеальних газів
Статистичний і термодинамічний методи дослідження
Молекулярнафізикаітермодинаміка– розділифізики, вякихрозглядаються залежності агрегатних станів та властивостей тіл від їх будови, взаємодії між частинками, з яких складаються тіла, й характеру руху частинок.
Длядослідженняфізичнихвластивостеймакроскопічнихсистем, які налічують велику кількість атомів та молекул, застосовують два якісно різнихметоди, щовзаємнодоповнюютьодинодного: статистичний(або молекулярно-кінетичний) ітермодинамічний.
Статистичний метод – це метод дослідження систем з великої кількості частинок, в якому використовуються статистичні залежності й середні (усереднені) значення фізичних величин, що характеризують усю систему. Цей метод лежить в основі молекулярної фізики – розділу фізики, щодосліджує будову тавластивостіречовини, виходячизмоле- кулярно-кінетичних уявлень про те, що всі тіла складаються з атомів, молекул або іонів, які знаходяться в безперервному хаотичному русі. Властивостімакроскопічнихсистемобумовленінелишеіндивідуальнимивластивостямисамихчастинок, айособливостямиїхсукупнихрухів та середніми значеннями динамічних характеристик частинок.
Термодинамічний метод – це метод дослідження систем з великої кількостічастинок, вякомувикористовуютьсявеличини, щохарактеризують систему в цілому (тиск, об'єм, температура) при різних перетворенняхенергії, яківідбуваютьсявсистемі, невраховуючиприцьомувнутрішньої будови досліджуваних тіл і характеру руху окремих частинок. Цейметодлежитьвосновітермодинаміки– розділуфізики, якийдосліджуєзагальніякостімакроскопічнихсистем, щознаходятьсяустанітермодинамічноїрівноваги, іпроцесипереходуміжцимистанами.
Термодинамічна система
Термодинамічнасистема– сукупністьмакроскопічнихтіл, яківзаємодіють і обмінюються енергією як між собою, так і з іншими тілами (зовнішнім середовищем). Термодинамічні системи, які не обмінюютьсяіззовнішнімсередовищемречовиною, називаютьсязамкненими. Тер-
94 |
Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА |
|
|
модинамічнісистеминазиваютьсяізольованими, якщовонинеобмінюютьсяіззовнішнімсередовищемніенергією, ніречовиною.
Термодинамічні параметри – фізичні величини, якіхарактеризують стан термодинамічної системи: температура, тиск, об'єм та ін.
Якщодляданоїсистемизовнішніумовитаїїстанізчасомнезмінюються, то ця система знаходиться в термодинамічній рівновазі. Параметри стану системи можуть змінюватися. Будь-яка зміна в термодинамічнійсистемі, пов'язаназізміноюхочабодногозїїтермодинамічних параметрів, називається термодинамічним процесом. Такий процес називається рівноважним, якщо система в ньому проходить неперервний ряднескінченноблизькихтермодинамічнорівноважнихстанів.
Температурасистеми, щознаходитьсяврівноважномустані, ємірою інтенсивностітепловогорухуатомів, молекултаіншихчастинок, якіутворюють цю систему. Температура – фізична величина, яка характеризує стан термодинамічної рівноваги макроскопічної системи і визначає напрямтеплообмінуміжтілами.
Для вимірювання температури застосовуються температурні шкали, яківстановлюютьсязадопомогоютермометричнихтіл. Міжнародна практична шкала (шкала Цельсія) градуйована в градусах Цельсія (°С) за двома реперними точками – температурами кристалізації та кипіння водипритиску1,013 105 Па, якіприймаютьсявідповідноза0 і100 °С.
Термодинамічна температурна шкала (шкала Кельвіна), градуйована в градусах Кельвіна (К), визначається за однією реперною точкою – потрійною точкою води – температурою, при якій лід, вода і насичена пара при тиску 609 Па знаходяться в термодинамічній рівновазі. Температурацієїточкизаданоюшкалоюдорівнює273,15 К. ТемператураТ= 0 К називається абсолютним нулем температури.
Термодинамічна температура (Т) і температура (t) за Міжнародною практичноюшкалоюпов'язаніспіввідношеннямТ= 273,15 + t.
Нормальніфізичніумовизадаютьсянаступнимчином: Т0 = 273,15 К,
р0 = 101325 Па.
Ідеальний газ
Ідеальний газ – це фізична модель, що є найпростішим об'єктом, для якого в термодинаміці може бути розглянуте термічне рівняння стану. Приформулюваннімоделі"ідеальнийгаз" приймаютьнаступніприпущення:
1) власним об'ємом молекул газу можна знехтувати відносно об'є- мупосудини;
2.1. Молекулярно-кінетична теорія ідеальних газів |
95 |
|
|
2)сили взаємодії між молекулами газу відсутні;
3)зіткнення молекул газу між собою і зі стінками посудини абсолютнопружні.
Виходячи із цього, ідеальний газ можна розглядати як сукупність молекул-кульок, які хаотично рухаються і не взаємодіють одна з одною на відстані та об'ємом яких можна знехтувати.
Законами, які описують поведінку ідеальних газів, є закони Бойля– Маріотта, Авогадро, Дальтона, Гей-Люссака.
Закон Бойля–Маріотта
Для даної маси газу m при постійній температурі Т добуток тиску р на об'єм V є сталою величиною:
pV = const при T = const і m = const.
Крива, яка відображає залежність між р і V та характеризує якості речовиниприпостійнійтемпературі, називаєтьсяізотермою. Ізотерми– гіперболи, якірозташованінаграфікутимвище, чимвищетемпература даногопроцесу.
Закон Авогадро
Кількість речовини ν – фізична величина, що визначається числом специфічних структурних елементів – молекул, атомів чи іонів, з яких складається речовина.
Одиницякількостіречовини– моль(кількістьречовинисистеми, яка налічуєстількижструктурнихелементів, скількивміщуєтьсяв0,012 кг ізотопукарбону12С).
Водномумолірізнихречовинвміщуєтьсяоднеітежчисломолекул NА, яке називається числом Авогадро:
N A = 6,022 1023 моль–1.
Закон Авогадро формулюється так: молі будь-яких газів при однакових температурі й тиску займають однакові об'єми.
При нормальних умовах (Т = Т0, р = р0) цей об'єм (молярний об'єм)
Vµ = 22,41 10−3 м3/моль.
Молярна маса µ = mν – це маса одного моля речовини.
Одиниця молярної маси – кілограм на моль (кг/моль).
96 |
Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА |
|
|
Закон Дальтона
Парціальнийтиск– тиск, якийутворювавбигаз, якийвходитьусклад газовоїсуміші, якщобвінодинзаймавоб'єм, щодорівнюєоб'ємусуміші при тій же температурі.
Закон Дальтона формулюється наступним чином: тиск суміші ідеальнихгазівдорівнюєсуміпарціальнихтисківр1, р2, …, рn газів, яківнеї входять:
р = р1 + р2 + … + рn або p = ∑ pn.
n
Закон Гей-Люссака
1.Тискрданоїмасиm газуприпостійномуоб'ємізмінюєтьсялінійно
зтемпературою t:
р= р0 (1 + αt) при V = const; m = const.
2.Об'ємV даноїмасиm газуприпостійномутискузмінюєтьсялінійно
зтемпературою t:
V = V0 (1 + αt) при p = const; m = const,
де α = 1/273 К–1; V0 і p0 – відповідно об'єм і тиск при t = 0 °С. Процес, якийпротікаєприпостійномутиску, називаєтьсяізобарним.
На діаграмі в координатах (V, t) цей процес зображається прямою, яка називаєтьсяізобарою. Процес, якийпротікаєприпостійномуоб'ємі, називається ізохорним. На діаграмі в координатах (p, t) він зображається прямою, яка називається ізохорою.
Ізобари та ізохори перетинають вісь температури в точці t = –1/α = = – 273 °С. Якщо початок відліку змістити в цю точку, то отримаємо шкалу Кельвіна (термодинамічну температуру): T = t + 1/α.
У термодинамічній шкалі температур
V = V0 (1 + αt) = V0αT ; p = p0 (1 + αt) = p0αT.
Звідси |
|
|
|
|
|
|
||
|
V1 |
= |
T1 |
або |
V |
= const |
при p = const; m = const; |
|
V |
T |
T |
||||||
|
|
|
|
|||||
2 |
|
2 |
|
|
|
|
||
2.1. Молекулярно-кінетична теорія ідеальних газів |
97 |
|
|
p1 |
= |
T1 |
або |
P |
= const |
при V = const; m = const (закон Шарля), |
||
p |
2 |
T |
T |
|||||
|
|
|
|
|||||
|
|
2 |
|
|
|
|
||
де індекси 1 і 2 відносяться до довільних станів, які лежать на одній ізобарічиізохорі.
Рівняння стану ідеального газу
Рівняннямстанутермодинамічноїсистеминазиваєтьсярівняння, яке зв'язує тиск р, об'єм V і температуру Т термодинамічної системи, що знаходитьсявстанітермодинамічноїрівноваги:
f ( p, V , T ) = 0,
декожназізміннихєфункцієюдвохінших.
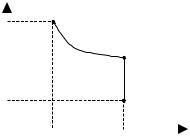
Припустимо, що деяка маса газу знаходиться в стані 1, при цьому її об'єм V1, тиск р1, температура Т1. Ця ж маса газу в іншому довільному стані характеризується параметрами р2, V2, Т2. Перехід зі стану 1 у стан 2 здійснюється послідовно ізотермічним (1–1') та ізохорним (1'–2) процесами (рис. 2.1).
ЗапишемодлявизначенихстаніврівняннязазаконамиБойля–Маріотта і Гей-Люссака:
|
|
|
|
|
p′ |
|
T |
|
p V |
= p′ V |
; |
1 |
= |
1 |
. |
||
|
|
|||||||
1 |
1 |
1 |
2 |
p2 |
|
T2 |
||
|
|
|
|
|
|
|||
Виключаючи p′ , отримаєморівняннястануідеальногогазу: дляда-
1
ної маси ідеального газу відношення добутку тиску та об'єму до термо-
динамічної температури є сталою ве- |
p |
|
|
|
|
|
||||||
личиною(рівнянняКлапейрона): |
|
T1 |
1 |
|
|
|||||||
|
p1V1 |
= |
p2V2 |
або |
pV |
= const. |
p1 |
|
|
|
||
|
|
|
|
|||||||||
|
|
|
|
T1 |
|
|
||||||
|
|
|
|
|
|
|
||||||
|
T1 |
|
T2 |
|
T |
p′1 |
|
|
|
|
||
|
|
|
|
|
1′ |
|
|
|||||
За однакових тиску р і темпера- |
p2 |
|
|
T2 |
|
|
||||||
турі Т молі всіх газів займають одна- |
|
|
|
|
||||||||
|
|
2 |
|
|
||||||||
ковий молярний об'єм V згідно із за- |
|
|
|
|
|
|
||||||
коном Авогадро. Рівняння стану для |
|
|
V1 |
V2 |
V |
|||||||
моля ідеального газу записується на- |
|
|
||||||||||
|
|
|
Рис. 2.1 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|

98 Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА
ступним чином: pV = RT, де константа R = 8,31 Дж/(моль К) – універсальна газова стала.
Длядовільноїмасиm газурівняннястануідеальногогазу(рівняння Клапейрона–Менделєєва) має вигляд
|
|
|
|
|
pV = |
m |
RT . |
|||||||
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
ВикористовуючисталуБольцмана k |
= |
R |
=1,38 10−23 Дж/К, рівнян- |
|||||||||||
|
||||||||||||||
ня стану можна записати так: |
|
|
|
|
|
|
N A |
|||||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
p = |
RT |
= |
kN AT |
|
= nkT, |
|||||
|
|
|
|
V |
|
|
||||||||
|
|
|
|
|
|
|
V |
|
|
|
|
|||
|
|
|
|
µ |
µ |
|
|
|
|
|||||
де n = |
N |
= |
N A |
– концентрація молекул (кількість молекул в одиниці |
||||||||||
V |
V |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
µ |
|
|
|
|
|
|
|
|
|
|
||
об'єму).
Такимчином, можназробитивисновки:
тискідеальногогазуприданійтемпературіпрямопропорційнийконцентраціїйогомолекул;
приоднаковихтемпературійтискувсігазиналічуютьводиниціоб'є- му однакове число молекул.
Кількість молекул, яка налічується в 1 м3 газу за нормальних умов, називається числом Лошмідта:
NL = p0 = 2,68 1025 м–3. kT0
Основне рівняння молекулярно-кінетичної теорії ідеальних газів
Припустимо, що в посудині об'ємом V знаходиться ідеальний газ масою m, який складається з N молекул масою m0, що рухаються з однаковими швидкостями v. За визначенням концентрація молекул у газі n = N/V.
Якщо при зіткненні зі стінками за час ∆t елементарній площадці ∆S стінки посудини передається імпульс ∆Р, то тиск газу, який він створює
настінкупосудини, p = |
∆P |
. |
|
||
|
∆t∆S |
|

2.1. Молекулярно-кінетична теорія ідеальних газів |
99 |
|
|
При кожному зіткненні молекула, яка рухається перпендикулярно стінці, передає їй імпульс 2m0v. У середньому в напрямку до стінки рухається 1/6 частина всіх молекул. (Якщо розглянути три взаємно перпендикулярні осі, то в середньому тільки 1/3 молекул рухається вздовж однієїзосейітількиполовиназних– 1/6 – уздовжданогонапрямку.) За час ∆t площадки ∆S досягне 1/6n∆Sv∆t молекул і передадуть їй імпульс
∆P = 13 nm0v2∆S∆t .
Тиск, якийстворюєгазнастінку посудини, p = 13 nm0v2 .
Якщо газ об'ємом V уміщує N молекул, які рухаються зі швидкостями v1, v2, …, vN, то доцільно розглядати середню квадратичну швидкість, яка характеризує всю сукупність молекул газу та визначається як
v |
2 = 1 N |
v2 = |
1 |
|
v2dN . |
|
N ∑ |
|
N |
vmax |
|
кв |
i |
∫ |
v |
||
|
|
|
|||
|
i =1 |
|
|
0 |
|
Основнерівняннямолекулярно-кінетичноїтеоріїідеальнихгазівмає вигляд
p = 13 nm0 vкв 2.
Існують й інші варіанти запису цього рівняння з урахуванням співвідношень
|
1 Nm v |
2 |
; pV = 2 |
N m0 vкв |
2 |
2 Е; |
|
pV = |
= |
||||||
|
3 |
0 |
кв |
3 |
2 |
|
3 |
|
|
|
|
||||
pV = |
1 m v |
2 ; pV = 1 |
v |
2 |
, |
||
|
3 |
кв |
|
3 |
|
кв |
|
|
|
|
|
|
|
||
де Е– сумарна кінетична енергія поступальногоруху всіхмолекул газу; V – молярний об'єм; – молярна маса.
Використовуючи рівняння Клапейрона–Менделєєва, отримаємо
100 Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА
RT = 1 v |
2, звідки середньоквадратична швидкість молекул ідеаль- |
|||||||||
3 |
кв |
|
|
|
|
|
|
|
|
|
ногогазу |
|
|
|
|
|
|
|
|
|
|
|
|
|
vкв = |
|
3RT |
= |
3kT . |
|||
|
|
|
|
|
|
|
|
m0 |
|
|
Середнякінетичнаенергіяпоступальногорухуоднієїмолекулиіде- |
||||||||||
альногогазу |
|
|
|
|
|
|
|
|
||
|
|
|
|
E |
|
|
2 |
|
3 |
|
|
|
ε0 |
= |
= |
m0 vкв |
= |
kT. |
|||
|
|
N |
2 |
|
2 |
|||||
|
|
|
|
|
|
|
|
|||
Звідси випливає, що при Т = 0 К |
ε0 |
= 0 – рух молекул газу зупи- |
||||||||
няється.
Молекулярно-кінетичнетлумаченнятемпературиформулюєтьсятак: термодинамічна температура – міра середньої кінетичної енергії поступальногорухумолекулгазу.
Закон Максвелла про розподіл молекул ідеального газу за швидкостями
Угазі, щознаходитьсяустанірівновагиприданійтемпературі, встановлюєтьсядеякийстаціонарнийрозподілмолекулзашвидкостями, який не змінюється із часом. Цей розподіл описується функцією f (v), яка називається функцією розподілу молекул за швидкостями, що визначає відносне число молекул, швидкості яких лежать в інтервалі v...v + dv, тобто
dN(v) = f (v)dv. N
Закон Максвелла можна записати у вигляді
|
|
|
3 |
|
|
|
v2 |
|
|
|
m |
|
|
|
|
m |
|||
0 |
2 |
|
|||||||
f (v) = 4π |
|
|
v2 exp |
− |
0 |
|
. |
||
|
|
|
|
||||||
2πkT |
|
|
2kT |
|
|||||
|
|
|
|||||||
Якщо по осі абсцис відкласти швидкості v, а по осі ординат – функцію f (v), то для різних температур T1 < T2 < T3 криві розподілу молекул за швидкостями будуть мати вигляд, зображений на рис. 2.2.
