
Ushkac_Mehanika
.pdf
2.2. Адіабатичний процес. Робота газу при різних процесах |
131 |
|
|
ками(переносмаси) міжцимитілами, щовиникаєіпродовжується, поки існуєградієнтгустини.
Перенос маси (дифузія) для хімічно однорідного газу описується закономФіка:
qm = −D ddxρ ,
деqm – густинапотокумаси– масаречовини, якапереноситьсязаодини-
цючасукрізьодиничнуплощадку, перпендикулярнуосіOX; D = 13 v λ –
коефіцієнт дифузії; dρ/dx – градієнт густини, який дорівнює швидкості змінигустининаодиницюдовжини OX y напрямкунормалідоцієїплощадки.
Внутрішнє тертя (в'язкість)
У зв'язку з хаотичним тепловим рухом молекул відбувається обмін молекуламиміжшарамигазу, щорухаютьсязрізнимишвидкостями, внаслідокчогоімпульсшару, якийрухаєтьсяшвидше, зменшується, атого, що рухаєтьсяповільніше– збільшується(відбуваєтьсяперенесенняімпульсу від одного шару до іншого). Це призводить до гальмування шару, якийрухаєтьсяшвидше, іприскоренняшару, щорухаєтьсяповільніше.
Внутрішнє тертя описується законом Ньютона:
qp = − η dvdx ,
де qp – густина потоку імпульсу – повний імпульс, який переноситься водиницючасувпозитивномунапрямкуосіOX крізьодиничнуплощад-
ку, перпендикулярну осі OX; η = 13 ρ v λ – динамічна в'язкість; dv/dx –
градієнт швидкості, який показує бистроту зміни швидкості в напрямку OX, перпендикулярномурухушарівгазу.
Зовнішнясхожістьматематичнихвиразів, якіописуютьявищапереносу, обумовлена спільністю молекулярного механізму перемішування молекулупроцесіїххаотичногоруху, якийлежитьвосновітеплопровідності, дифузіїтавнутрішньоготертя.
132 |
|
Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА |
||
|
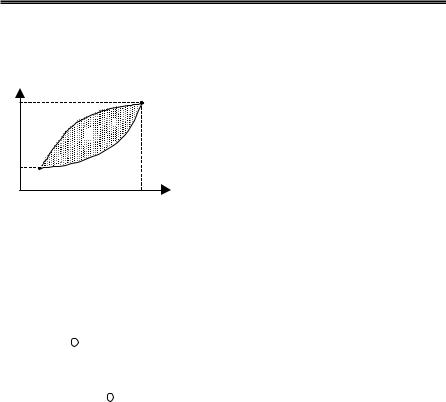
Круговий процес (цикл) |
|
||
|
Круговимпроцесом(циклом) називаєтьсясукупністьтермодинаміч- |
|||
них процесів, унаслідок яких система повертається в початковий стан. |
||||
Надіаграмі, наприкладукоординатах(p, V), рівноважнікруговіпроцеси |
||||
p |
|
|
|
зображуються графічно замкненою кри- |
p2 |
3 |
2 |
|
вою (рис. 2.6). |
|
|
|
Тіло, якездійснюєкруговийпроцеста |
|
|
А |
|
|
обмінюється енергією з іншими тілами, |
p1 |
11 |
4 |
|
називається робочим тілом. |
|
Робота за цикл А визначається пло- |
|||
|
|
|
||
|
|
|
|
|
0 |
V1 |
V2 |
V |
щиною, якаохопленазамкненоюкривою |
|
(див. рис. 2.6). Робота – це функція не |
|||
|
Рис. 2.6 |
|
тільки стану термодинамічної системи, |
|
але і виду процесу, який відбувається. Тому робота не є однозначною |
||||
функцієюстану(такою, яквнутрішняенергія). Зпершогозаконутермо- |
||||
динамікивиходить, щотеплотаQ, такожякіроботаА, єфункцієюпроце- |
||||
су, який відбувається із системою. |
||||
|
Цикл називається прямим, якщо за цикл здійснюється позитивна |
|||
робота A = ∫ pdV > 0: вінпротікаєзагодинниковоюстрілкою13241 (див.
рис. 2.6). Циклназиваєтьсязворотним, якщозациклздійснюєтьсянега-
тивнаробота A = ∫ pdV < 0: вінпротікаєпротигодинниковоїстрілки14231
(див. рис. 2.6).
Прямийциклвикористовуєтьсявтепловихдвигунах(періодичнодіючий пристрій, що здійснює роботу за рахунок теплоти, яку отримує ззовні). Зворотнийциклвикористовуєтьсявхолодильнихмашинах(періодичнодіючийпристрій, вякомузарахунокзовнішніхсилтеплотапереноситься до тіла з більш високою температурою).
Термодинамічний процес називається оборотним, якщо він може відбуватися як у прямому, так і в зворотному напрямках. Причому, якщо такий процес відбувається спочатку в прямому, а потім у зворотному напрямку і система повертається в початковий стан, то в навколишньому середовищі та в цій системі не відбувається ніяких змін. Будь-який процес, який не задовольняє цим умовам, є необоротним.

2.2. Адіабатичний процес. Робота газу при різних процесах |
133 |
|
|
Реальні процеси необоротні, в них завжди відбувається дисипація(втрата) енергії (через тертя, теплопровідність тощо). Оборотні процеси– цефізичнамодель, ідеалізаціяреальнихпроцесів.
Коефіцієнт корисної дії кругового процесу. Цикл Карно
У результаті кругового процесу система повертається в початковий стан, відповідно повна зміна внутрішньої енергії дорівнює нулю. Тому Q = ∆U + A = A, тобто робота, яка здійснюється за цикл, дорівнює кількостіотриманоїзовнітеплоти. ЯкщовходікруговогопроцесусистеманетількиотримуєкількістьтеплотиQ1, алеівтрачає(віддає) кількість теплоти Q2, то Q = Q1 – Q2.
Термічнийкоефіцієнткорисноїдії(ККД) длякруговогопроцесу– це величина, що дорівнює відношенню роботи, яку здійснює система, до кількості теплоти, яку отримає в цьому циклі система:
η = |
A |
= |
Q1 − Q2 |
= 1 |
− |
Q2 |
. |
Q |
Q |
|
|||||
|
|
|
|
Q |
|||
|
1 |
|
1 |
|
1 |
|
|
Цикл Карно складається із чотирьох оборотних процесів: двох ізотермічних та двох адіабатичних. Термічний ККД циклу Карно
η = Q1 − Q2 = T1 − T2 .
Q1 T1
134 |
Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА |
|
|
Приклади розв'язування задач
Приклад1. Ефективнийдіаметрмолекулиповітрядорівнює2,9 10–10 м. Визначити середню довжину вільного шляху λ та середню частоту зіткнень молекули повітря z при температурі 273 К і тиску 1,01 Па.
d = 2,9 10–10 м
T0 = 273 К p = 1,01 Па
k = 1,38 10–23 Дж/К
R = 8,31 Дж/(моль К) µ = 29 10–3 кг/моль λ – ? z – ?
Аналіз і розв'язок
За1 смолекулаповітрязазнаєвсередньому z =  2πd 2n v зіткнень з іншими моле-
2πd 2n v зіткнень з іншими моле-
кулами повітря. Середня довжина вільного пробігу молекули між двома послідовними зіткненнями
λ = |
1 |
, |
(1) |
2πd 2n |
де n – концентрація молекул (відношення числа молекул до об'єму газу, в якому вони знаходяться).
Для визначення невідомої концентрації молекул повітря скористає- мосяосновнимрівнянняммолекулярно-кінетичноїтеорії:
p = |
2 n ε0 , |
(2) |
|
3 |
|
дер– тискгазу; ε0 – середняенергіяпоступальногоруху молекулгазу, якадорівнює
ε0 |
= |
3 kT, |
(3) |
|
|
2 |
|
де k – стала Больцмана; Т – термодинамічна температура газу. Підставимо (3) у(2) ізнайдемо концентрацію молекул:
n = |
p |
. |
(4) |
|
|||
|
kT |
|
|
|
0 |
|
|
Підставивши (4) у (1), одержимо:
λ = |
kT |
2πd 2 p . |
Приклади розв'язування задач |
|
|
|
|
|
135 |
|||
|
|
|
|
||||||
Перевіриморозмірністьневідомоївеличини: |
|
|
|||||||
[λ] = |
[k][T ] |
= |
Дж К м2 |
= |
Дж |
= |
Н м |
= м. |
|
[d 2 ][ p] |
К м2 Н |
Н |
Н |
||||||
|
|
|
|
|
|||||
Обчислимоневідомудовжинувільногопробігумолекулиповітря:
λ = |
1,38 10 |
−23 273 |
= 10−2 = 1 см = 10−2 м. |
|
3,14(2,9 |
10−10 )2 |
|||
2 |
1,01 |
Середня частота зіткнень молекул повітря пов'язана з довжиною вільногопробігуспіввідношенням
z = |
v |
, |
(5) |
|
λ |
|
|
де v – середня арифметична швидкість молекул, яку можна визначити заформулою
v = |
8RT |
, |
(6) |
|
πµ |
|
|
де R – універсальна газова стала; – молярна маса повітря. Підставимо (6) у (5), після перетворення одержимо:
z = |
8RT . |
(7) |
|
π λ2 |
|
Перевіриморозмірністьсередньоїчастотизіткненьмолекулповітря:
[ z ]= [R][T ] |
= |
Дж К моль |
= |
кг м2 |
= 1 |
= |
1 |
= с−1. |
[ ][λ2 ] |
|
моль К кг м2 |
|
с2 кг м2 |
с2 |
|
с |
|
Обчислимо невідому частоту зіткнень: |
|
|
|
|
||||
z |
= |
8 8,31 273 |
|
= 4,47 104 |
с−1. |
|
|
|
3,14 29 10−3 10−4 |
|
|
|
|||||
|
|
|
|
|
|
|
||
Відповідь: λ = 10–2 м; z = 4,47 104 с–1.

136 |
Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА |
|
|
Приклад 2. Використовуючи загальне рівняння політропи, знайти вираздляроботиідеальногогазуприполітропномупроцесізмінипара-
метрів від р1, V1, Т1 до р2, V2, Т2.
Розглянемо окремі випадки: 1) С = Ср; 2) С = СV; 3) С = 0; 4) С = ∞.
Аналіз і розв'язок задачі у загальному вигляді
Рівняння політропного процесу, який відбувається зі сталою теплоємністю, має вигляд
pV n = const,
|
C p − C |
|
C p −C |
|
||
де n = |
– показник політропи, тобто pV |
C −C |
= const . |
|||
|
|
V |
||||
C |
− C |
|||||
|
|
|
|
|||
|
V |
|
|
|
|
|
Іззагальногорівнянняполітропивипливає, що p1V1n = p2V2n = pV n, де ріV – будь-якіпроміжні значення параметрів вінтервалі(p1V1, p2V2). Отже,
p = p1V1n V1n .
Узагальномувипадку будь-якогопереходуідеальногогазузістану 1 до стану 2
A12 = ∫2 pdV.
1
значить,
V2
A12 = p1V1n ∫ dV
V1 V n
|
p1V1 |
|
|
|
n−1 |
|
|
|
|
|
|
V1 |
|
|
|
= |
|
= n −1 1 |
− V |
|
|
|
||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
||
p1V1
R
|
|
|
R |
|
|
CV −C |
|||
|
V1 |
|
||
(CV − C) 1 |
|
|||
− V |
|
|||
|
2 |
|
||
|
|
|
|
|
.
Легкопереконатися, щоданазагальнаформулароботиполітропного процесу перетворюється на окремі формули при відповідних значеннях теплоємностіС. Дійсно,
якщо С = Ср, тобто при ізобарному процесі
A12 |
= − p1V1 |
|
V2 |
|
= p1[V2 |
− V1]; |
|
1 |
− |
|
|
||||
V |
|||||||
|
|
|
1 |
|
|
|
|

Приклади розв'язування задач |
137 |
|
|
якщоС= СV, тобтоприізохорномупроцесі |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
p1V1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
CV −C |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V1 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
A12 = |
|
|
|
|
|
(CV − C) 1− |
|
|
|
|
|
|
|
|
|
= 0; |
|
|
|||||||||||||||||||
|
|
|
|
|
R |
|
V |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
якщо С = 0, тобто при адіабатичному процесі |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
γ −1 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
p1V1 |
|
|
|
V1 |
CV |
|
|
|
|
|
|
p1V1 |
|
|
|
|
|
m |
|
|
|
|
T2 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
A |
= |
− |
|
|
|
|
|
= |
|
|
|
|
V1 |
|
|
|
|
|
= |
|
RT |
|
− |
||||||||||||||||||
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|||||||||||||||||||||
γ −1 |
V |
|
|
|
|
|
|
γ −1 |
1− |
V |
|
|
|
|
|
|
T |
||||||||||||||||||||||||
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
якщо С = ∞, тобто при ізотермічному процесі |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
V1 |
CV −C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
1− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
V1 |
|
|
|
|
m |
RT ln V2 |
||||||||||
|
|
A = p V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= − p V ln |
|
= |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
12 |
|
1 |
1 |
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
1 |
|
1 |
|
V2 |
|
|
|
|
|
|
V1 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
CV − C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
γ 1−1;
.
В останній формулі застосовано відому теорему, згідно з якою
lim ak −1 = ln a.
k→0 k
138 |
Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА |
|
|
Задачі для самостійної роботи
Адіабатичний процес. Робота газу при різних процесах. Явища переносу
1.Кисень масою 10 г знаходиться під тиском 3 105 Н/м2 при температурі10 °С. Післянагріванняприпостійномутискугаззайнявоб'єм10 л. Знайти кількість теплоти, отриману газом, та енергію теплового руху молекул газу доіпісля нагрівання.
2.Водень масою m = 10 г нагріли на 200 К, при цьому газу була наданатеплотаQ = 40 кДж. Визначитизмінувнутрішньоїенергіїводню
івиконанунимроботу.
3.Азот масою 12 г знаходиться в закритій посудині об'ємом 2 л при температурі 10 °С. Після нагрівання тиск у посудині став дорівнювати 104 мм рт. ст. Яку кількість тепла було надано газу при нагріванні?
4.Азот об'ємом 2 л знаходиться під тиском 105 Н/м2. Яку кількість теплотинеобхіднонадатиазоту, щобприp = const об'ємзбільшитивдвічі?
5.Кисень об'ємом 5 л знаходиться під тиском 2 105 Н/м2. Яку кількість теплоти необхідно надати системі, щоб при V = const тиск збільшитивдвічі?
6.У закритій посудині знаходиться 14 г азоту під тиском 105 Н/м2
іпритемпературі27 °С. Післянагріваннятискупосудиніпідвищивсяв5 разів. Знайти: 1) до якої температури був нагрітий газ; 2) який об'єм посудини; 3) яка кількість теплоти надана газу?
7.Яку кількість теплоти необхідно надати 12 г кисню, щоб нагріти йогона50 Кприпостійномутиску?
8.На нагрівання 40 г кисню від 16 до 40 °С витрачено 150 кал. При якихумовахнагрівавсягаз? (Припостійномуоб'ємічипостійномутиску?)
9.У закритій посудині об'ємом 10 л знаходиться повітря під тиском 105 Н/м2. Якукількістьтепланеобхіднонадатиповітрю, щобпідвищити тиск упосудинів5 разів?
10.Яку кількість вуглекислого газу можнанагрітивід20 до100 °С, надаючитеплоту0,053 ккал? Наскількиприцьому змінитьсякінетична енергіяоднієїмолекули? Підчаснагріваннягазрозширюєтьсяприр= const.
11.У закритій посудині об'ємом V = 2 л знаходиться азот, густина якогоρ = 1,4 кг/м3. ЯкукількістьтеплотиQ необхіднонадатиазоту, щоб нагрітийогоприцихумовахна∆t = 100 °С?
12.Азот знаходиться в закритій посудині об'ємом 3 л при температурі27 °Сітиску3 aтм. Післянагріваннятискупосудиніпідвищивсядо
Задачі для самостійної роботи |
139 |
|
|
25 aтм. Визначити: 1) температуру азоту після нагрівання; 2) кількість наданого азоту тепла.
13.Для нагрівання деякої кількості газу на 50 °С при постійному тискунеобхідновитратити160 кал. Якщоцюжкількістьгазуохолодити на 100 °С при постійному об'ємі, то виділиться 240 кал. Яку кількість степенів вільності мають молекули цього газу?
14.Азот масою 10 г знаходиться в закритій посудині при температурі 7 °С. Визначити: 1) яку кількість тепла необхідно надати азоту, щобзбільшитисереднюквадратичнушвидкістьйогомолекулудвічі?
2)у скільки разів при цьому зміниться температура газу? 3) в скільки разівприцьомузмінитьсятискгазунастінкипосудини?
15.Гелій знаходиться в закритій посудині об'ємом 2 л при температурі 20 °С і тиску 105 Н/м2. Знайти: 1) яку кількість тепла необхідно надати гелію, щоб підвищити його температуру на 100 °С? 2) якою буде середня квадратична швидкість його молекул при новій температурі?
3)який установиться тиск? 4) якою буде густина гелію? 5) якою буде енергіятепловогорухуйогомолекул?
16.У закритій посудині об'ємом 2 л знаходиться однакова маса азоту й аргону за нормальних умов. Яку кількість тепла необхідно надати, щоб нагріти цю газову суміш на 100 °С?
17.Кисень масою 10 г знаходиться під тиском 3 105 Н/м2 при температурі 10 °С. Після нагрівання при постійному тиску газ зайняв об'єм 10 л. Знайти кількість теплоти, отриманої газом.
18.Водень масою 15 г знаходиться під тиском 0,15 МПа при температурі15 °С. Післянагріванняприпостійномутискугаззайнявоб'єм20 л. Знайтизмінувнутрішньоїенергіїгазу.
19.Водень масою 6,5 г, що знаходиться при температурі 27 °С, розширюєтьсявдвічіприр= const зарахунокприпливутеплаззовні. Знайти роботурозширеннятазмінувнутрішньоїенергіїгазу.
20.Азот масою 18 г, що знаходиться при температурі 37 °С, розширюється втричі при р = const за рахунок припливу тепла ззовні. Знайти змінувнутрішньоїенергіїгазутакількістьтеплоти, наданоїгазу.
21.У закритій посудині знаходяться 20 г азоту і 32 г кисню. Знайти змінувнутрішньоїенергіїцієїсумішігазівприїїохолодженніна28 К.
22.Азот знаходиться під тиском p = 4 10–15 атм (при нормальній температурі). Знайтикількістьйогомолекулу1 см3 тасереднювідстань міжнимиприцьомутиску.

140Розділ2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА
23.При ізобарному нагріванні деякого ідеального газу (ν = 2 моль) на ∆Т = 90 К йому була надана кількість теплоти 2,1 кДж. Визначити: а) роботу, якувиконавгаз; б) змінувнутрішньоїенергіїгазу; в) величину
γ = Cр/CV.
24. При ізотермічному розширенні 4 м3 газу його тиск змінився від р1 = 6 105 Па до р2 = 106 Па. Знайти виконану при цьому роботу.
25. При адіабатичному розширенні кисню (ν = 2 моль), який знаходився при нормальних умовах, його об'єм збільшився в п = 3 рази. Визначитизмінувнутрішньоїенергіїгазу.
26. При адіабатичному розширенні гелію (ν = 4 моль), який знаходився при нормальних умовах, його об'єм збільшився в п = 2 рази. Визначитироботурозширеннягазу.
27. До якої температури охолодиться повітря, що знаходиться при температурі0 °С, якщовонорозширюєтьсяадіабатичновідоб'ємуV1 до
об'єму V2 = 2V1?
28. Визначити середню довжину вільного пробігу молекули вуглекислого газу при температурі 100 °С і тиску 0,1 мм рт. ст. Діаметр молекуливуглекислогогазу3,2 10–8 см.
29. Знайти середнє число зіткнень за 1 с молекул деякого газу, якщо середня довжина вільного пробігу при цих умовах дорівнює 5 104 см, а середня квадратична швидкість його молекул – 500 м/с.
30. Вуглекислий газ і азот знаходяться при однакових температурі йтиску. Знайтидляцихгазіввідношеннякоефіцієнтівдифузії. Діаметри молекул вважати однаковими.
31. Визначитикоефіцієнттеплопровідностіазоту, якийзнаходиться в деякому об'ємі при температурі 280 К. Ефективний діаметр молекул азотудорівнює0,38 нм.
32. Азот масою 500 г, що знаходиться під тиском р1 = 1 МПа при температурі t1 = 127 °С, ізотермічно розширюється так, що його тиск зменшується в n = 3 рази. Після цього газ адіабатично стискають до початкового тиску, а потім ізобарно стискають до початкового об'єму. Побудуватиграфікциклуізнайтироботу, виконанугазомзацикл.
33. Циліндр радіусом r = 12 см і довжиною l = 40 см розташований усередині другого циліндра з радіусом R = 12,5 см так, що осі обох циліндрівспівпадають. Малийциліндрнерухомий, великийобертається із частотою п = 12 с–1. Динамічна в'язкість газу, в якому знаходиться циліндр, η = 8,5 мкПа с. Якасиладієнаодиницюповерхнівнутрішнього циліндра?
