
хирургия 5 курс / книги / Savel'ev V.S. (red.) 80 lekcij po hirurgii (Litterra, 2008)(ru)(T)(K)(910s)(ISBN 9785982161190)
.pdf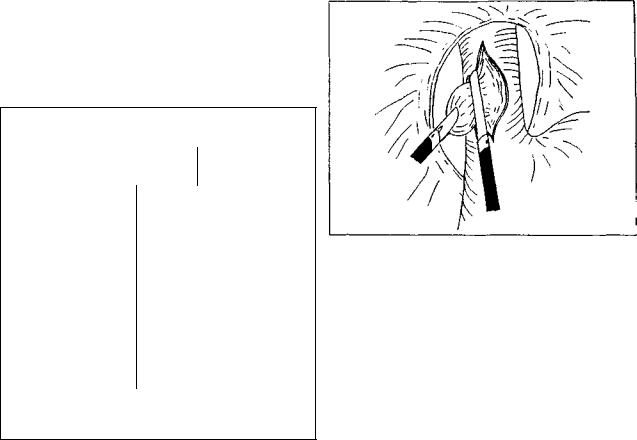
Видеоэндоскопическая хирургия пищевода
полость вводят раствор антисептика так, чтобы линия шва была полностью погружена в жидкость, через эзо фагоскоп в просвет пищевода нагнетают воздух. При эпифренальных дивертикулах дополнительно произво дят эзофагомиотомию. В плевральной полости устанав ливают дренажную трубку.
*&*z=ZrJ
>!\р~. ~~^^"v.
41 |
?\%У Ч " - ^ |
|
|
||||
|
|||||||
|
&г- |
~ |
|
s ч] ~~^ |
|
|
|
- * * г / |
|
|
|
|
|||
^^^Н |
L^Yv |
|
|
|
|
|
|
^^^^^^ |
\ |
^^^ri |
|
]&•// 5 |
|
|
|
^ ^ |
|
|
|
|
|||
|
|
^ш\ • |
ш^л |
|
|
||
"шЛ^ f >: |
|
|
|||||
|
|
|
|
Щ-^==- jg |
|
|
|
" ~ |
^ |
\ |
|
|
|
|
|
^^
Рис. 9. Торакоскопическая дивертикулэктомия
Рис. 10. Лапароскопическая дивертикулэктомия
Доброкачественные опухоли и кисты пищевода
Доброкачественные новообразования пищевода встречаются редко. Они составляют 0,5—5% от всех опу холей пищевода. По характеру роста доброкачественные новообразования пищевода делят на внутрипросветные (полипообразные) и внутристеночные. По происхожде нию и гистологическому строению — на эпителиальные: аденоматозные полипы, папилломы; кисты и неэпите лиальные (мезенхимальные): лейомиомы, рабдомиомы, липомы, фибромы, гемангиомы, хондромы и др.
Лапароскопический доступ используют в хирурги ческом лечении эпифренальных дивертикулов. После введения инструментов и ревизии органов брюшной полости производят тракцию желудка каудально, отво дят ретрактором левую долю печени. Рассекают брю шину, покрывающую абдоминальный отдел пищевода, диафрагму отслаивают от пищевода острым и тупым путем (при необходимости может быть выполнена диафрагмотомия). Под контролем эзофагоскопа визу ализируют дивертикул, который с помощью электрохи рургического крючка освобождают из рубцовых тканей и выделяют до стенки пищевода. Тракция пищевода в разные стороны облегчает выполнение мобилизации. Линейный степлер проводят в заднее средостение параллельно стенке пищевода, дивертикул помещают между браншами сшивающего аппарата и отсекают на уровне шейки {рис. 10). Выполняют контроль гер метичности швов. Операцию завершают выполнени ем внеслизистой эзофагомиотомии. Брюшную полость дренируют.
Доброкачественные опухоли пищевода примерно в половине случаев протекают бессимптомно. При внутрипросветных опухолях ведущим симптомом является дисфагия, обычно незначительно или умеренно выра женная. Другими симптомами могут быть тупые боли и ощущение инородного тела за грудиной, тошнота, слю нотечение. Иногда при регургитации опухоли на ножке, расположенной в шейном отделе пищевода, может возникнуть асфиксия.
Наиболее часто встречающейся доброкачественной опухолью пищевода (60—70%) является лейомиома. Длительное время лейомиомы протекаютбессимптомно. При больших размерах опухоли или при циркулярном росте возникают явления дисфагии, реже встречается «компрессионный синдром», связанный со сдавленней органов средостения.
Кисты занимают второе место по частоте среди всех доброкачественных новообразований пищевода. Большинство кист являются врожденными. Наиболее часто они локализуются в нижней трети пищевода.
15 КОлскций по хирургии |
361 |
|
Торакальная хирургия
Клиническая картина кист соответствует клинической картине других доброкачественных новообразований пищевода. Нередко наблюдается изъязвление и кровоте чение в просвет кисты, при инфицировании кисты могут нагнаиваться. Описана злокачественная трансформация кист, что наблюдается и при других доброкачественных новообразованиях пищевода у 10% больных.
Прочие виды доброкачественных опухолей встреча ются исключительно редко.
Объективное исследование, как правило, не выявля ет специфических симптомов доброкачественных ново образований пищевода. Основными способами инс трументальной диагностики являются рентгенография пищевода, эзофагоскопия, компьютерная или магнитнорезонансная томография.
При рентгенологическом исследовании внутрипросветные опухоли определяются в виде локального утолщения одной из складок или округлого дефекта наполнения на широком основании или на ножке. При внутристеночных опухолях складки слизистой сохране ны, опухоль дает краевой дефект наполнения с ровными контурами, перистальтика и эластичность пищевода в зоне проекции новообразования сохранены.
Всем больным с подозрением на опухоль пищевода необходима эзофагоскопия. При внутрипросветных опу холях выполняют прицельную биопсию с последующим морфологическим исследованием материала. Для внут ристеночных опухолей характерно наличие образования, выступающего в просвет пищевода, слизистая оболочка над ним, как правило, не изменена. При изъязвлении опухоли можно обнаружить дефект слизистой оболочки. При наличии неизмененной слизистой оболочки над новообразованием биопсию выполнять не следует.
Лечение доброкачественных опухолей пищевода — только оперативное в связи с возможностью злока чественного перерождения, кровотечения и других осложнений.
Внутрипросветные опухоли, располагающиеся на ножке, могут быть удалены с помощью эндоскопа электроэксцизией. Полипы на широком основании иссекают через стенку пищевода с последующим ее послойным ушиванием.
При интрамуральных опухолях и кистах пищевода показана органосохраняющая операция, заключающа яся в вылущивании (энуклеации) опухоли без вскры тия слизистой оболочки с рассечением только мышц. При повреждении слизистой оболочки образовавшийся дефект ушивают, затем накладывают швы на мышечную оболочку пищевода.
Видеоэндохирургический доступ к доброкачествен ным опухолям пищевода осуществляют в зависимости
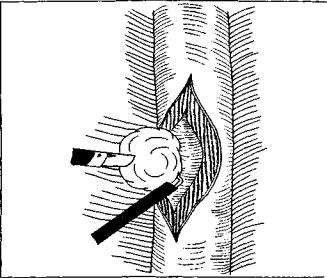
от локализации патологического процесса. При распо ложении опухоли в абдоминальном отделе пищевода операцию производят из лапароскопического доступа, если новообразование локализуется в грудном отде ле пищевода, оперативное вмешательство выполняют торакоскопически. Независимо от доступа пищевод обнажают только над доброкачественным новообразо ванием, рассекают мышечную оболочку над опухолью, когтистым зажимом опухоль фиксируют и частично тупым путем, частично при помощи электрохирургичес ких инструментов выделяют из мышечного слоя и уда ляют (рис. 11). Видеоэндоскопическая техника в связи с увеличением объекта операции в 8—10 раз способству ет хорошей визуализации тканей, что позволяет удалить новообразование без повреждения слизистой оболоч ки. Мышечную оболочку ушивают отдельными швами на атравматической игле. Плевральную или брюшную полость дренируют через один из разрезов.
Рис. 11. Видеоэндосконнческая эннуклеация леномпомы
Грыжи пищеводного отдела диафрагмы
Грыжа пищеводного отверстия диафрагмы — смеще ние какого-либо органа брюшной полости, покрытого брюшиной, через пищеводное отверстие диафрагмы в заднее средостение. Выделяют аксиальные (скользя щие) и параэзофагеальные грыжи. Аксиальные грыжи пищеводного отверстия диафрагмы могутбыть пищевод ными, кардиальными, кардиофундальными, субтоталь ными и тотальными желудочными. Параэзофагеальные грыжи подразделяют на фундальные (встречаются
362
Видеоэндоскопическая хирургия пищевода
наиболее часто), антральные, кишечные, кишечно-желу- дочные и сальниковые.
Причиной образования приобретенных грыж пище водного отверстия диафрагмы являются инволюционные процессы в связочном аппарате пищеводного отверстия диафрагмы, в результате чего последнее расширяется и образуются своего рода грыжевые ворота. Эти измене ния наиболее часто встречаются у стариков, беременных, больных, страдающих ожирением. Непосредственной причиной, вызывающей возникновение грыж пищевод ного отверстия диафрагмы, является повышение внутрибрюшного давления. Грыжи пищеводного отверстия диа фрагмы часто сочетаются с язвенной болезнью желудка и двенадцатиперстной кишки, хроническим холецис титом, дивертикулезом толстой кишки, дивертикулами пищевода, ахалазией кардии и кардиоспазмом.
Клиническая картина грыж пищеводного отверс тия диафрагмы очень разнообразна. В 5—40% случаев клинические проявления отсутствуют, в основном при грыжах небольших размеров. '-—
Симптомами грыж пищеводного отверстия диафрагмы могут быть изжога, боль, отрыжка, регургитация, дисфагия, икота. Изжога наблюдается обычно после еды, при перемене положения тела, чаще возникает в ночное время, боли за грудиной появляются и усиливаются при гори зонтальном положении. При наклоне туловища вперед боли часто сопровождаются регургитацией желудочного содержимого («симптом шнурка»). У больных с грыжами пищеводного отверстия диафрагмы нередко возникает рефлекторная стенокардия. Боли могут локализовываться также в подложечной и межлопаточной областях. Тяжелый рефлюкс-эзофагит часто сопровождается дисфагией. Нередко при грыжах пищеводного отверстия диа фрагмы возникает кровотечение, обычно незначительное.
Основным методом диагностики грыж пищеводного отверстия диафрагмы является рентгенологическое исследование. Рентгенологические симптомы опреде ляются типом грыжи. При аксиальной грыже в грудную полость смещен весь желудочно-пищеводный переход, и часть желудка пролабирует в заднее средостение. Кардия находится наддиафрагмой. В случае параэзофагеальной грыжи пищеводно-желудочный переход рас полагается в брюшной полости, а часть желудка выхо дит через пищеводное отверстие диафрагмы в грудную полость рядом с пищеводом. Большие грыжи распоз наются сравнительно легко, для выявления небольших грыж необходимо исследование как в вертикальном, так и в горизонтальном положении больного, а также в положении Тренделенбурга. Рентгенологическое иссле дование играет важную роль в распознавании осложне ний хиатальной грыжи и прежде всего рефлюкс-эзофа-
гита. Эндоскопическое исследование является весьма важным, позволяет выявить симптомы недостаточности кардии, оценить тяжесть эзофагита, выявить осложне ния и сопутствующие заболевания. Ценным функцио нальным методом диагностики скользящих грыж пище водного отверстия диафрагмы является эзофагоманометрия, позволяющая определить зону повышенного давления в области пищеводно-желудочного перехода, смещенного выше уровня диафрагмы.
Лечение аксиальных грыж пищеводного отверстия диафрагмы необходимо начинать с консервативных мероприятий. При сформировавшейся пептической стриктуре на фоне проводимых мероприятий выполня ют бужирование пищевода, чаще всего в качестве пред операционной подготовки. Оперативное вмешательство необходимо проводить при осложненных формах и без успешности предшествующих медикаментозных мероп риятий. Наиболее целесообразной операцией является фундопликация по Ниссену в различных модификаци ях. При протяженных стриктурах выполняют резекцию пищевода. Параэзофагеальные грыжи подлежат опера тивному вмешательству в связи с опасностью тяжелых осложнений. Производят низведение грыжевого содер жимого в брюшную полость, крурорафию. Операцию завершают фундопликацией.
Основной используемый доступ при видеоэндохирургическом лечении грыж пищеводного отверстия диафрагмы — лапароскопический. Левую долю печени отводят ретрактором. Разделяют печеночно-желудоч- ную порцию сальника, рассекают брюшину, покрываю щую абдоминальный отдел пищевода, низводят грыже вое содержимое в брюшную полость, производят выде ление правой стенки пищевода. Затем, при отведении пищевода вправо, выделяют левую стенку пищевода. Ретроэзофагеальную клетчатку тупо разделяют при тракции пищевода кпереди и влево. После создания окна ножки диафрагмы сводят отдельными узловыми швами из нерассасывающего материала на атравматической игле с предварительно введенным в желудок толстым зондом. Затем выполняют мобилизацию дна желудка и верхней части большой кривизны для фундопликации. Короткие желудочные артерии в этой облас ти клипируют и пересекают. После мобилизации дна желудка производят непосредственно фундопликацию. Стенку желудка захватывают введенным позади пище вода зажимом и протягивают слева направо вперед, образуя циркулярную манжетку. Задний лоскут подши вают 2—3 узловыми швами к дну желудка, выведенному спереди от пищевода с обязательным захватыванием в шов стенки пищевода для предотвращения соскальзы вания созданной манжетки (рис. 12).
363

Торакальная хирургия
стриктурах) дугу непарной вены необходимо пересекать после предварительной интракорпоральной перевязки и наложения двух рядов титановых скрепок, для этой цели может быть использован также линейный сшивающий аппарат. При торакоскопическом выделении пищевода обычно не отмечается массивных кровотечений.
Рис. 12. Видеолапароскопическая фундопликация |
|
Видеоэндохирургические экстирпации |
Рис. 13. Торакоскопическая экстирпация пищевода |
и резекции пищевода |
|
Показанием к выполнению торакоскопической экс тирпации пищевода являются рак, рубцовые стрикту ры пищевода, ахалазия кардии и кардиоспазм IV ст.
Операцию производят из правостороннего торакоскопического доступа в положении больного на левом боку под эндотрахеальным наркозом с раздельной интубацией бронхов.
После введения троакаров рассекают легочно-диа- фрагмальную связку в режиме электрокоагуляции, легкое высвобождают из спаек и отводят кпереди. Сначала рассе кают медиастинальную плевру над нижней третью пище вода вверх до дуги непарной вены, а затем выше. Стенку пищевода захватывают зажимом Бэбкокка и, выполняя тракцию пищевода вправо и влево, мобилизуют его на всем протяжении, освобождая от фасциальных отрогов спереди и сзади (рис. 13). Выделение пищевода при раке обязательно производится с удалением средостенных лимфатических узлов в объеме F2. После мобилизации выше и ниже дуги непарной вены пищевод захватывают ниже дуги и, осуществляя тракцию в кранио-каудальном направлении, рассекают фасциальные отроги, соединяю щие дугу непарной вены и пищевод. Выделение пищевода в месте пересечения его дугой непарной вены является наиболее ответственным этапом операции. В ряде случа ев (при расположении опухоли в средней трети грудного отдела пищевода, наличии хронического склерозирующе-
го медиастинита вследствие периэзофагита при Рубцовых
Затем больного укладывают на спину, выполняют верхне-срединную лапаротомию. При раке пищевода производят лимфаденэктомию, идентичную лимфаденэктомии, выполняемой при раке кардиального отдела желудка. Выкраивают трансплантат из большой кривиз ны желудка и отсекают пищевод от желудка (при раке пищевода производится также удаление кардиального отдела и дна желудка). Пищевод удаляют через разрез на шее по переднему краю левой грудино-ключично-сосце- видной мышцы. Выкроенный трансплантат из большой кривизны желудка помещают в заднее средостение и выводят на шею, где соединяют с шейным отделом пище вода анастомозом «конец в конец» двухрядным швом. Плевральную полость дренируют в VII—VIII межреберье, обязательно производят дренирование брюшной полости и шейной раны. Операционные раны ушивают.
Торакоскопическая резекция пищевода. Обычно резекцию пищевода производят несколько ниже дуги непарной вены. Показаниями к выполнению данной опера ции являются рак желудка с переходом на пищевод и огра ниченные рубцовые стриктуры нижней трети пищевода.
Оперативное вмешательство производят из право стороннего торакоскопического доступа. Рассекают легочную связку, легкое отводят кпереди, визуализи руют пищевод и рассекают медиастинальную плевру от диафрагмы до дуги непарной вены. Стенку пищевода захватывают зажимом и, осуществляя тракции в раз-
364

Видеоэидоскопическая хирургия пищевода
ные стороны, освобождают пищевод со всех сторон в режиме монополярной и биполярной коагуляции. Электрохирургическими ножницами пересекают пище вод. В оставшуюся часть пищевода вводят головку циркулярного сшивающего аппарата диаметром 21 или 25 мм, накладывают и затягивают кисетный шов.
Бригада хирургов, оперирующая в брюшной полости, выделяет абдоминальный отдел пищевода и подготавли вает желудок или тонкую кишку (в зависимости от объема вмешательства) к наложению анастомоза. Рабочую часть степлера вводят в просвет желудка или тонкой кишки через отдельный разрез и соединяют с головкой аппарата в заднем средостении под торакоскопическим контро лем (рис. 14). Наложение анастомоза является наибо лее ответственным этапом операции. Отдельный разрез желудка или кишки ушивают. Ниже анастомоза желудок (тонкую кишку) фиксируют отдельными узловыми швами к диафрагме. Плевральную полость дренируют.
Рис. 14. Видеоторакоскопическая резекция пищевода
Послеоперационное ведение больных
При видеоэндохирургическом лечении доброка чественных заболеваний пищевода пациенты могут подниматься с постели вечером в день операции или на следующий день. После резекций и экстирпаций пищевода больные нуждаются в пребывании в палате интенсивной терапии.
В послеоперационном периоде сохраняется введен ный во время операции назогастральный зонд, обес печивающий декомпрессию и позволяющий проводить энтеральное питание.
Кормление пациентов per os возможно на вторыетретьи сутки, а при наложении швов на стенку пищево
да — с 5—7-х суток после операции (предварительно выполняют контрольную рентгенографию пищевода с контрастом). До начала питания пациенты нужда ются в комплексной терапии, направленной на кор рекцию водно-электролитных, белковых нарушений. Антибактериальная терапия целесообразна после экс тирпаций и резекций пищевода, а также после опера ций, сопровождающихся вскрытием просвета пищево да. В послеоперационном периоде применение нарко тических анальгетиков требуется обычно только после резекций и экстирпаций пищевода.
Конверсия в эндохирургии пищевода
При выполнении эндохирургических операций иног да хирургам приходится отказываться от эндохирургического метода и переходить к открытому, традицион ному. Этот переход получил название «конверсия».
Показаниями к конверсии являются:
•невозможность выполнения эндоскопической операции в связи с распространенностью патоло гического процесса или сложностями анатомичес ких взаимоотношений органов;
•осложнения, возникшие во время эндоскопичес кой операции, которые невозможно исправить при помощи эндохирургической техники;
•безуспешность развития операции в течение 30— 40 минут;
•технические неполадки аппаратуры, возникшие во время операции.
Успех видеоэндохирургического лечения больных с заболеваниями пищевода зависит от четкого соблюде ния показаний и противопоказаний и своевременного перехода к открытым операциям.
Перспективы развития видеоэндохирургии пищевода
Внедрение видеоэндоскопической техники в хирур гию пищевода открывает новые горизонты в лечении больных этой сложной и разнообразной патологией. И если при лечении пациентов с доброкачественными заболеваниями пищевода видеоэндохирургия во многих случаях является операцией выбора, то при резекциях
иэкстирпациях пищевода остается еще много сложных
ипорой трудноразрешимых проблем. Решению этих задач будет способствовать создание более совершен ных инструментов и сшивающих аппаратов.
При выполнении видеоэндохирургических операций хирург лишен возможности пальпировать ткани. С этой задачей успешно могли бы справиться миниатюрные
365
Торакальная хирургия
гибкие ультразвуковые датчики, которые позволят диф ференцировать нормальные и патологические ткани. Внедрение сшивающих аппаратов с изменяющейся гео метрией рабочей части значительно облегчит выпол нение резекций пищевода и наложение анастомозов в труднодоступных зонах. Разработка и внедрение робо тов и компьютеров сделают видеоэндохирургические операции на пищеводе менее травматичными и опасными и более доступными для хирургов, занимающихся про блемой лечения больных с заболеваниями пищевода.
Литература
1.Балалыкин А.С. Эндоскопическая абдоминальная хирургия. М., 1996, 144 с.
2.Емельянов СИ., Матвеев Н.Л., Феденко В. В. Лапароско пическая хирургия желудка. М., 2002,164 с.
3.Ивашкин В.Т., Трухманов А.С. Болезни пищевода. М., 2000, 184 с.
4.Кубышкин В. А., Корняк Б. С. Гастроэзофагеальная рефлю сная болезнь. М., 1999,190 с.
5.Федоров И.В., Сигал Е.И., Одинцов В.В. Эндоскопическая хирургия. М., 1998, 352 с.
6.Черноусое А.Ф., Богопольский П.М., Курбанов Ф.С. Хирурги пищевода. М., 2000, 352 с.
7.Cuschieri A., Shimi S., Banting S. Endoscopic oesophagectomv through a right thoracoscopic approach. J. R. Coil. Edinb. 1992 v. 37, p. 7—11.
8.Dallemagne В., Weerts J.M., Jeahes C, Marciewicz S., Lombard R. Laparoscopic Nissen fundoplication: preliminary report Surg. Laparosc. Endosc. 1991, № 1, p. 138—143.
9.Pellegrini C.A., Wetter L.A., Patti M., Leichter R., Mussan G. Mori I., Bernstein G., Way L. Thoracoscopic esophagomyotomy: initial experience with a new approach for the treatment of achalasia. Ann. Surg. 1992, v. 216, p. 291—296.
10.Shimi S., Nathanson L.K., Cuschieri A. Laparoscopic cardiomyotomy for achalasia. J. R. Coll Edinb. 1991, v. 36, p. Ш—• 154.
366
Диагностика и лечение дисфагии
Ю.А. Пархисвнио, В.В. Булынин
В понятие синдрома дисфагии включен комплекс патологических симптомов, возникающих при наруше нии функции пищевода и кардии, вызванных различны ми заболеваниями верхних отделов пищеварительного тракта. К этим симптомам относятся: нарушение пасса жа пищи, болевые ощущения, изжога, срыгивание.
Следующие заболевания вызывают синдром дис фагии:
• рак пищевода и кардии; ш химический ожог пищевода и вызванная им стрик
тура пищевода;
•ахалазия кардии и кардиоспазм;
•пептический стеноз пищевода на фоне гастроэзофагеальной рефлюксной болезни (ГЭРБ);
•инородные тела пищевода;
щ дивертикулы пищевода;
•стриктуры пищеводно-желудочных и пищеводнокишечных анастомозов;
•редкие причины.
Диагностика
Диагностика заболеваний, вызывающих синдром дисфагии, сложна, особенно на ранних этапах разви тия болезни, она требует определенных навыков от врача, а также современного оснащения лечебного учреждения.
Рентгенологическое исследование в настоящее время остается основным ориентировочным методом диагностики патологии пищевода. При различных пово ротах больного вокруг вертикальной оси контраст ное рентгенологическое исследование производится с водной взвесью бария сульфата, а при подозрении на перфорацию— с водорастворимым контрастом. Контрастное рентгеновское исследование позволяет определить характер контуров, перистальтику, рельеф слизистой оболочки, функцию пищеводного и желу дочного сфинктеров. Исследование больного в гори зонтальном положении с приподнятым ножным концом рентгеновского стола (положение Тренделенбурга) поз воляет выявить нарушение функции нижнего сфинк тера пищевода, дислокацию органов. Основным мето дом обследования пациентов с перфорацией пищевода служит рентгенография с использованием различных контрастных веществ.
Компьютерная томография дает возможность определить топографию опухоли пищевода, толщину его стенок, распространение и прорастание опухоли в окружающие анатомические структуры, выявить мета стазы в лимфатические узлы.
Фиброэзофагоскопия позволяет осмотреть сли зистую оболочку пищевода на всем его протяжении, произвести прицельную биопсию из подозрительных участков (с гистологическим исследованием), сделать мазки для цитологического исследования. Наиболее доступными методами диагностики протяженности и степени выраженности химического ожога слизистых пищевода, желудка, а в ряде случаев тонкой кишки, являются ФЭГДС и рентгенологические методы исследо вания. Тем не менее они не дают исчерпывающей объ ективной оценки глубины патологических изменений в перечисленных органах.
Ультрасонография — наиболее информативное и перспективное исследование, позволяющее установить глубину поражения стенки пищевода при химическом ожоге, глубину инвазии опухоли и тем самым опреде лить дальнейшую лечебную тактику в каждом конкрет ном случае. Ультразвуковое исследование (УЗИ) органов брюшной полости используется для выявления метаста тического поражения печени, лимфатических узлов при раке кардии и пищевода. Дополненное пункционной биопсией, оно с большой достоверностью позволяет определить характер округлых образований печени и других органов живота. Эти исследования очень часто являются последней точкой в решении хирурга о прове дении оперативного лечения или отказе от него.
РН-метрия — определение интенсивности желу- дочно-пищеводного рефлюкса с помощью специального зонда, установленного в пищеводе, позволяет фикси ровать изменение рН пищевода при желудочно-пище- водном рефлюксе. Ионометрическое исследование желудочно-пищеводного перехода, дополненное манометрией, наиболее информативно при заболеваниях, сопровождающихся функциональными нарушениями кардии. К ним относятся: скользящая хиатальная грыжа, изолированная недостаточность кардии, ахалазия кар дии, диффузный спазм пищевода, рефлюкс-эзофагит, склеродермия пищевода. Особенно ценную информа цию дает суточное рН-мониторирование. Это иссле дование в комплексе с другими исследованиями (ФГС,
367
Торакальная хирургия
рентгенологическое исследование) позволяет выявить причину эзофагита и определить тактику лечения.
ФГС-скрининг ГЭРБ и пищевода Баррета. Метод сочетает в себе свойства, присущие контрастной рен тгенографии пищевода (позволяет определить высоту заброса желудочного содержимого в пищевод), хро матографии пищевода (определить участки пищевода Баррета) и обычной ФГДС (осмотреть пищевод, желу док, взять прицельную биопсию из измененных учас тков пищевода). Данный метод заключается в следу ющем: больному натощак проводят фиброгастроскоп в желудок, после чего через инструментальный канал фиброгастроскопа вводят зонд, через который в полость желудка инъецируют 10 мл спиртового 1% раствора метиленового синего, разведенного в 30—40 мл физио логического раствора и извлекают фиброгастроскоп вместе с зондом. Больному предлагают совершить ряд проб, провоцирующих рефлюкс: согнуть и приподнять ноги в лежачем положении, вызвать кашель, наклонить туловище вперед, присесть и т.д. Спустя 10—15 минут больному проводят фиброэзофагоскопию. Раствор мети ленового синего забрасывается в пищевод и прокраши вает его, причем эрозированные участки окрашиваются несколько интенсивнее по сравнению с неизмененной слизистой. В зависимости от выраженности недостаточ ности кардиального сфинктера пищевода, раствор мети ленового синего прокрашивает слизистую пищевода от кардиального отдела вплоть до средней и верхней трети его. Метиленовый синий плохо проникает в клетки сли зистой неизмененного пищевода, одновременно окраши вая клетки кишечного эпителия (пищевод Баррета).
Этот метод позволяет быстро и эффективно опре делить интенсивность гастроэзофагеального рефлюкса, который является пусковым фактором развития пептического эзофагита. Предлагаемой методикой можно пользоваться в любых учреждениях, имеющих фиброгастроскоп и врача эндоскописта, она не требует значительных дополнительных материальных затрат, что позволяет ее широко применять в медицинской практике. Применение этого простого способа опре деления желудочно-пищеводного рефлюкса позволяет более активно выявлять пациентов с гастроэзофагеальной рефлюксной болезнью и в ранних стадиях забо левания провести соответствующее дообследование и лечение.
Рак пищевода и кардии
Среди злокачественных заболеваний рак пищевода в нашей стране — шестое по частоте заболевание, встречающееся чаще у мужчин в возрасте 50—60 лет.
Рак составляет 60—80% всех заболеваний пищевода. Большое значение в развитии рака пищевода и кардии имеет хроническое воспаление слизистой оболочки пищевода. До 96% из заболевших раком нижней трети пищевода и кардии в анамнезе имели различной степе ни выраженности эзофагит. Обследование пациентов с онкологической патологией пищевода подчинено сле дующему алгоритму:
•клинические и биохимические исследования крови;
шрентгенография грудной клетки;
•контрастная рентгенография пищевода и желудка;
. ФГЭС;
шУЗИ органов брюшной полости;
•РКТ и ЯМРТ исследования;
•лапароскопия;
•бронхоскопия.
Следует отметить, что проведение бронхоскопии при раке верхней и средней трети необходимо для исключе ния прорастания опухоли в трахею. Лапароскопия играет важную роль в определении тактики лечения пациентов с опухолью средней трети, нижней трети и кардии, отка заться от нее можно только в тех случаях, когда имеется необходимость гастростомии или энтеростомии.
Различают три основные формы рака пищевода:
•экзофитный (узловой, грибовидный, папиломатозный);
•эндофитный (язвенный);
•инфильтративный склерозирующий (циркулярная форма), встречаются смешанные формы.
Распространение рака происходит за счет лимфогенного, гематогенного метастазирования, а также за счет прорастания опухоли в окружающие органы и ткани. По лимфатическим путям возможно распростра нение метастаза опухоли на несколько сантиметров от основной опухоли при макроскопически неизмененных тканях пищевода.
Клиническая картина и диагностика. Основными симптомами рака пищевода являются: ощущение дис комфорта за грудиной при проглатывании пищи, дисфагия, боль за грудиной, гиперсаливация, похудание. Начало заболевания бессимптомное (доклиническая фаза). Этот период может длиться 1—2 года. Когда опухоль достигает значительных размеров и начинает суживать пищевод, появляются первые признаки нару шения пассажа пищи, перерастающие в выраженную дисфагию. Дисфагия встречается у 70—85% больных
ипо существу является поздним симптомом, возникаю щим при сужении просвета пищевода опухолью на 2/3
иболее. Для рака характерно прогрессирующее нарас тание дисфагии.
368
Диагностика и лечение дисфагии
Оперативное лечение. В настоящее время при опе ративном лечении рака пищевода и кардии чаще при меняются одномоментные варианты лечения, операция Добромыслова—Торека выполняется крайне редко. Выбор доступа и способа оперативного лечения должен производиться индивидуально, в зависимости от лока лизации и распространенности опухолевого процесса. Удаление опухоли верхней трети пищевода с его одно временной пластикой осуществляется из трех доступов: цервикотомия слева, торакотомия справа, лапаротомия. Для пластики возможно использование желудочной труб ки из большой кривизны желудка, толстой, тонкой кишки, в том числе трансплантация кишки на шею с использо ванием микрохирургической техники. При раке средней трети пищевода возможна пластика пищевода желудком из торакотомного справа и лапаротомного доступов, иногда выделение пищевода и лимфодиссекция произ водятся с помощью видеоторакоскопической техники без торакотомии. Используется пластика желудочной трубкой из большой кривизны желудка с формировани ем желудочно-пищеводного анастомоза на шее из трех доступов. При раке нижней трети пищевода произво дятся операции типа Льюиса с наложением анастомоза в грудной клетке выше непарной вены или пластика желу дочной трубкой из большой кривизны желудка с форми рованием желудочно-пищеводного анастомоза на шее из трех доступов. Возможна лимфодиссекция лапаротомным трансдиафрагмальным доступом с использованием видеоторакоскопической техники. Часто для выполне ния проксимальной резекции желудка и гастрэктомии с резекцией нижней трети пищевода используется торако- лапаро-френотомия. Этот доступ позволяет произвести пластику пищевода и желудка при опухоли кардиального отдела желудка. Чисто абдоминальный доступ при раке кардиального отдела желудка должен быть ограничен из-за большой частоты продолженного роста опухоли в зоне анастомоза. При выполнении пластики пищевода необходимо интраоперационное исследование линии резекции. Тщательная лимфодиссекция, объем которой зависит от расположения опухоли пищевода, является неотъемлемой частью оперативного вмешательства по поводу рака пищевода и кардии.
Химические ожоги пищевода
Тяжесть повреждения стенки пищевода и выражен ность резорбтивного действия определяются как хими ческой природой принятого вещества, его концентра цией, консистенцией, количеством, так и длительностью
контакта реагента со стенкой пищеварительного тракта, наполнением пищей желудка, а также общим состояни ем организма пострадавшего. Все это в итоге дает ту или иную клиническую картину ожога пищевода, и оп ределяет исход заболевания.
Среди веществ, обладающих прижигающим (коррозивным) действием, выделяют следующие группы:
•едкие кислоты и кислотоподобные вещества (органические— уксусная кислота, и минераль ные — серная, соляная, азотная и др.);
•едкие щелочи и щелочеподобные вещества (каус тическая сода, едкое кали, нашатырный спирт, силикатный клей и др.);
•окислители (пергидроль, перманганат калия и др.); ш прочие (соли тяжелых металлов, йодная настой
ка и др.).
Повреждающее действие едких щелочей обусловле но наличием в них гидроксильных ионов, которые при контакте с тканями вызывают омыление жиров и разру шение белков с образованием щелочных альбуминатов. Под воздействием щелочи ткани теряют свою струк туру, разжижаются, представляя собой студенистую массу (колликвационный некроз, «мягкое омертвение»), слабо препятствующую дальнейшему проникновению в глубину и разрушительному действию еще свободных гидроксильных ионов щелочи. Струп образуется мягкий и рыхлый, легко травмирующийся, что нередко вызыва ет обильные кровотечения. В зависимости от глубины поражения тканей различают степени:
•легкая — оказываются поврежденными только поверхностные слои эпителия на большем или меньшем участке пищевода;
•средняя — характерны более глубокие изме нения. Развиваются некрозы, которые местами распространяются на всю глубину слизистой обо лочки пищевода;
•тяжелая — некроз захватывает слизистую обо лочку, подслизистый и мышечный слои пищевода.
Полость рта, глотки, различные отделы пищевода и желудка поражаются в неодинаковой степени, при этом в пищеводе одновременно могут быть участки ожога 1-й, 2-й и 3-й степеней. Ряд авторов при распространении некроза на параэзофагеальную клетчатку, плевру и другие прилегающие к пищеводу органы дополнительно выделя
ют 4-ю (крайне тяжелую) степень ожога пищевода.
Воспаление и репаративный процесс стенки пище вода после химической травмы в целом подчиняются общим закономерностям течения раневого процесса. Различают следующие фазы (стадии) морфологических изменений в стенке пищевода после ожога:
ш альтерация — повреждение тканей (первые часы);
369
Торакальная хирургия
•острые воспалительные проявления (первые 2— 10 суток);
•отторжение некротических масс и образование изъязвлений (7—18-е сутки);
•грануляции (10—30-е сутки);
•рубцевание (1 месяц и более).
При этом следует учесть, что течение воспалитель ного и репаративного процессов в стенке пищевода после ожога имеет ряд особенностей, обусловленных степенью тяжести и обширностью повреждения, вли янием агрессивной микрофлоры пищевода, а также состоянием общего и местного иммунного статуса орга низма. По патологоанатомическим изменениям, завися щим от времени, прошедшего с момента ожога пищево да, условно выделяют четыре стадии:
1)гиперемия, отек слизистой оболочки;
2)некроз и изъязвления;
3)образование грануляций;
4)эпителизация или рубцевание.
Диагноз — ожог пищевода — не вызывает сомнения сразу после сбора анамнеза, выраженность поврежде ний пищевода уточняется при ФГЭС и рентгенографии.
Лечение ожога пищевода. В настоящее время накоплен значительный опыт лечения больных с хими ческим ожогом пищевода. Комплекс мероприятий на госпитальном этапе проводится токсикологами и реани матологами адекватно степени тяжести ожога и общего состояния пациента:
•зондовое промывание желудка;
•обезболивание;
•инфузионно-трансфузионная терапия;
•профилактика гнойно-септических осложнений;
•спазмолитики;
•питание и общеукрепляющая терапия. Осложнения. В остром периоде ожога могут раз
виться тяжелые осложнения: шок, коллапс, дыхатель ная недостаточность, пищеводно-желудочное кровоте чение, пищеводно-респираторный свищ, а также пер форация пищевода и желудка с развитием гнойного медиастинита и перитонита.
Способы профилактики рубцового стеноза пище вода после ожога. Среди пациентов с химическим ожогом пищевода тяжелой степени формирование руб цового сужения пищевода отмечается в 15—70% случа ев. На наш взгляд, целесообразно рассмотреть способы профилактики рубцового стеноза пищевода после хими ческого ожога не по принадлежности к тому или иному фармакологическому классу, а по преобладающему механизму предупреждения формирования сужения.
Механическое воздействие на стенку пищевода. Цель ранней (профилактической) дилатации пищевода,
в отличие от поздней (лечебной), растягивающей и раз рывающей рубец, состоит в направленном пространс твенном моделировании роста соединительной ткани, замещающей дефект стенки пищевода таким образом, чтобы образующийся рубец стенки пищевода не вызывал сужение просвета органа.
Бужирование и баллонирование — периодичес кое антеградное или ретроградное введение в просвет пищевода зонда, бужа или эндоскопа (бужирование) или раздувание воздухом или жидкостью баллона, вве денного в просвет пищевода (баллонирование) с целью формирования созревающей соединительной ткани в виде муфты заданного диаметра.
Воздействие на воспалительно-репаративный процесс. Течение воспалительно-репаративного про цесса в стенке пищевода после химического ожога зависит от интенсивности лейкоцитарной инфиль трации, агрессивности присоединившейся инфекции, состояния трофики окружающих тканей и организма в целом, сроков отторжения некротизированных тканей, скорости и выраженности гранулирования, рубцевания
иэпителизации ожоговой поверхности.
Сцелью подавления воспалительной реакции пре дложено большое число препаратов. Отдельного вни мания заслуживает вопрос использования эндокринных препаратов коры надпочечников. Клеевые аппликации (МК-8 и др.) ускоряют отделение некротических тка ней. Это обусловлено стойким соединением препарата
сбелками слизи, образованием влагонепроницаемой пленки. Представляется интересным местное использо вание лазерного облучения мощностью 10—150 мВт/смг. Лазерная энергия путем ионизации разрушает слабые электрохимические связи в коллоиде обратимо, в связи
счем предложено после облучения проводить ороше ние поверхности раствором индигокармина, закрепля ющим ионизационное состояние. Это приводит к уско рению отторжения, улучшению условий дренирования ожоговой поверхности. С целью профилактики стено за пищевода предложено применять гипербарическую оксигенацию.
Ферменты (лидаза, ронидаза и другие), содержа щие гиалуронидазу, вызывают распад гиалуроновой кислоты, являющейся основным «цементирующим» веществом соединительной ткани, и тем самым умень шают ее вязкость. Это увеличивает проницаемость тканей, облегчает движение жидкости в межтканевых пространствах, тормозит развитие рубца, способствуя размягчению и частичному рассасыванию уже образо вавшейся рубцовой ткани.
Однако действие гиалуронидазы носит обратимый характер, и при уменьшении ее концентрации вя.жость
370
