
хирургия 5 курс / книги / Savel'ev V.S. (red.) 80 lekcij po hirurgii (Litterra, 2008)(ru)(T)(K)(910s)(ISBN 9785982161190)
.pdf
Трансплантация печени: клинические и хирургические аспекты
является проведение порто-бедренно-аксиллярного шунтирования, при котором забираемая отдельно из портального бассейна (2) и отдельно из бассейна нижней полой вены (1—3) кровь с помощью специ ального центрифужного насоса (5) принудительно вливается в систему верхней полой вены (4) через левую аксиллярную вену (рис. 2). Однако проведение вено-венозного шунтирования у реципиентов с мас сой тела менее 20 кг весьма затруднено и в настоящее время не используется. С учетом накопления хирур гического и анестезиологического опыта при ОТП,
атакже в связи с организационными, техническими
ифинансовыми проблемами, присущими использо ванию вено-венозного шунтирования, в ряде транс плантационных центров наблюдается тенденция к
Рис. 2. Схема порто-бедреино-аксилляриого шунтирования » беспеченочиом периоде: 1 — нижняя полая вена; 2 — каню ля в воротной вене; 3 — канюля в левой подвздошной вене; 4 — канюля в левой подмышечной вене; 5 — центрифужный насос
постепенному отказу от его проведения не только у детей, но и у взрослых.
Завершающим этапом гепатэктомии, выполняемой по любой методике, являются контроль гемостаза и подготовка поддиафрагмальной культи нижней полой вены реципиента для анастомоза с нижней полой веной трансплантата либо подготовка сохраненной нижней полой вены реципиента, заключающаяся в ушивании мелких отверстий в ее стенке после удаления печени.
Имплантация донорской печени
Результат ортотопической трансплантации печени в значительной степени зависит от того, насколько хирур гу удастся воссоздать естественные условия, приемле мые для функционирования трансплантата в организме реципиента. В связи с этим методика имплантации варь ирует в зависимости от разновидности используемого трансплантата. Такими разновидностями являются:
•трупная печень (целая);
•«уменьшенная»трупная печень;
•анатомические доли или левый латеральный сек тор трупной печени после разделения одного трансплантата для двух реципиентов;
•анатомические доли или левый латеральный сек
тор печени живого родственного донора. Методика имплантации целой трупной печени являет
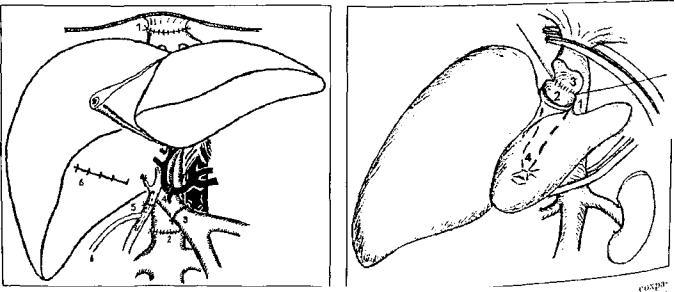
ся основой для всех других модификаций. Трансплантат ортотопически располагают в брюшной полости. Первым накладывается верхний (поддиафрагмальный) анасто моз между культей нижней полой вены реципиента и донорским фрагментом того же сосуда. Он представляет наибольшие трудности в связи с ограничением возмож ности манипулирования и обзора в этой области. Затем накладывается нижний (подпеченочный) кава-каваль- ный анастомоз. При этом восстанавливается непрерыв ность нижней полой вены. В случае использования вено-венозного шунтирования канюлю из воротной вены реципиента извлекают и воротную вену пережимают сосудистым зажимом. Анастомоз между воротной веной реципиента и воротной веной трансплантата накладыва ется «конец в конец» с учетом возможного несовпадения диаметров этих сосудов, что корригируется различными вариантами сосудистого шва.
Наложение трех описанных анастомозов обеспечива ет возможность возобновления портального и кавального кровотоков. Анестезиологическая бригада должна быть заранее информирована о пуске портального кровотока через трансплантат, чтобы своевременно корригировать
\
441
Абдоминальная хирургия
гемодинамические изменения и нарушения гомеостаза. Реперфузии трансплантата должно предшествовать внутривенное введение метил-преднизолона из расчета 20 мг/кг массы тела реципиента (но не более 1000 мг). Для реперфузии трансплантата первым снимают зажим с надпеченочного участка нижней полой вены, а затем с воротной вены. Последним снимается зажим с подпеченочного отдела нижней полой вены, что восстанавливает кавальный кровоток (рис. 3).
Методика венозной реконструкции при имплан тации «уменьшенной» печени, равно как и правой доли от разделенной печени трупа, и последова тельность действий идентичны описанным выше. Разновидностью методики кавальной реконструкции при использовании этих трех видов трансплантатов является наложение единственного кава-кавального анастомоза. Это бывает возможно в случаях, когда гепатэктомия у реципиента выполняется с сохране нием позадипеченочного фрагмента нижней полой вены. Для осуществления методики надпеченочное отверстие нижней полой вены трансплантата анастомозируется с отверстием в передней стенке нижней полой вены реципиента, образованным при иссече нии устьев печеночных вен. При этом дистальный отдел нижней полой вены трансплантата просто перевязывается (рис. 4).
Венозная реконструкция при использовании i |
К а честв е |
трансплантата левой доли или левого латерально |
|
ра трупной печени, а также анатомических долей |
го секто- |
левого |
|
латерального сектора печени живого родственног "°иГ' |
|
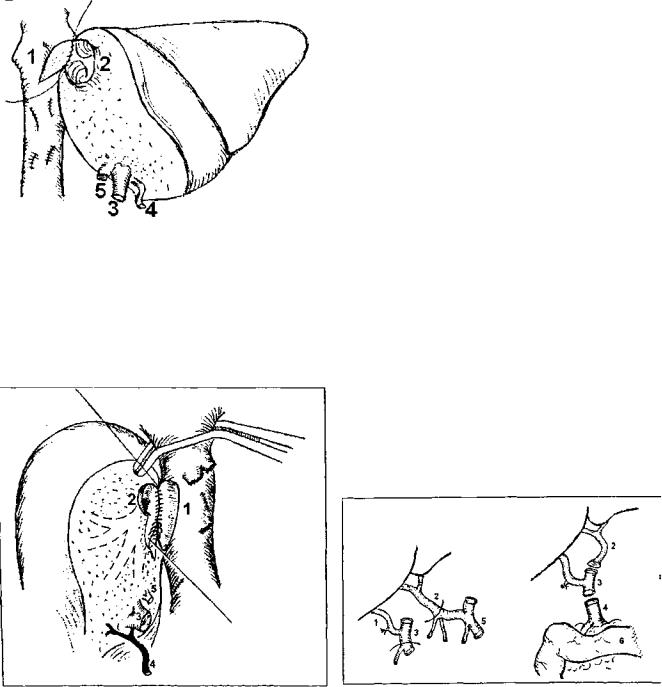
имеет ряд особенностей. Во всех указанных случа^ 0 ^ гепатэктомии у реципиента необходимо сохранит ** П Р И дипеченочный отдел его нижней полой вены о П°3а" ОТ предыдущих видов донорской печени, трансплант данной группы не имеют собственного донорского ч^Ы тка нижней полой вены. Поэтому восстановление вен^' ного оттока выполняется путем соединения печеночн " вены трансплантата с нижней полой веной реципиент в виде печеночно-кавального анастомоза «конец в бок или в виде печеночно-печеночного анастомоза «конец в конец» с культей одноименной печеночной вены реципи ента. Основной задачей при этом является профилактика нарушения венозного оттока при возможных смещениях трансплантата в брюшной полости. В связи с этим предпоч тительным является печеночно-кавальная реконструкция конец-в-бок (рис. 5). В этой связи заслуживает внимания методика имплантации правой доли печени от живого родственного донора, разработанная и применяемая в РНЦХ РАМН с 1997 года. Суть методики — в создании как можно более широкого печеночно-кавального анастомоза, что достигается искусственным расширением устьев пра вых печеночных вен трансплантата и реципиента (рис. 6).
\>нс. 3. Окончательный вид имплантированной трупной пече ни: 1 ~ верхний (ноддиафра! мальный) кава-кавальный анас томоз; 2 — нижний (иоднеченочный) кава-кавалышн анас томоз; .'j - норто-иорталыгый анастомоз; 4 — артериальная реконструкция с использованием общей печеночной артерии реципиента; 5 -•• билиарная реконструкция холсдохо-холедо- хоанапомоз на Т-образном дренаже; 6 — ушитое ложе желч ного пузыря
-— |
|
' ~" |
%, |
i ,...( при |
en'I ыч |
|
|||||
Рис. Л. Вариант имплантации трупной |
^ ^ t-oNpiin |
„ с и т * |
|||
нении нижней полой вены Рс и "м "°"( 'V1 ! 0 l ,i,i pi'11 "" |
Ч'.-"| с " |
||||
иозадипечепочпый отдел нижней ш - ^ | 1 ( ) Л ( ) М „ены |
ПО'»"1 |
||||
2 - надпеченочное отверстие " " * ! " щ м н ! * 1 1 1 ' 1 ' 1 |
„4i»J -4 |
||||
илантата; 3 - отверстие в 1,с Гк 'лИ1 '1 | ')| "у1 'т ',,ев И'"10" |
ГР»'"" |
||||
вены реципиента |
после иссечен! |
• |
,„ цены |
||
пен; 4 — дистальный отде , н п > м " ' " |
' |
|
|
||
илантата |
|
|
|
|
|
442
Трансплантация печени: клинические и хирургические аспекты
Рис. 5. Псченочно-кавальиая реконструкция при имплан тации левой доли печени: 1 — нижняя полая вена реципиен та после гепатэктомни: отверстие в передне-левой боковой стенке анастомознруется с устьем общего ствола левой и срединной печеночных вен трансплантата; 2 — устье общего ствола левой и срединной печеночных вен трансплантата, 3 — воротная вена трансплантата; 4 — артерия трансплантата: 5 — желчный проток трансплантата
Рис. 6. Печеночно-кавальная реконструкция при импланта ции правой доли печени от живого родственного донора по методике РИЦХ РАМН: 1 — нижняя полая вена реципиента после гепатэктомни: искусственно сформированное отверс тие в стенке нижней полой вены после иссечения устья пра вой печеночной вены; 2 — устье печеночной вены трансплан тата увеличено па счет рассечения боковой стенки сосуда в дистальном направлении; 3 — воротная вена трансплантата, 4 — артерия трансплантата; 5 — желчный проток трансплан тата
Особенностью портальной реконструкции при использовании указанных трансплантатов является то, что порто-портальный анастомоз накладывают между стволом воротной вены реципиента и воротной веной трансплантата, которая является долевой (правой или левой) ветвью воротной вены донора.
Возможности артериальной реконструкции, то есть воссоздания артериального притока к трансплантату, также зависят от вида используемого трансплантата. Так, все виды трупных трансплантатов, кроме левой доли и левого латерального сектора, при соблюдении правил изъятия донорской печени располагают неограниченной длиной артериального сосуда вплоть до фрагмента аорты. В то же время родственные трансплантаты и левые фраг менты трупной печени, как правило, имеют только доле вую артерию, длина которой не превышает 3—4 см.
Артериальная реконструкция, чаще всего, выполняет ся путем анастомозирования общей или собственно пече ночной артерий трансплантата «конец в конец» с общей печеночной артерией реципиента в месте отхождения желудочно-двенадцатиперстнойартерии.Существуетмно- жество других, более сложных, вариантов в зависимости от анатомических особенностей (рис. 7). Артериальную реваскуляризацию трансплантатов у совсем малень ких детей можно выполнять непосредственно от аорты, используя либо трупный донорский сосуд, включающий участок аорты, либо артериальную или венозную донор скую вставку. Анастомоз с аортой реципиента в таких случаях накладывается либо выше отхождения чревного ствола, либо ниже почечных артерий. Однако за последние
Рис. 7. Вариант артериальной реконструкции при имплан тации трупной печени. Слева — анатомический вариант артериального кровоснабжения печени донора. Справа — артериальная реконструкция в организме реципиента: 1 — правая печеночная артерия трансплантата (ветвь верхней брыжеечной артерии); 2 — собственно печеночная артерия трансплантата (из системы чревного ствола); 3 — верхняя брыжеечная артерия: 4 — собственно печеночная артерия реципиента: 5 — чревный ствол и его ветви: 6 — двенадцати перстная кишка реципиента
443
Абдоминальная хирургия
10 лет методика артериальной реваскуляризации транс плантатов у маленьких детей возвращается к традици онному способу анастомозирования печеночных артерий донора и реципиента с помощью микрохирургической техники.
Выбор способа билиарной реконструкции зависит от конкретных обстоятельств, складывающихся в резуль тате имплантации донорской печени, в частности, от характеристик желчного протока (или протоков) конк ретного трансплантата и реципиента. Наиболее физио логичным считается восстановление непрерывности гепатикохоледоха путем анастомозирования донорс кого и собственного фрагментов протока «конец в конец» (см. рис. 3). Такой билио-билиарный анастомоз принято формировать на каркасном Т-образном дре наже, который одновременно служит для декомпрес сии. Причинами отказа от такой реконструкции могут явиться несовпадение диаметров протоков, чрезмерное натяжение, а также сомнения в адекватности крово снабжения стенок протоков как у донора, так и у реци пиента. Кроме того, при исходном заболевании печени, связанном с болезнью протоков, например при первич ном склерозирующем холангите, показания к использо ванию дистальной культи холедоха реципиента весьма противоречивы. Таким образом, при наличии сомнений
в адекватности желчных протоков донора и/или реци пиента для наложения билио-билиарного соустья мето дом выбора становится билио-дигестивный анастомоз, то есть холедохо(гепатико)-еюностомия с петлей кишки, выключенной по Roux.
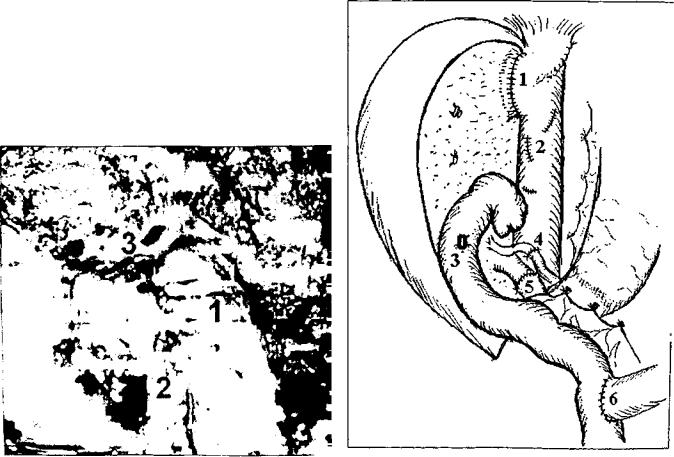
Реконструкция желчеотведения при использовании родственных трансплантатов или левосторонних фраг ментов трупной печени связана с дополнительными трудностями, так как эти трансплантаты, как правило, не имеют каких-либо значимых по длине отрезков желчных протоков вне паренхимы трансплантата. Устья таких протоков зияют на поверхности среза паренхи мы (рис. 8). Их число варьирует от 1 до 4. Это требует наложения соответствующего числа билиодигестивных анастомозов, что предусматривает использование весь ма прецизионной хирургической техники при оптичес ком увеличении (рис. 9).
Рис. 8. Имплантация праной доли печени живого родстнен- |
Рис. 9. Имплантация праной доли печени ж иного родствен |
|
ного донора закончена (схема): 1 - печеночно-канальный |
||
иою донора (интраоперациопная фотография). Сосудистая |
анастомоз; 2 — ушитые дефекты и стенке нижней полой пены |
|
реконструкция закончена: 1 — порто-портальный анасто |
после гепатэктомни; 3 — проекция гопатико-еюноанлггомо |
|
моз; 2 |
аририи-артериальный анастомоз; 3 — зияющее |
за, расположенного на задней стенке кишки; \ артерно- |
устье печеночного протока трансплантата перед наложением |
артерпальпый анастомоз; 5 — порто-портальный анастомоз; |
|
билио-дигестииного анастомоза |
6 — межкншечиый анастомоз (но Roux) |
|
444
Трансплантация печени: клинические и хирургические аспекты
j Посттрансплантационный период
Под посттрансплантационным периодом следует понимать жизнь реципиента с функционирующим транс плантированным органом (в данном случае — донор ская печень) независимо от ее продолжительности. Нормальное течение этого периода у взрослого реципи ента подразумевает выздоровление от болезни печени и ее осложнений, физическую и социальную реабилита цию, а у детей посттрансплантационный период должен гарантировать ряд дополнительных условий, таких как физический рост, интеллектуальное развитие и поло вое созревание.
Реакция отторжения и иммуноподавляющее лечение
Неотъемлемой частью течения посттрансплан тационного периода является реакция отторжения. Определяющую роль в том, как будет протекать пост трансплантационный период, играет медикаментозная иммуносупрессия. Главным принципом проведения медикаментозной иммуносупрессии является использо вание минимально допустимых доз иммунодепрессантов, обеспечивающих удержание реакции клеточного отторжения трансплантата в пределах слабой степе ни. Основными видами протоколов иммуносупрессии при трансплантации печени являются 2-компонентный (кортикостероиды + циклоспорин А или такролимус) и 3-компонентный (кортикостероиды, циклоспорин А или такролимус + мофетиловая кислота или мофетила микофенолат).
Разработанный в Японии препарат FK-506 (Такролимус, Програф), который является альтерна тивой циклоспорину А, используется в клинической практике с 1994 г. Механизм действия FK-506 и цик лоспорина А аналогичен, однако имеются некоторые отличия, которые позволяют в ряде случаев, заменив один препарат другим, добиваться более успешного подавления реакции отторжения.
Использование препаратов микофеноловой кисло ты в качестве третьего компонента иммуносупрессии вполне традиционно, имеется и благоприятный опыт назначения сочетания такролимуса и мофетила микофенолата с исключением кортикостероидов.
При использовании трупного трансплантата уже с третьих суток имеется вероятность развития криза отторжения. Выход морфологической картины реак ции отторжения за рамки слабой степени означает
наличие криза отторжения, что требует незамедлитель ного повышения доз иммуноделрессантов и проведения серийного морфологического контроля эффективности лечения.
Использование родственных трансплантатов зна чительно упрощает проведение медикаментозной иммуносупрессии. Это особенно заметно, когда доно рами становятся ближайшие родственники реципи ента — родители или сибсы. В таких случаях наблю дается совпадение донора и реципиента по трем или четырем антигенам HLA. Несмотря на то что при этом реакция отторжения безусловно присутствует, ее проявления настолько незначительны, что могут быть купированы меньшими дозами иммунодепрессантов. Вероятность возникновения криза отторжения родс твенного печеночного трансплантата весьма мала и может быть спровоцирована лишь самовольной отме ной иммуноделрессантов. Занимаясь родственной трансплантацией печени с 1997 г. и прооперировав 200 пациентов в возрасте от б мес до 62 лет, мы не наблюдали у них кризов отторжения при использо вании 2-компонентного протокола иммуносупрессии. Кроме того, возможность поддержания низких кон центраций циклоспорина или такролимуса и малых дозировок кортикостероидов у реципиентов родс твенных трансплантатов позволяет минимизировать побочные эффекты препаратов.
Общеизвестно, что трансплантация органов пред полагает проведение иммуноподавляющего лечения в течение всего периода существования донорского органа в организме реципиента. По сравнению с другими трансплантируемыми органами, такими как почка, поджелудочная железа, легкое, сердце и др., печень занимает особое положение: являясь иммунокомлетентным органом, она обладает толерант ностью к иммунному ответу реципиента. Как показал более чем 30-летний опыт трансплантации, при пра вильном проведении иммуносупрессии средний срок выживания печеночного трансплантата значитель но превышает таковой для других трансплантируе мых органов. Около 70% реципиентов донорской
печени демонстрируют десятилетнее выживание.
Длительное взаимодействие печеночного трансплан тата с организмом реципиента создает благоприят ные условия для постепенного снижения доз имму ноделрессантов вплоть до отмены кортикостероидов, а затем, в ряде случаев, до полной отмены медика ментозной иммуносупрессии, что более реально для реципиентов родственных трансплантатов в связи с заведомо большей исходной тканевой совместимос тью донора и реципиента.
445
Абдоминальная хирургия
Качество жизни реципиентов донорской печени
Одной из задач, решаемых при выполнении трансплан тации печени, является создание возможностей для выздо ровления и полной физической и социальной реабилита ции реципиента, т.е. обеспечения качества жизни. Опыт практической работы с реципиентами донорской печени в различные сроки после трансплантации показывает, что в течение первого года немногочисленные проблемы, связанные с применением иммунодепрессантов, посте пенно исчезают. В большинстве случаев к концу первого года дозы иммуноподавляющих препаратов снижаются до минимальных, которые не влияют на качество жизни.
Заканчивая изложение проблемы транспланта ции печени, необходимо подчеркнуть, что своевре менное выполнение этого вмешательства и прове дение адекватного иммуноподавляющего лечения позволяет не только сохранить жизнь, но и обеспе чить полное выздоровление реципиента.
Говоря о перспективах развития трансплантации печени в России, следует констатировать, что основ ной проблемой в настоящее время является необ ходимость организации сколько-нибудь действенной системы посмертного органного донорства. Это пред ставляет собой скорее социально-этическую, нежели медицинскую проблему. По всей вероятности, наиболее реальным путем в настоящее время является развитие родственной трансплантации, в том числе использова ние правой доли печени по методике ГУ РНЦХ им. акад. Б.В. Петровского РАМН, что является полноценной аль тернативой пересадке целого трупного органа.
Литература
1.Готье СВ., Цирульникова О.М., Филин А.В. и соавт. Xupv гичвекая техника и результаты ортотопической тпп плантации правой доли печени от живого родственно
донора / Анналы хирургической гепатологии. 2001 т /V? 2, с. 22—29. ' '
2.Готье СВ., Цирульникова О.М. Ортотопическая транс плантация печени / В кн. Клиническая трансплантоло гия. Под ред. Б.А. Константинова. «Аир-Арт». м., 2004
с.120—152.
3.Константинов Б.А., Готье СВ. Трансплантация печени в России: проблемы, перспективы ближайшего десятиле тия/Анналы хирургической гепатологии. 1998, т.з,Н°.г
с.119—121.
4.Шумаков В.И., Гальперин Э.И., Неклюдова Е.А. Трансплан тация печени. М.: Медицина, 1981, 288 с.
5.Broelsch СЕ., Whitington P.F., Emond J.С. et al. Liver transplantation in children from living related donors. Annals of Surgery, 1991, vol. 214, №- 4, p. 428—438.
6.Liver Transplantation. Ed. by Calne R. Grune and Stratton, Hew York. 1987, 571 p.
7.Ringe B. Quadrennial review on liver transplantation. Am. J. Gastroent 1994, v. 89, №- 8, p. S18—S26.
8.Rogiers X., Malago M., Gawad K. et al. In situ splitting of cadaveric livers. Annals of Surgery, 1996, vol. 224, № 3, p. 331—341.
9.Starzl Т.Е., Demetris A.J. Liver Transplantation: A 31-Year Respective. Parti—III. Current Problems in Surgery, 1990, vol. 27, № 4, p. 1—240.
10.Williams J.W. Hepatic transplantation. W.B. Saunders Compa ny, Philadelphia. 1990, 245 p.
446
ХИРУРГИЯ ПАНКРЕОНЕКРОЗА
М.И. Филимонов, С.З. Бурневич
На современном этапе развития абдоминальной хирургии наиболее проблемным в неотложной панкреатологии остается раздел хирургического лечения боль ных панкреонекрозом. Об этом свидетельствуют как отсутствие единых и согласованных взглядов в выборе хирургической тактики, так и значительная вариабель ность послеоперационной летальности. Одним из ярких примеров такого положения вещей является широкая дискуссия на хирургических форумах по вопросам клас сификации острого панкреатита, выбора показаний, оптимальных сроков и методов хирургического лечения больных панкреонекрозом. В частности, это подтверж дают и различия ежегодных данных послеопераци онной летальности, которые варьируют от 5 до 50% в хирургических стационарах г. Москвы.
Вместе с тем широкий диапазон колебаний после операционной летальности и различий тактических вариантов хирургического лечения панкреонекроза, в том числе и в историческом аспекте, создает ситуацию статистического хаоса, которую одни хирурги расцени вают как закономерную, другие как непрогнозируемую. В значительной мере это обусловлено рядом причин: поздними сроками госпитализации, несвоевременной диагностикой панкреонекроза, отсутствием единой трактовки форм заболевания, проведением неадекват ной тяжести состояния больного интенсивной терапии и, как следствие, выполнением необоснованно «ран них» или «запоздалых» оперативных вмешательств. Все эти изменения происходят на фоне абсолютного роста числа больных с острым панкреатитом, а в структуре хирургического стационара это заболевание занимает традиционно третье место после острого аппендицита и острого холецистита.
Исторический экскурс, практически всегда пред шествующий изложению материала в монографиях или руководствах по неотложной панкреатологии, издан ных за последние три десятка лет, убедительно пока зывает, что разнообразная и, порой, противоречивая тактика хирургического лечения панкреонекроза явля ется «зеркальным» отображением различных пред ставлений в понимании патогенеза заболевания на определенный период времени. В тесной связи с этими явлениями остается изучение закономерностей эволю ции деструктивного панкреатита, что определяется не только качеством диагностики и верификацией клини-
ко-морфологической формы заболевания в динамике некротического процесса, но и результатами убеди тельных доказательств многоцентровых исследований эффективности различных методов хирургического лечения.
Проведенное нами в 1999 г. анкетирование хирур гических учреждений Российской Федерации показало, что на сегодняшний день отсутствует единый и согла сованный (стандартизированный) подход к тактике хирургического лечения больных панкреонекрозом в соответствии с периодами и фазами развития некро тической деструкции. Этому соответствуют и неравно мерная оснащенность и недостаточное обеспечение клинических учреждений даже при наличии для этого квалифицированных кадров, имеющих определенный опыт ведения больных панкреонекрозом. Однако уже сегодня следует признать тот факт, что стандарти зация методов лабораторного и инструментального обследования при панкреонекрозе является реальной, тогда как стандартизация консервативного и хирур гического лечения требует дальнейшей разработки. Это в полной мере относится к пониманию хирургом проблемы не только с чисто хирургической позиции, но и объективной оценки эффективности каждого из существующих сегодня методов комплексной интенсив ной терапии. Нельзя сбрасывать со щитов тот реальный факт, что хирург до сих пор остается «заложником» конечной эффективности консервативной терапии пан креонекроза.
В настоящем изложении проблемы мы сочли целе сообразным представить ключевые вопросы выбора тактики хирургического лечения панкреонекроза, осно вой которых являются современные представления об этиологии и патогенезе заболевания, особенностях диагностики и возможностей интенсивной терапии.
Этиология и патогенез
Как показали исследования последнего десятиле тия, отличительной особенностью патогенеза деструк тивного панкреатита является развитие широкого спек тра патоморфологических форм заболевания, отли чающихся от интегральной совокупностью факторов: распространенности, глубины и характера поражения поджелудочной железы (ПЖ), забрюшинной клетчатки
447
Абдоминальная хирургия
(ЗК) и органов брюшной полости (ОБП). На этом фоне полиморфизм эволюции и многообразных их клини ческих проявлений связаны в большинстве наблю дений лишь с ограниченным числом этиологических факторов — билиарного и алиментарного (алкоголь ного) происхождения. Данные эпидемиологических исследований свидетельствуют о том, что среди лиц пожилого и старческого возраста в качестве причины панкреонекроза доминируют желчнокаменная болезнь и ее осложнения, тогда как у лиц молодого и среднего возраста основным этиологическим фактором является прием алкоголя и его суррогатов. Такая тенденция, отмеченная в последние десятилетия во всех развитых странах Европы и Америки, связана с увеличением числа больных, страдающих желчнокаменной болезнью в группах больных старше 40 лет и употребляющих алкоголь среди самой работоспособной (до 40 лет) части населения. С хирургических позиций только эти наиболее часто встречаемые причины панкреонекро за, приводящие к острой «блокаде» терминального отдела холедоха и главного панкреатического протока, являются неотложным показанием к эндоскопической/ транскутанной декомпрессии внепеченочных желчных путей у больных панкреонекрозом с использованием малоинвазивных хирургических технологий.
Для панкреонекроза в отличие от интерстициального (отечной формы) панкреатита наиболее характерно развитие разнообразных местных, в том числе инфици рованных осложнений, сопровождающихся формиро ванием выраженной системной воспалительной реак ции, панкреатогенного и инфекционно-токсического (септического) шока, тяжелого сепсиса и полиорганной дисфункции/недостаточности. В такой ситуации при стерильном панкреонекрозе летальность не превышает 10%, а при инфицированном панкреонекрозе дости гает максимальных значений 30% и более. С позиций патогенеза и особенностей хирургического лечения панкреонекроз является одной из потенциальных форм внутрибрюшной инфекции, тяжелого абдоминального сепсиса, порой не уступающего по коварству эволюции разлитому перитониту.
Применительно к проблемам диагностики и комп лексного лечения отличительной особенностью панкре онекроза служит то обстоятельство, что в патологичес ком процессе отчетливо обозначаются доинфекционная и инфекционная фазы заболевания.
Основу патогенеза деструктивного панкреатита в начальной, доинфекционной его фазе составляет острое асептическое воспаление ПЖ и окружающих структур ЗК и БП, обусловленное аутолизом тканей
под воздействием панкреатических ферментов с вовле
чением в процесс механизмов воспаления и цитокиногенеза. При панкреонекрозе возникает не просто гипер продукция про- и противовоспалительных медиаторов воспаления, а дисрегуляция системной воспалительной реакции. Так, при определенном сочетании факторов (гиперферментемия, распространенный некроз ПЖ, ЗК и ОБП), эта реакция может стать автономной, неконтро лируемой и независимой от действия инициирующего фактора, что объясняет резистентность как хирургичес ких, так и консервативных интенсивных мероприятий при фульминантных формах панкреонекроза.
При стерильном панкреонекрозе базисный некро тический процесс служит основной причиной «ранней» доинфекционной волны выраженной системной воспа лительной реакции и развития «ранних» проявлений синдрома полиорганной дисфункции/недостаточнос ти. В отношении выбора рациональной хирургичес кой тактики особенно важен тот факт патогенеза, что инфекционный процесс во вторую фазу заболевания, как правило, незаметно в основных клинических прояв лениях «наслаивается» на тканевую деструкцию, опре деляя проблемы своевременной диагностики панкреатогенной инфекции и интегральную тяжесть состояния больного с инфицированным панкреонекрозом. Важно особо отметить, что не изначально прогрессирующая инфекция, а именно сопряженность двух патологи ческих процессов (деструктивного и инфекционного) становится главным фактором, определяющим исход панкреонекроза.
В таких ситуациях принципиальную значимость при обретают патогенетически обоснованные и своевре менные лечебные мероприятия в зависимости от фазы патологического процесса. Их задача состоит не только в устранении непосредственных результатов деструк ции, системной воспалительной реакции и полиор ганной дисфункции/недостаточности, но одновремен н о — в упреждающем воздействии на потенциальные источники и механизмы инфицирования, так как их «включение» влечет за собой быстрое развитие генера лизованных форм хирургической инфекции.
Благодаря определенным достижениям в интен сивной терапии (адекватная коррекция гиповолемии и электролитных нарушений, респираторная и инотропная поддержка, оптимизированная антибактериаль ная профилактика и терапия, парентеральное питание, гемофильтрация, плазмаферез) достигнуто некото рое улучшение результатов лечения больных панк реонекрозом в доинфекционную фазу заболевания. К сожалению, радужные надежды, возлагавшиеся на эффективность применения антиметаболитов, анти ферментов, препаратов соматостатина и их аналогов,
448
Хирургия панкреонекроза
антицитокннов, не оправдались, что показано в рандо мизированных многоцентровых исследованиях послед них пяти лет. Следствием этих успехов и одновременно неудач является четко,,ртмеченная тенденция к тому, что в каждодневной практике хирургу все чаще прихо дится сталкиваться с формированием разнообразных клинико-морфологических форм заболевания в группе пациентов, «переживших» фазу панкреатогенного шока и полиорганной дисфункции. Важно отметить, что под влиянием интенсивной терапии закономерности разви тия «однотипного» некротического процесса от абактериального к бактериальному кардинально не измени лись, хотя удалось достигнуть двухкратного снижения уровня инфицирования, а формы заболевания стали в большей степени носить характер «отсроченных во времени» постнекротических осложнений. Вместе с тем из года в год как в Европе, так и Америке стабильными и даже растущими при алкогольной причине панкреатита остаются цифры погибших больных, развитие панкреонекроза у которых независимо от прогресса интенсив ной терапии носит фульминантный характер.
Эти данные, с учетом ставшей уже историей концеп ции раннего хирургического лечения и несравненно больших возможностей современной интенсивной тера пии, особенно сегодня должны настораживать хирурга, склонять его к активным хирургическим мероприятиям вопреки доводам о «бесперспективности» каких-либо лечебных мероприятий.
Исследования последнего времени свидетельству ют о том, что такое разнообразие вариантов встреча емых форм деструктивного панкреатита связано не только с особенностями топографической анатомии забрюшинного пространства и характером некроти ческой деструкции (жировой, геморрагический, сме шанный), но и с закономерностями эндогенного их инфицирования. В хирургическом преломлении этих данных необходимо отметить, что инфицирование как септический процесс и как сам по себе факт эволюции панкреонекроза имеет строго определенные законо мерности развития, определяемые распространеннос тью, глубиной (масштабом) панкреонекроза ПЖ, ЗК и БП, сроками заболевания, режимами антибактериаль ной профилактики и терапии. В этой связи хирургу не приходится и не следует уповать на «силу» даже самых современных «широкозахватных» антибактериальных средств, а, наоборот, рассматривать значимость опе рации при крупномасштабной деструкции как средс тва профилактики инфицирования и «хирургической детоксикации».
Факторный анализ неблагоприятного течения забо левания, проведенный на материале больных с четко
верифицированным диагнозом панкреонекроза, пока зывает достоверное увеличение фатального исхода при развитии распространенных (субтотальных и крупноочаговых) форм заболевания, осложненных формиро ванием некротической флегмоны, выходящей за пределы парапанкреальной клетчатки, преимущественно на параколическую и паранефральную области забрюшин ного пространства. На этом фоне комплементарным, а в ряде ситуаций и серьезным конкурирующим фактором является инфицирование некротических тканей, кото рое является практически неотъемлемым компонентом крупномасштабного поражения ПЖ и ЗК уже в ранние сроки заболевания. Традиционное выделение геморра гического и жирового панкреонекроза и в настоящее время сохраняет свою актуальность, поскольку наличие геморрагического характера процесса является одним из неблагоприятных факторов прогноза заболевания. Вместе с тем четкая «прижизненная» верификация этих форм панкреонекроза существенно затруднена при применении всего арсенала современных лабораторных и инструментальных методов обследования, поэтому использование их в качестве классификационных еди ниц в современных условиях имеет ограниченное прак тическое значение.
Классификация
Согласно изложенным особенностям эволюции пан креонекроза, основу современной классификации ост рого панкреатита должны составлять именно те фак торы, выявление которых в реальном режиме времени определяет фатальный исход или осложненное разви тие заболевания:
•распространенность некротического процесса в ПЖ, различных отделах ЗК и БП;
•фактор инфицирования некротических тканей различной локализации;
•степень тяжести состояния больного по интег ральным системам-шкалам.
Всоответствии с этими данными в эволюции панк реонекроза целесообразно не только выделять доинфекционную и инфекционную фазы патологического процесса, но и ежедневно оценивать эти позиции у пос тели больного, которые в зависимости от распростра ненности некротического поражения в ПЖ, ЗК и БП и сроков заболевания и «качества» интенсивной терапии имеют определенные клинические, инструментальные
илабораторные признаки. В отношении выбора диф ференцированной тактики хирургического лечения в классификации деструктивных форм острого панкре атита наряду с характеристикой распространенности
449
Абдоминальная хирургия
процесса (мелко-, крупноочаговый, суб-, тотальный) мы рекомендуем выделять следующие качественно отлич ные формы этого заболевания: 1) стерильный панкреонекроз; 2) инфицированный панкреонекроз. Основные положения этой классификации полностью согласуются с международной классификацией, принятой в 1991 г. в Атланте и в 1997 г. в Европе.
В усовершенствованной нами классификации в пер вую, доинфекционную фазу заболевания мы выделяем следующие внутрибрюшные осложнения: 1) фермен тативный асцит-перитонит, развитие которого опреде ляется аутоферментной «агрессией», протекающей в абактериальных условиях, как правило, в ранние сроки заболевания; 2) парапанкреатический инфильтрат, мор фологическую основу которого составляет некротичес кая («абактериальная») флегмона различных отделов забрюшинной клетчатки и 3) псевдокисту различной степени зрелости, которая формируется спустя месяц и более от начала заболевания.
Для инфекционной фазы патологического процесса наиболее характерно сопутствующее развитие: 1) сеп тической некротической флегмоны различных отделов забрюшинного пространства; 2) панкреатогенного абс цесса (забрюшинного или внутрибрюшного), что в боль шей степени соответствует эволюции отграниченных (мелкоили крупноочаговых) форм поражения ПЖ и ЗК; 3) гнойного перитонита (при «разгерметизации» забрю шинного пространства).
Среди экстраабдомииальных осложнений мы выде ляем: 1) панкреатогенный ферментативный шок; 2) сеп тический (или инфекционно-токсический) шок; 3) поли органную дисфункцию/недостаточность с указанием степени тяжести состояния больного по интегральным системам-шкалам — APACHE И, MODS, SOFA; 3) тяжелый панкреатогенный сепсис.
Наши исследования показали, что эволюция инфи цированных форм панкреонекроза характеризуется отличительными временными, клиническими и про гностическими особенностями. Установлено, что в первые 4 суток заболевания распространенный некротический процесс в забрюшинном пространс тве носит абактериальный характер. Уже на первой неделе заболевания у трети пациентов с распростра ненным панкреонекрозом происходит инфицирование вовлеченных в некротический процесс областей, что соответствует в данный период времени формиро ванию инфицированного панкреонекроза. Ко второй неделе заболевания при распространенном панкреонекрозе развивается инфицированный панкреонекроз в сочетании с панкреатогенным абсцессом. К концу третьей и началу четвертой недели заболевания при
очаговых формах панкреонекроза формируются «поз дние» осложнения панкреонекроза с образованием панкреатогенного абсцесса. Выявленные нами зако номерности и варианты развития панкреатогенной инфекции имеют убедительное научно-практическое обоснование и соответствуют исторически сложив шимся в нашей стране представлениям о хирургичес ком сепсисе.
Выявленные нами закономерности позволили рас сматривать панкреонекроз как одну из частых причин абдоминального, в частности, панкреатогенного сепси са, имеющего строгую закономерность в трансформа ции различных форм панкреонекроза. Нами выделены три основных клинико-морфологических варианта раз вития панкреатогенной инфекции в виде инфицирован ного панкреонекроза, панкреатогенного абсцесса и их сочетаний (рис. 1). Так, варианты развития некротичес кого процесса всецело определяются распространен ностью поражения поджелудочной железы и различных отделов забрюшинной клетчатки.
Ограниченный |
f |
Панкреатогенный абсцесс |
|
панкреонекроз |
|
|
|
|
|
|
Инфицированный |
|
|
|
панкреонекроз + |
^ _ *- ~ |
|
Панкреатогенный абсцесс |
|
Распространенный «•"""** |
|
• |
Инфицированный |
|
|||
паи^агчи^пл^ |
|
Панкреонекроз |
|
Рис. 1. Этапы эволюции деструктивного панкреатита
Результатом ограниченного стерильного панкрео некроза является развитие преимущественно панкреа тогенного абсцесса. В свою очередь распространенный стерильный панкреонекроз, как правило, тотально-суб тотальный, у 60—80% больных характеризуется эволю цией в инфицированный некроз, либо в инфицирован ный некроз в сочетании с панкреатогенным абсцессом. В диагностической программе второй «хирургической доминантой» после оценки распространенности некро за является своевременное выявление факта инфици рования. Оба этих фактора — распространенность и
инфекция — четко коррелируют со степенью тяжес ти состояния больного. Эти особенности составляют не только структуру клинической классификации, но и алгоритм диагностической программы у больных пан креонекрозом. По этим причинам в программу обяза тельного обследования больных необходимо включать не только ультрасонографию и лапароскопию, но и определение «традиционных» клинико-лабораторных показателей, необходимых для объективной оценки степени тяжести состояния больного по интегральным системам-шкалам.
450
