
хирургия 5 курс / книги / Savel'ev V.S. (red.) 80 lekcij po hirurgii (Litterra, 2008)(ru)(T)(K)(910s)(ISBN 9785982161190)
.pdfДиагностика и лечение дисфагии
гиалуроновой кислоты восстанавливается. В связи с этим мы полагаем, ,что ферментотерапию более оправ данно применять с лечебной целью на фоне механичес кого растяжения уже сформировавшегося рубцового сужения.
Считается, что неблагоприятное влияние агрессив ной микрофлоры пищевода является одним из ведущих факторов, поддерживающих эзофагит. В связи с этим предложено значительное количество методик местной антибактериальной терапии, как изолированной, так и в сочетании с другими вариантами воздействия.
Наиболее перспективным, на наш взгляд, является раннее профилактическое самобужирование с озони рованным маслом, позволяющее достигнуть хороших результатов в 98% случаев. Метод заключается в сле дующем: при наличии эндоскопического подтвержде ния язвенно-некротического эзофагита пациентам с 5—7-х суток после ожога производится профилактика развития РСП, включающая прием внутрь озонирован ного растительного масла по 1 чайной ложке 3 раза в сутки за 30 минут до еды в сочетании с сеансами раннего превентивного самобужирования пищевода эластичным зондом внешним диаметром 1,1—1,2 см 2—3 раза в сутки. При этом в стационаре пациент в течение нескольких дней под контролем врача обу чается самобужированию, которое продолжает после выписки ежедневно на протяжении 2—б месяцев с периодическими эзофагоскопическими и рентген-кон трольными осмотрами. Перфораций и кровотечений при профилактике по предложенной методике не наблюдалось.
Методы лечения рубцовых стриктур пищево да. Бужирование в настоящее время остается глав ным методом лечения рубцовых стенозов пищевода. Существует несколько различных методов бужирования Рубцовых стенозов пищевода, основанных на механи ческом растягивании рубцовой ткани, которые можно разделить на следующие группы с учетом способа проведения бужа: вслепую ортоградно; ортоградно под контролем ФГС; за нить ретроградно или ортоградно; по струне-проводнику или нити.
Больше всего осложнений в виде перфораций пище вода бывает при ортоградном слепом бужировании. Для того чтобы избежать осложнений, нужно учитывать противопоказания к проведению бужирования этим методом: стеноз пищевода менее 0,6 см; наличие престенотического расширения пищевода; период менее трех месяцев с момента ожога. Наиболее перспек тивным и часто применяемым является бужирование по струне. Выбор оптимального метода бужирования нередко является трудной задачей для хирурга. Этот
выбор зависит от многих факторов: степени стеноза пищевода, зоны его расположения и протяженнос ти. Большое значение имеет временной фактор-время после получения ожога пищевода. Часто при проведе нии бужирования приходится сочетать различные виды бужирования. Но не всегда удается провести бужи рование перечисленными способами, это сопряжено с высоким риском перфорации пищевода, особенно у больных, перенесших ранее операции на пищеводе.
Вэтих случаях показано оперативное лечение. Наиболее часто выполняемые вмешательства: плас
тика тонкой и толстой кишкой, транехиатальная пласти ка желудочной трубкой из большой кривизны желудка, пластика тонкой кишкой с элементами микрососудис той хирургии.
Ахалазия кардии
икардиоспазм (АиК)
Впереводе с латинского ахалазия кардии — отсутс твие расслабления кардии. Ахалазия кардии относит ся к сравнительно редким заболеваниям, ее частота составляет 1—2 случая на 100 000 населения в год.
Чаще всего заболевание развивается в возрасте от 30 до 40 лет. Дети и подростки среди всех больных с ахалазией кардии составляют 5%. После первого описания кардиоспазма T.Willis в 1679 году прошло более 300 лет, но патогенез заболевания до сих пор окончательно не выяснен. Существующие теории не могут полностью объяснить причину возникновения ахалазии кардии и кардиоспазма. В настоящее время кардиоспазм и ахалазия кардии рассматриваются как два различных заболевания. При кардиоспазме значи тельно возрастает пищеводно-желудочный градиент, а при ахалазии он нормален или снижен на фоне ослаб ленной моторики пищевода. В нашей стране наиболее распространена классификация кардиоспазма, разра ботанная Б.В. Петровским:
• 1-я стадия — пищевод не расширен, рефлекс раскрытия кардии сохранен, моторика пищевода усилена, дискоординирована;
ш 2-я стадия — рефлекс раскрытия кардии отсутству ет, отмечается расширение пищевода до 4—5 см;
а3-я стадия — расширение пищевода до 6—8 см, задержка в нем жидкости и пищи, отсутствие пропульсивной моторики;
•4-я стадия — резкое расширение, удлинение и искривление пищевода с атонией стенок, дли тельной задержкой жидкости и пищи (S-образный пищевод).
i |
371 |
Торакальная хирургия
Диагностика: ФГС, рентгеноскопия, пищеводножелудочная манометрия, иногда при выраженном спас тическом компоненте с целью исключения ИБС прово дится ЭКГ-исследование.
Лечение. Пациентам с 1-й ст. кардиоспазма про водится терапия: спазмолитики, седативные средства, физиотерапия. Из физиотерапевтических воздействий используются электросон, электрофорез с цинком и магнезией. Очень редко пациенты в начальных стади ях заболевания попадают для лечения к торакальным хирургам, они лечатся у терапевтов или вообще не обращаются за медицинской помощью. Большинство больных лечатся с применением различных видов кардиодилататоров (механических, гидравлических, пнев матических). Наиболее часто в настоящее время исполь зуются пневматические кардиодилататоры с хорошими результатами в 72% наблюдений. Мы отдаем предпочте ние механическим кардиодилататорам Н. Stark, получая хорошие результаты в 93% случаев. В случаях, когда проведение механического дилататора может вызвать травму пищевода, проводится предварительная дилатация гидравлическим дилататором с последующей механической дилатацией аппаратом Н. Stark.
Хирургическое лечение ахалазии кардии и карди оспазма применяется значительно реже. Предложено более 60 способов хирургического лечения этих забо леваний, но большинство из них в настоящее время имеют лишь историческое значение. Практически все современные способы оперативного лечения ахалазии и кардиоспазма имеют в своей основе миотомию в области кардиального жома, переходящую на нижнюю треть пищевода и желудок, дополненную различными вариантами фундопликации. При наличии сопутствую щих заболеваний, таких как язвенная болезнь желуд ка и двенадцатиперстной кишки, гастрит, эзофагит, проводится соответствующая лекарственная терапия. Особенно часто АиК сопровождается гастритом, дуоде нитом и язвенной болезнью. Следует отметить, что эзо фагит до коррекции патологии желудочно-пищеводного перехода имеет алиментарный гнилостный характер и требует местной и общей антибактериальной терапии. При избыточной дилатации или неадекватной оператив ной коррекции характер эзофагита меняется, и лечение его должно подчиняться законам лечения рефлюксного эзофагита. Часто АиК сопровождается другими забо леваниями верхних отделов пищеварительного тракта, требующими соответствующей терапии. При язвенной
болезни желудка, ДПК и гастрите, спровоцированных НВ, должна проводиться эррадикация НВ с применени ем стандартных схем. При язвенной болезни желудка и двенадцатиперстной кишки, гастрите, вызванных повы
шением кислотности желудочного содержимого, подав ления кислотности достигали с помощью блокаторов гистаминовых Нг-рецепторов, при этом отмечали стиха ние также и эзофагита. Ингибитор водородно-калиевого протонного насоса — омепразол, чаще вызывает полное исчезновение симптомов даже тяжелого эзофагита, воз никшего после коррекции нижнего пищеводного сфин ктера. Эти средства следует использовать в течение длительного времени с целью купирования эзофагита. Любой вид медикаментозной терапии не ведет к пол ному излечению, и большинство больных имеют реци дивы симптомов болезни, т.к. кислотосупрессирующая терапия не может быть постоянной. Медикаментозная терапия должна быть адекватной и изменяться парал лельно с основными методами коррекции патологии желудочно-пищеводного перехода.
Рубцовый стеноз пищевода на фоне пептического эзофагита
Ведущее место в патогенезе гастроэзофагеальной рефлюксной болезни (ГЭРБ) занимает нарушение функ ции антирефлюксного барьера, последнее может возни кать вследствие первичного снижения тонуса нижнего пищеводного сфинктера, увеличения числа его спон танных расслаблений, структурных изменений нижнего пищеводного сфинктера, а также в результате автоном ной дисфункции блуждающих нервов. В развитии несо стоятельности пищеводного сфинктера может играть ведущую роль один из факторов (снижение давле ния, уменьшение общей длины или протяженности абдоминального отдела) или их комбинация. Снижение давления в области нижнего пищеводного сфинктера, независимо от других факторов, приводит к развитию гастроэзофагеальной рефлюксной болезни; в свою оче редь, если протяженность абдоминальной части нижне го пищеводного сфинктера меньше 1 см, то вероятность развития рефлюкса составляет 90%, независимо от величины давления в нем. Другими причинами возник новения пептического эзофагита могут быть:
аповышение кислотности желудочного содержи мого, повышение кислотности физиологических рефлюксов (нормальных по частоте и длитель
ности);
•скользящая грыжа ПОД, особенно на фоне язвен ной болезни желудка и ДПК;
•состояние после резекции и экстирпации желудка, гастроэнтеростомии;
•длительное стояние зонда и других инородных тел
впищеводе.
372
Диагностика и лечение дисфагии
Микроорганизмы играют важную роль в развитии гастроэзофагеальной болезни. Эзофагит при гастроэзофагеальной рефлюксной болезни протекает тяже лее у больных, инфицированных Helicobacter pylori. Особенности строения слизистой оболочки кардиального отдела желудка таковы, что Helicobacter pylori часто способствует воспалительному процессу в этой области. Нередко желудочные и дуоденальные язвы ассоциированы с Helicobacter pylori и гастроэзофа геальной рефлюксной болезнью. В самом пищеводе Helicobackter pylori встречается лишь при метаплазии эпителия, т.е. при пищеводе Барретта.
Определенную этиологическую роль в развитии несостоятельности нижнего пищеводного сфинктера играют вынужденное положение тела с наклоном туло вища, избыточная масса тела, курение и злоупотребле ние алкоголем, причем, по мере повышения крепости алкогольных напитков и утяжеления заболевания, час тота выраженных форм эзофагита возрастает. В ряде случаев рефлюкс-эзофагит заканчивается формиро ванием рубцовой пептической стриктуры пищевода, уровень которой зависит от многих факторов.
Диагностика: ФГЭС, рентгеноскопия, пищеводножелудочная 24-часовая РН-метрия.
Лечение зависит от причин, вызвавших рефлюксэзофагит и рубцовую стриктуру пищевода. При эрозив ных формах гастроэзофагеальной рефлюксной болезни, отсутствии грыжи ПОД проводится следующая терапия. Ингибиторы протонной помпы (ИПП): омепразол 20 мг, лансопразол 30 мг, рабепразол 20 мг, пантопразол 40 мг или эзомепразол 40 мг — 2 раза в сутки в течение 3— 4 недель. При необходимости показана комбинация с мотилиумом или координаксом (10 мг — 4 раза в день). При наличии феномена ночного кислотного прорыва на фоне терапии ИПП рекомендован прием ранитидина 150—300 мг на ночь.
У некоторых больных рефлюксная болезнь разви вается на фоне желчного рефлюкса. В случае дуоденогастрального рефлюкса желчные кислоты обычно инактивируются (преципитируются) в кислом желудочном содержимом. Поэтому желчные кислоты редко оказы ваются в пищеводе у больных рефлюксной болезнью с высоким уровнем желудочной секреции. При угнетении желудочной секреции большое количество желчных кислот может оказаться в пищеводе, повреждая его сли зистую. В данном случае оказываются эффективными прокинетики, которые нормализуют моторику пищевода и желудка, улучшая антродуоденальную координацию. Однако не стоит забывать об ИПП, которые уменьшают не только кислотность, но и объем желудочного содер жимого, а это в свою очередь уменьшает желудочно-
пищеводный рефлюкс при недостаточности нижнего пищеводного сфинктера.
В гистологических препаратах у больных с пептичес кой стриктурой пищевода отмечались участки фиброза в строме слизистой оболочки, массивная лейкоцитар ная инфильтрация в подэпителиальных слоях, грану ляционная ткань с фиброзом и гиалинозом в субмукозе. В другом варианте выявляются отек и диффузная инфильтрация стромы с преобладанием плазматичес ких веретенообразных клеток. После проведения курса ГБ0, на фоне консервативной терапии и бужирования, обнаруживается подавление образования соединитель ной ткани за счет уменьшения коллагеновых волокон.
Вних отмечено появление большого количества клеток
свакуолизированными ядрами и пикнотизированной цитоплазмой, исчезновение лейкоцитарной инфильтра ции в слизистой, усиление пролиферативной активно сти эпителия.
Влечении пептической стриктуры пищевода при рефлюкс-эзофагите применяют бужирование пищевода и баллонную дилатацию. Эффект дилатации закреп ляется самобужированием с озонированным маслом и консервативной терапией. При грыжах пищеводного отверстия диафрагмы на фоне предшествующей консер вативной терапии проводится оперативное лечение.
Внастоящее время известно около 100 различных операций, которые выполняются или выполнялись при рефлюкс-эзофагите и пептических стриктурах пище вода. Стали широко примененяться следующие антирефлюксные вмешательства: тотальная фундопликация по Ниссену или Россетти (360°) и парциальные фундопликации по Белей (270°), Тоупе (180°) и Дору (180°).
В1991 году Dallmage представил отчет о первых успеш но выполненных лапароскопических фундопликациях по Ниссену, но, по данным отдела гастроэнтерологии, больницы Университета Филадельфии, США, показа ниями для лапараскопической манипуляции являются грыжи только до 3 см. Критериями отказа пациентам в эндовидеоскопической операции по Ниссену явля лись высокая барреттовская метаплазия пищевода или наличие больших фиксированых грыж пищеводного отверстия диафрагмы.
Вслучае, когда патология пищеводно-желудочно- го перехода сочетается с желчекаменной болезнью, по данным литературы, рекомендовано проведение симультанных операций.
Таким образом, хирургическое лечение рефлюксэзофагита и его осложнений необходимо индивидуа лизировать в зависимости от разнообразных факторов, большое место среди которых занимает вид предшест вующего лечения, особенно хирургического. Основной
373
Торакальная хирургия
и наиболее оптимальной операцией является фундопликация, сочетающаяся с ваготомией. При возмож ности выполнить органосохраняющее вмешательство операцией выбора при тяжелом рефлюкс-эзофагите (пищевод Баррета) и необратимой пептической стрик туре является экстирпация пищевода с пластикой желу дочной трубкой или толстой кишкой с одномоментным наложением анастомоза на шее.
Инородные тела пищевода
Диагностика инородных тел пищевода не вызывает больших трудностей, чаще всего диагноз ставится уже при сборе анамнеза, а фиброгастроскопическое иссле дование лишь подтверждает его. Дисфагия, вызван ная инородными телами пищевода, является проблемой больше эндоскопической, т.к. инородные тела в боль шинстве случаев удается удалить при ФГЭС и только при возникновении осложнений требуется хирургическое вмешательство. Очень часто инородное тело низводится из пищевода в желудок и реже извлекается через рото вую полость. Оперативное удаление инородных тел про изводится редко. Перфорация пищевода наблюдается в каждом сотом случае. По нашим данным, более чем в половине из них она заканчивается летальным исходом.
В случаях, когда подозревается перфорация пище вода, очень эффективным методом обследования явля ется рентгеноскопия пищевода с водорастворимым контрастом. Несмотря на то что водорастворимые кон трасты несут в себе молекулы йода, они не являются антисептиками, и поэтому целесообразно применять при этих исследованиях смесь контраста с антибиоти ками широкого спектра действия. Раньше исследова ния проводились с бариевой взвесью, что приводило к образованию в средостении бариевого депо, которое длительное время поддерживало медиастинит и значи тельно удлиняло сроки лечения больных, а в некоторых случаях приводило к летальному исходу. Исход лечения больных с инородными телами пищевода мало зави сит от времени стояния инородного тела в пищеводе и определяется периодом от момента перфорации до момента оперативного лечения. Летальность при пер форациях пищевода инородными телами достигает 60% вследствие развития медиастинита. Лечение перфора ций пищевода оперативное. Обязательным условием лечения перфораций пищевода является его выклю чение из процесса проведения пищи путем наложения
гастростомы, энтеростомы или проведением зонда для энтерзльного питания. Объем оперативного лечения
зависит от времени, прошедшего с момента перфорации. При перфорациях неизмененного пищевода без явле ний развившегося медиастинита показано ушивание пищевода, дренирование зоны перфорации. Ушивание пищевода в зоне гнойного воспаления обычно ведет к несостоятельности швов и увеличению перфоративного отверстия; в этих ситуациях более целесообразно адекватное дренирование зоны перфорации с активной аспирацией гнойного содержимого. Способ дренирова ния зависит от локализации перфорации.
Рубцовые стриктуры пищеводных анастомозов
Стриктура анастомоза — наиболее частое органи ческое заболевание искусственного пищевода. Рубцовый процесс развивается обычно на фоне воспале ния и особенно сильно прогрессирует при вторичном
заживлении |
анастомоза при его несостоятельности. |
К рубцовым |
сужениям следует относить случаи, когда |
нарушение прохождения пищи по пищеводу наступает при ширине соустья, диаметр которого меньше 1/3 про света пищевода.
Причины возникновения стенозов пищеводных анас томозов весьма разнообразны и зависят от множества факторов, воздействующих на анастомоз после его фор мирования, к последним можно отнести следующие:
•технические погрешности наложения анастомоза;
•использование шовных материалов, не отвечаю щих современным требованиям;
•нарушение кровоснабжения анастомозируемых органов;
•ретроградный заброс естественных агрессивных сред организма;
•рост опухоли в зоне анастомоза.
От рубцового сужения соустья следует отличать сужение вследствие дефектов оперативной техники. Это тяжелое осложнение обычно выявляется сразу при первых приемах воды и пищи или в ближайшие сроки после операции. Уточнить причину этого явления поз воляют рентгеноскопия с применением водораствори мого контраста и ФГЭС. Фиброэзофагоскопия позволяет не только диагностировать, но и устранить, чаще всего, причину стеноза анастомоза.
Для формирования пищеводных анастомозов необ ходимо использовать монофиламентные рассасываю щиеся нити. От использования шовных материалов, обладающих фитильными свойствами, надо отказаться. Зарубежные коллеги часто используют механический аппаратный шов при наложении пищеводных анастомо-
374
Диагностика и лечение дисфагии
зов. Использование методики однорядных непрерыв ных шовных анастомозов позволяет избежать стриктур анастомозов.
Замечено, что ишемия зоны анастомоза в ряде случа ев ведет к формированию рубцовой стриктуры анасто моза. Заброс желудочного или кишечного содержимого часто вызывает развитие эзофагита и стеноз анастомоза, особенно это бывает после выполнения проксималь ных резекций желудка и гастрэктомий при наложе нии пищеводного анастомоза с петлей тонкой кишки. В большинстве случаев удается разрешить стриктуры пищеводных анастомозов бужированием под контро лем ФГС. После расширения анастомоза до диаметра 1,2—1,4 см мы применяем методику поддерживающего самобужирования с озонированным маслом, что позво ляет остановить процесс стенозирования анастомоза в большинстве случаев. При пептическом эзофагите и стенозе анастомоза необходимо бужирование дополнять лекарственной терапией, улучшающей пассаж пищи в зоне анастомоза (мотилиум, церукал.). После прокси мальной резекции при «кислом» рефлюксе необходимо назначение ингибиторов протонной помпы (омез, ультоп и др.), а с целью предотвращения «ночного кислотного прорыва» — Н2-блокаторы (ранитидин, фамотидин).
Дисфагия у пациентов, оперированных по поводу рака пищевода и кардии, довольно часто бывает за счет продолженного опухолевого роста в зоне анас томоза. Наибольшее число пациентов с проблемами в зоне анастомоза было после проксимальных резек ций желудка и нижней трети пищевода. Из повторно обратившихся после этой операции почти у четверти наблюдалось нарушение пассажа пищи по пищеводу на фоне рецидива заболевания в виде продолженного роста в зоне анастомоза. После гастрэктомий с резек цией нижней трети пищевода, при операциях Льюиса и трансхиатальной экстирпации пищевода, пластике его желудочной трубкой рубцовый стеноз пищевода наблюдался на фоне рецидива заболевания значи тельно реже — в каждом десятом случае. Не всегда опухолевые клетки бывают получены при биопсии зоны стеноза анастомоза при первом же ФГС осмотре. Однако прогрессирующий стеноз анастомоза, особенно появив шийся через год и более после операции, заставляет думать о рецидиве заболевания, многократно повторять биопсию и чаще склоняться в пользу повторной опера ции. Оперативное лечение пациентов с продолженным
ростом опухоли в зоне анастомоза возможно далеко не во всех случаях, т.к. метастатический процесс идет параллельно с ростом опухоли. При рецидиве опухоли пищеводно-желудочного перехода возможно проведе ние экстирпации культи желудка и резекции анастомо
за из левостороннего торакоабдоминального доступа. Если продолженный рост опухоли не позволяет сделать это, следует произвести экстирпацию или резекцию пищевода с использованием для пластики тонкой или толстой кишки одним из общепринятых методов.
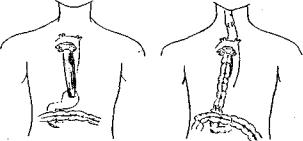
Предлагаем вашему вниманию один из малоизвес тных, но удобных и надежных вариантов пластики. Способ пластики пищевода заключается в следующем: доступ к пищеводу и культе желудка, несущей опухоль, осуществляется посредством левосторонней лапароторакофренотомии. Выделяется желудочно-пищевод- ный переход, несущий опухоль, выделяются культя желудка и пищевод до верхней апертуры грудной клетки. Через разрез по внутреннему краю левой кивательной мышцы выделяется шейный отдел пищевода. Мобилизуется пригодный для пластики отдел толстой кишки, производится экстирпация пищевода и культи желудка, толстокишечный трансплантат проводится в заднем средостении и укладывается в ложе удален ного пищевода, проксимальный конец трансплантата соединяется с культей пищевода методом ручного шва. Дистальный конец трансплантата соединяется с культей двенадцатиперстной кишки по методу «конец в конец» (рис. 1).
Рис. 1. Пластика пищевода толстой кишкой (схема)
Заболевания, редко вызывающие синдром
дисфагии, и их лечение
В хирургии пищевода встречаются редкие нестан дартные варианты заболеваний,являющиеся причиной синдрома дисфагии, диагностика и лечение которых вызываюттрудности. Иногда причины,вызывающиесиндром дисфагии, первично не связаны с заболеваниями пищевода. Особенную трудность представляет лечение больных с синдромом дисфагии после пневмонэктомии
375
Торакальная хирургия
слева, на фоне огромной перфорации опухоли кардии, требующих хирургического вмешательства, т.к. доступ к пищеводу справа крайне затруднен из-за отсутствия левого легкого.
Предложенный способ позволил реабилитировать пациента после пневмонэктомии слева с большим дефек том пищевода (2хб см) в области аортального окна.
Способ заключается в следующем — после диагнос тированной перфорации пищевода, неудачной попыт ки ушивания дефекта пищевода, после пульмонэктомии слева, посредством открытого ведения (торакостомия) разрешается эмпиема плевры и больному выполняется следующее: из широчайшей мышцы спины на сосудистой ножке выкраивается лоскут предполагаемого размера, равный остаточной полости оперированного гемиторакса. Выкроенный лоскут перемещается в плевральную полость через окно сформированного после резекции заднего отрезка ребра. Освежаются края раны пищевода, отсепаровываются края слизистой его и сшиваются рас сасывающейся нитью с атравматической иглой. Не нару шая целостности лоскута, одной частью его укрывается перфорационное отверстие пищевода, и он подшивается отдельными узловыми швами по периметру раны пищево да, остальная часть укладывается в остаточной плевраль ной полости. В дальнейшем проводятся асептические перевязки. Питание осуществляется через гастростому до полного заживления послеоперационной раны и конт рольного рентгеноскопического исследования пищевода с контрастом на предмет целостности органа. По оконча нии лечения гастростома закрывается.
Ниже приводим описание наиболее интересного, с нашей точки зрения, клинического наблюдения боль ной с травматической стриктурой пищевода после пневмонэктомии справа. В этом случае для лечения больной был использован способ наложения отсрочен ных компрессионных магнитных анастомозов. Данный метод не только позволил избавить больную от травмати ческой восстановительной операции, но и, по-видимому, был единственным путем к излечению пациентки.
| Больная Г., 31 год, поступила в отделение торакаль-
:ной хирургии с диагнозом рубцовая стриктура пищевода, осложненная пищеводно-торакальным свищом, состояние
после пульмонэктомии справа, торакопластики, ушивания пищеводного свища. Жалобы на затрудненное прохожде ние по пищеводу даже жидкой пищи, наличие свищей на передней грудной стенке, через которые выделялись гной и
Iсъеденная пища. В 5-летнем возрасте (I960 г.) была опери рована по поводу нагноительного заболевания правого лег кого. Произведена пульмонэктомия. Послеоперационный период осложнился эмпиемой плевры, пищеводно-тора кальным свищом, по поводу чего больная была опериро
вана повторно, произведена торакопластика, ушивание пищеводного свища. В последующем свищи периодически открывались и самостоятельно закрывались. В 1983 году у больной начали нарастать явления дисфагии, и в 1986 году
|
по пищеводу стала проходить только жидкая пища. |
|
Рентгенологически: правая половина грудной клетки |
|
резко деформирована, уменьшена в объеме, фиброторакс, |
|
резецированы передние отрезки ребер с III по VIII, выражен |
|
ный левосторонний сколиоз грудного отдела позвоночника. |
|
При контрастировании: пищевод смещен в правую |
|
половину грудной клетки. В средней трети его имеется |
|
перегиб. Пищевод в этой зоне фиксирован массивными |
|
спайками, резко сужен (до 0,6 см в диаметре), затруднена |
|
проходимость бария. Выше места сужения и перегиба суп- |
|
растенотическое расширение пищевода (рис. 2 а). В месте |
|
перегиба и сужения имеется пищеводно-плевральный |
|
свищ с полостью до 9,5 х 3 см неправильной формы. Вверху |
|
имеется еще один затек контрастной массы размером 3,5 х |
|
1 см. Заключение: рубцовая деформация средней трети |
J |
пищевода, пищеводно-торакальный свищ. |
При фиброэзофагоскопии: пищевод свободно прохо |
|
дим до 30 см по шкале фиброскопа, в просвете светлая |
|
| |
пенистая жидкость, гной. Пищевод расширен над суже- |
I |
ниём. На 30 см от резцов имеется изгиб пищевода в виде |
• |
кармана, передняя стенка кармана прилежит к сердцу, |
I |
просвет пищевода в этой зоне сужен до 0,6 см, здесь же |
I |
имеется свищевое отверстие около 1 см. |
I |
Наложение эзофагоанастомоза обычным методом в |
jj |
условиях фиброторакса 20-летней давности и грубой |
| деформации пищевода в этой зоне признано невозмож- •• ным. Создание искусственного пищевода также было бы tj нерациональным, так как пищевод выше и ниже стриктуры jj был в удовлетворительном состоянии.
1 Было принято решение наложить пищеводно-пищевод- | ный анастомоз с помощью постоянных магнитов, введенных — один в проксимальный отдел пищевода, а другой —
вдистальный отдел через гастростому. Анатомические соотношения благоприятствовали использованию данной методики. После наложения гастростомы по Кадеру— Штамму с помощью двух фиброскопов, один из которых про веден через рот, а другой через гастростому, были введены
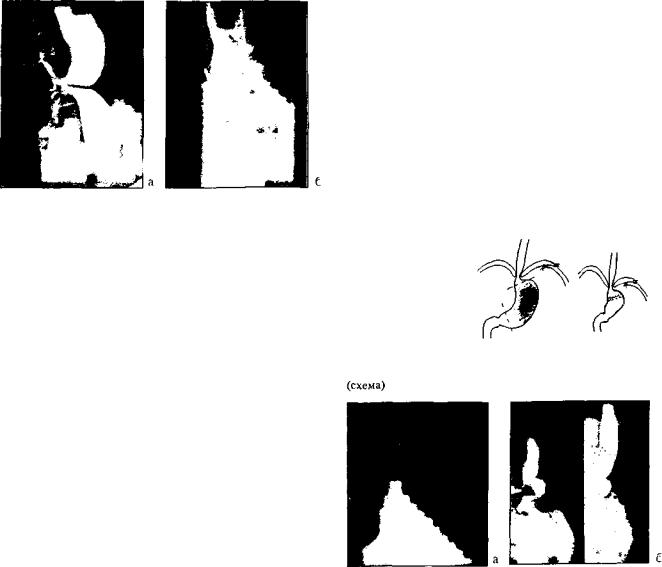
впищевод два кольцевых магнита. Магниты установлены в зоне, где стенки пищевода наиболее близко подходят друг к другу. На седьмые сутки произведена фиброскопия, при которой выявлено, что магниты образовали соустье в стен ке пищевода и свободно держатся на капроновых нитях. Прикрепленная к проксимальному магниту нить пересечена, магниты удалены через гастростому. Через 20 дней после удаления магнитов при контрольной рентгеноскопии весь барий проходит по пищеводу через образованное соустье. лишь незначительная его часть попадает в свищевой ход.
376
Диагностика и лечение дисфагии
Больной было произведено внебрюшиниое закрытие гастростомы. На контрольной рентгеноскопии пищевод проходим для густой бариевой взвеси, которая проходит прямо через соустье (рис. 2 6). Пищевод обычных размеров, желудок без особенностей. Через 4 года больная чувствует себя хорошо, ест любую пищу, пищеводно-торакальные свищи закрылись, прибавила в весе, трудоспособна.
Рис. 2. Рентгенограммы пищевода до (а) и после (б) наложе ния анастомоза
Отсроченные магнитные пищеводно-желудочные анастомозы возможны также у пациентов с практичес ки полным стенозом пищевода в области перехода его в желудок при небольших, размером до 7—8 см, но неоперабельных опухолях, в случаях, когда возможно мобилизовать и подвести дно желудка для наложения анастомоза на 3—4 см выше опухоли. Техника операций проста: лапороторакофренотомия слева, мобилизация нижней трети пищевода и дна желудка, проведение маг нитного элемента в желудок через микрогастротомию. Второй магнит с помощью ФГЭС-аппарата проводился в пищевод. Магниты сближали и смыкали выше опухоли, чем достигали фиксации стенок пищевода и желудка в зоне будущего анастомоза. Последним этапом форми ровали манжетку по Ниссону. В операциях использова ли магниты (SmCo5-SmCol7) различной конфигурации с силой давления на ткани 1,2—1,5 г/мм2. Через 7—8 суток магнитные элементы удаляли за фиксированную к ним нить через рот и начинали полноценное питание больно го обычным способом.
Разрывы диафрагмы обычно не вызывают дисфа гии, однако в некоторых случаях дисфагия и боль яви лись ведущими симптомами заболевания. В двух наблю дениях заболеванию предшествовали ножевые ранения левой половины грудной клетки и, по-видимому, ране ния диафрагмы, происшедшие за несколько месяцев до появления симптомов заболевания. Приводим два наших наблюдения.
Больной С, 18 лет, поступил в общехирургическое отделение с диагнозом острый панкреатит. За сутки до поступления после рвоты у больного появились выра женные боли в эпигастральной области, наруше ние пассажа пищи по пищеводу, многократная рвота. При объективном обследовании высокий лейкоцитоз 19 х Ю'/л, амилаза крови 4,1, при Ro-графии грудной клет ки выявлена жидкость в плевральной полости слева. При ФГЭС выраженная деформация пищевода и желудка. После нескольких часов интенсивной терапии состояние больного продолжало ухудшаться. Больному произведена лапаротомия, при которой выявлено отсутствие желудка в брюшной полости. При проведении торакотомии в плевральной полос ти выявлен практически полностью некротизированный желудок. Произведено удаление желудка в пределах здо ровых тканей с наложением антрально-кардиального анас томоза (рис. 3), пластика диафрагмы. Послеоперационный период протекал обычно. Пациент осмотрен через 6 меся цев — жалоб нет, самочувствие удовлетворительное. При рентгенографии (рис. 4) и ФГЭС значительное уменьшение объема желудка, гастрит.
Рис. 3. Субтотальная резекция некротизированного желудка
Рис. 4. Рентгенограммы больного до (а) и после (б) субтоталь ной резекции ущемленного в разрыве диафрагмы желудка
Второй больной М., 48 лет, переведен в торакальное отделение из фтизиатрической клиники. Два года назад больному произведена нижняя лобэктомия слева по поводу туберкулезного процесса. Два месяца назад больной обра тился в ту же клинику по поводу болей в грудной клетке
377

Торакальная хирургия
слева, легкой дисфагии. Рентгенологически выявлена оста-
8точная полость в наддиафрагмальном пространстве слева, и больному произведена торакотомия, при которой выявлен разрыв пищевода и желудка в плевральную полость, сфор-
•мирована торакостома. При поступлении выяснено, что у пациента полтора года назад была тупая травма живота.
•: |
Состояние больного тяжелое, у больного кахексия, тургор |
|
кожных покровов резко снижен. При осмотре выявлена зияю- |
|
щая рана кардиального отдела желудка с переходом на пище |
!вод размером 8 х б см. Просвет желудка открывался в гнойную полость, края желудка прочно сращены с диафрагмой.
| В качестве первого этапа эндоскопически желудочный > зонд проведен в ДПК (рис. 5), начато активное энтеральное
| |
и параэнтеральное кормление больного и лечение гной- |
. |
ной инфекции. Через четыре недели состояние пациента |
|
несколько улучшилось, плевральная полость очистилась от |
*гноя, показатели внутренней среды также стали лучше и больному произведена операция.
Операция заключалась в выделении желудка и пищево да из раны диафрагмы, ушивание раны желудка и пищевода двухрядными непрерывными атравматичными швами, пог ружение их в брюшную полость. Диафрагма ушита с образо ванием дубликатуры атравматичными мононитями (рис. 6).
iПроизведен пневмолиз, частичное удаление париетальной плевры, декортикация верхней доли легкого. Плевральная
| полость дренирована и ушита наглухо. Послеоперационный \ период протекал тяжело с нагноением торакотомной раны. ' В результате проведенного лечения оставшаяся доля легко- ( го заняла весь объем левой плевральной полости, торако-
Iтомная рана зажила вторичным натяжением, пассаж пищи естественным путем полностью восстановлен.
Рис. 5. Первый этап оперативного лечения
Рис. С. Ьторой этап оператиыю! о лечения
Редко встречаются кисты поджелудочной железы
выходящие в средостение. В качестве примера приво дим следующее наблюдение.
;.-' Больной К., 54 лет, поступил в торакальное отделение с жалобами на нарушение пассажа пищи по пищеводу. Два года назад перенес деструктивный панкреатит. Состояние
;больного тяжелое, больной истощен, тургор кожи резко
,снижен, гемодинамика со склонностью к гипотонии. При
ФГЭС слизистая пищевода не изменена, пищевод аппаратом g 1,2 см проходим, в средней трети на 30 см пищевод поддав- > лен снаружи и в этой зоне проходим аппаратом с усилием. !/ На УЗИ выявлено жидкостное образование, исходящее из ' поджелудочной железы и уходящее в средостение. При
рентгенологическом исследовании — пищевод поджат и У оттеснен извне образованием средостения (рис. 7а). После ,• проведения ФГЭС отмечено кратковременное улучшение •J прохождения пищи по пищеводу. Больной успешно бужиро- _, ван эластичным бужом и обучен самобужированию, после
..; чего он стал удовлетворительно питаться через рот, что
гпозволило подготовить его за три недели к оперативному лечению.
кНа операции с большими техническими трудностями ', из-за выраженного спаечного процесса выделены желудок, поджелудочная железа, основание кисты поджелудочной железы. Киста вскрыта, из нее выделилось около литра лизи- i рованной крови, сгустков и жидкости. Наложен цистоеюно-
5 анастомоз с выключенной по Ру кишкой. Послеоперационный
'., период осложнился ранней спаечной непроходимостью, по поводу чего больной был повторно оперирован. Пациент " осмотрен через 6 месяцев. Жалоб не предъявляет, диету не
'" соблюдает, явлений дисфагии нет. При рентгенографии — пищевод свободно проходим (рис. 7 б).
* 4 "< 1.
Рис. 7. Рентгенограммы пищевода до (а) и после дренирова ния (б) кисты
Приведенные сведения наглядно иллюстрируют те трудности, с которыми может столкнуться хирург, про водя лечение пациентов с синдромом дисфагии. В ряде
378
пустая страница
пустая страница
