
хирургия 5 курс / книги / Savel'ev V.S. (red.) 80 lekcij po hirurgii (Litterra, 2008)(ru)(T)(K)(910s)(ISBN 9785982161190)
.pdfХирургическое лечение рака желудка: современные аспекты проблемы
ры первого этапа метастазирования (N1), т.е. при II и Ша стадиях. Причем достоверно лучшие отдаленные результаты лечения были получены в группе пациентов с сохранением поджелудочной железы и селезенки, т.е. при выполнении органосохранных вмешательств с лимфодиссекцией D2.
Таким образом становится очевидным, что отсутс твие улучшения отдаленных результатов в группе рас ширенных операций во многом объясняется небольшим опытом, а также техническими и тактическими упуще ниями.
На IV Международном конгрессе по раку желудка (New-York, USA, 2001) на Консенсусной конференции, посвященной проблеме расширенной лимфодиссекции при хирургическом лечении рака желудка, большинство участников отмечало улучшение результатов за счет снижения частоты локорегионарного рецидива заболе вания и увеличения пятилетней выживаемости.
В заключение председатель Консенсусной конфе ренции профессор Brennan M.F. (президент конгресса) отметил, что при отработке методики в специализиро ванных центрах непосредственные результаты сопос тавимы с результатами стандартных вмешательств, а отдаленные результаты приближаются к данным Японской ассоциации по раку желудка (JGCA). С учетом накопленного опыта лимфодиссекция D2 является
достаточно безопасной процедурой и должна стать обязательным элементом хирургического лечения рака желудка.
Выбор метода резекции
При выборе объема планируемого вмешательства необходимо четко ответить на основные вопросы, отража ющие тактику лечения у каждого конкретного пациента.
•Является ли хирургическое лечение у данного пациента радикальным?
•Сопоставима ли операционная травма с инди видуальными функциональными возможностями данного пациента?
•Какова возможность послеоперационной реаби литации с удовлетворительным сохранением фун кции (прием пищи естественным путем,кратность и количество пищи, динамика массы тела)?
•На сегодняшний день наиболее онкологически обусловленным является выполнение расширен ного радикального вмешательства с последующим восстановлением непрерывности пищеваритель ного тракта наиболее функциональным способом. Именно этим принципом необходимо руководс твоваться при выборе всех составляющих.
•Хирургический доступ с учетом его травматичности, а также характеристик возможности полноцен ного выполнения резекционного и реконструктив ного этапов.
•Объем резекции с учетом распространенности процесса по органу и объема удаляемых тканей.
•Метод последующей реконструкции, который определяет послеоперационное восстановле
ние энтерального питания, а также возможность выполнения повторной операции в случае мест ного рецидива.
Эта цель может быть достигнута при адекватном предоперационном обследовании пациента с учетом всех доступных методов с целью проведения кли нического стадирования распространенности. Этот компонент лечебного процесса возможен лишь в условиях клиник, имеющих узкоспециализирован ные диагностические подразделения.
Основной целью радикального вмешательства при раке желудка является полное удаление опухоли с учетом возможных местных (интрамуральных) и лимфогенных путей распространения опухолевых клеток. Этот принцип является основным при выборе объема хирур гического вмешательства, как с учетом интрамуральной распространенности, так и строения экстраоргенной лимфатической системы.
Выбор объема удаления желудка
С учетом исследований, проведенных в рамках про граммы JGCA, по путям интрамурального и лимфогенного распространения рака желудка было показано, что при экзофитных локализованных формах роста опухоли желудка (Borrmann-I, II) с целью достиже ния достоверной радикальности необходимо отступать от края опухоли минимум на 3 см в проксимальном направлении. В то же время при инфильтративных формах роста опухоли (Borrmann-III, IV) необходимо отступать от определяемой границы минимум на 5 см в проксимальном направлении. В настоящее время такой подход считается допустимым в хирургии рака желудка в Японии. Однако даже при возможности рен тгенологической, визуальной и пальпаторной оценки проксимальной границы опухоли уровень резекции не должен определятся механистически, исходя из воз можности достижения «адекватной» границы. Помимо сохранения функциональности также необходимо учи тывать радикальность вмешательства, которая опреде ляется не только уровнем резекции органа, но и путями распространения опухолевых клеток. Поэтому в РОНЦ
РАМН показанием к выполнению дистальной суб-
561
Онкохирургия
тотальной резекции желудка является локальный неинфильтративный тип опухоли (Borrmann I, II), локализованный в антральном отделе желудка, без
перехода на угол желудка (который рассматривается как нижняя треть тела). Во всех случаях инфиль-
тративных опухолей, а также при локализованных экзофитных опухолях с переходом на тело желуд ка обязательным является выполнение гастрэктомии «de principle». Это положение является косвенным отражением частоты выполнения гастрэктомий при хирургическом лечении рака желудка. Действительно, если учесть, что опухоли тела и проксимального отде ла желудка составляют несколько менее 60%, а среди опухолей дистальной трети более половины являются эндофитными и около 10% переходят на угол желудка, то становится понятным, что при лечении рака желуд
ка более 80% должна составлять гастрэктомия.
Другим не менее важным фактором, нежели интрамуральная распространенность опухолевого процесса, является лимфогенная распространенность, то есть вовлечение регионарных лимфоколлекторов. Наличие пальпаторно определяемых при ревизии метастатичес ких узлов 8 связочном аппарате желудка, особенно в паракардиальной области справа и слева при опухолях антрального отдела, даже с учетом небольшого размера экзофитной неинфильтративной опухоли, должно скло нять чашу весов в пользу выполнения гастрэктомий. Другим определяющим фактором является наличие явных метастазов в бассейне по ходу селезеночной артерии (№ 11), а также в воротах селезенки (№ 10).
И если при выполнении расширенной гастрэкто мий на сегодняшний день стандартным являет ся выполнение комбинированной спленэктомии, то массивное поражение цепочки лимфоузлов по ходу селезеночной артерии (часто сопровождаемое перинодальным ростом опухолевой ткани с вовлече нием селезеночной артерии) является показанием к
выполнению комбинированной резекции подже лудочной железы различного объема, вплоть до субтотальной резекции 95% паренхимы.
Как указывалось выше, выбор объема хирургичес кого вмешательства зависит от нескольких взаимосвя занных факторов: характер и форма роста первичной опухоли, включая наличие подслизистой инфильтрации, переход на дистальную треть тела желудка, распростра ненность лимфогенного метастазирования. Несмотря на кажущуюся простоту алгоритма оценки данных о распространенности, каждый из них заключает в себе несколько вариантов, от сочетания которых зависит выбор тактики. Недооценка какого-либо из факторов распространенности приведет к выбору неадекватного
объема оперативного вмешательства. Так, на сегодняш ний день в большинстве лечебныхучреждений при раке дистальной трети желудка чаще всего выполняется дистальная субтотальная резекция желудка. Несмотря на то что данный объем оперативного вмешательства является более функциональным, нежели гастрэктомия, он имеет строгие показания и не должен применяться в ущерб онкологической радикальности.
Показаниями к выполнению дистальной субтоталь ной резекции желудка являются:
•экзофитные формы роста опухоли, без рентгено логических и эндоскопических признаков инфильтративного роста;
•отсутствие перехода на угол желудка (нижняя треть тела);
•отсутствие массивного выхода процесса на серо зную оболочку желудка;
•отсутствие мультицентрических очагов опухоле вого роста в желудке;
•отсутствие интраоперационно выявляемых мета статических лимфатических узлов в паракарди альной области, забрюшинном пространстве, осо бенно по ходу селезеночной артерии, в области чревного ствола, а также в воротах селезенки.
Во всех остальных случаях, с точки зрения онколо гической адекватности, необходимо выполнять гастрэктомию с лимфодиссекцией D2.
В онкохирургии радикальной субтотальной резек цией желудка может считаться лишь удаление 4/5 желудочной стенки с удалением всей малой кривизны до уровня пищеводно-желудочного перехода.
Тот же алгоритм определения допустимости выпол нения более функциональных резекций желудка необ ходимо использовать при раках проксимального отдела. Однако при этом необходимо принимать во внимание тот факт, что опухоли данной локализации чаще, чем рак тела и антрального отдела желудка, характеризу ются экзофитной формой роста. Поэтому лишь этот фактор не следует рассматривать как определяющий при выборе объема резекции. Более важными с про гностической точки зрения являются: наибольший раз мер опухоли, выход процесса на серозную оболочку, наличие лимфогенных метастазов.
Исследования рака проксимального отдела желудка, проведенные в Национальном институте рака (Токио), показали, что проксимальная субтотальная резекция желудка может быть выполнена лишь у пациентов при небольших размерах опухоли, до 4 см в наибольшем измерении, локализующихся в проксимальном отделе без распространения на верхнюю треть тела желуд ка. Причем обязательным является резекция неизме-
562
Хирургическое лечение рака желудка: современные аспекты проблемы
ненной визуально и пальпаторно стенки желудка на 2 см дистальнее определяемой границы опухоли при поверхностностелящемся характере роста, на 3 см при экзофитном и на 5 и более сантиметров при эндофитном и смешанном типах роста. Эти границы являются допустимыми при выполнении радикальной операции. Крайне важным прогностическим фактором являет ся выход процесса на серозную оболочку желудка. Исследования, проведенные японскими авторами, а также опыт работы торако-абдоминального отделения РОНЦ РАМН (Германов А.Б., 1998) позволяют с высокой степенью достоверности отметить, что при выходе
процесса на серозную оболочку желудка необхо димым минимальным объемом операции является комбинированная гастрэктомия со спленэктомией с обязательным выполнением лимфодиссекции D2.
Другим фактором, определяющим противопоказа ние к выполнению проксимальной субтотальной резек ции желудка, являются метастазы в лимфатические узлы, расположенные вдоль правой половины большой кривизны желудка, а также супра- и субпилорические. Эти группы лимфоколлекторов следует рассматри вать как второй этап лимфогенного метастазирования, и, следовательно, они подлежат удалению. Поэтому пальпаторное обнаружение увеличенных лимфатичес ких узлов этих групп при интраоперационной реви зии требует выполнения расширенной гастрэктомии с моноблочным удалением всего связочного аппарата желудка.
Резюмируя вышеизложенные положения, можно отметить, что проксимальная субтотальная резекция желудка может быть выполнена лишь при небольшой опухоли, менее 4 см, локализующейся в проксимальном отделе желудка, без выхода процесса на серозную обо лочку и при отсутствии данных о метастатическом пора жении лимфатических узлов правых отделов большой кривизны, а также супра- и субпилорических. Во всех остальных случаях необходимо выполнять расширен ную комбинированную гастрэктомию.
В случаях распространенного опухолевого процесса при выполнении заведомо паллиативного вмешатель ства с функциональных позиций более оправданным следует считать выполнение проксимальной резекции желудка как более щадящей.
Методы реконструкции после гастрэктомии
В настоящее время крайне актуальным, наряду с отработкой вариантов расширенных вмешательств.
является разработка физиологических методов вос становления непрерывности кишечной трубки, ведь при планировании радикального вмешательства и, сле довательно, улучшения отдаленных результатов лече ния именно фактор функциональной адаптации будет играть ключевую роль.
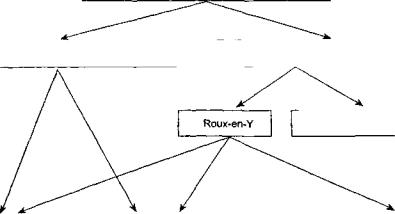
В настоящее время, после длительного этапа отра ботки, в клинической практике широко используются три основные методики реконструкции после гастрэк томии (рис. 4).
1.Петлевая пластика, зачастую сочетающаяся с формированием кишечного резервуара (типа Hunt-Lawrence-Rodino).
2.Формирование эзофаго-энтероанастомоза на отключенной петле по методу Ру (Roux-en-Y reconstruction).
3.Включение в пищеварительный тракт сегментов тонкой или толстой кишки (интерпозиция) на сосудистой ножке, с восстановлением естест венного пассажа пище по двенадцатиперстной кишке либо с созданием тонкокишечного резер вуара.
Выбор метода пластической реконструкции зависит от нескольких факторов, и в первую очередь от ради кальности выполненного вмешательства, а также от индивидуальных особенностей строения брыжейки у каждого пациента и зачастую от личных пристрастий каждого хирурга.
Основными положениями, которым необходимо сле довать, являются возможность наиболее физиологичес кого восстановления кишечного тракта либо минимиза ция такого фактора, как рефлюкс-эзофагит. Однако эти факторы не могут приниматься во внимание в ущерб безопасности пациента.
На основании опыта работы торако-абдоминального отделения мы предлагаем следующие варианты постгастрэктомической пластики.
• При соблюдении всех признаков радикальнос ти, то есть резекции адекватного объема тканей характеру опухоли (с учетом опухолевого роста), и отсутствии признаков диссеминации возможно выполнение реконструкции с интерпозицией сег ментов кишки на ножке с включением двенадцати перстной кишки либо формирование тонкокишеч ных резервуаров,
• При выполнении условно-радикальной операции с учетом распространенности заболевания возмож но выполнение реконструкции по Ру либо выпол нение петлевой пластики.
1 При выполнении паллиативного вмешательства единственно оправданным с точки зрения безо-
563
Оннохирургия
Методы реконструкции после гастрэктомии
С включением двенадцатиперстной кишки Без включения двенадцатиперстной кишки
Петлевая пластика П - loop
Без резервуара |
С формированием резервуара |
Uncut Roux (Резервуар их О - loop) |
Рис. 4. Методы реконструкции после гастрэктомии
пасности и прогнозируемого периода жизни явля ется выполнение петлевой впередиободочной пластики.
На основании опыта хирургического лечения рака желудка и анализа непосредственных и отдаленных результатов можно констатировать, что:
• рак желудка характеризуется ранним лимфогенным метастазированием в регионарные лимфати ческие узлы уже при прорастании опухоли в подслизистый слой, появлением прыгающих метаста зов в лимфатические коллекторы 2-х и 3-х этапов метастазирования;
• достоверное стадирование распространенности процесса возможно лишь при выполнении лимфодиссекции 02 (минимально допустимый объем диссекции) с обязательным исследованием уда ленного препарата на основании схемы этапности лимфогенного метастазирования различных отде лов желудка;
• отработка элементов расширенных операций, а также оптимизация ведения послеопераци онного периода позволяют значительно снизить послеоперационные осложнения и летальность
в группе расширенных операций;
•увеличение объема хирургического вмешательс тва за счет расширения границ выполняемой дис секции позволяет улучшить отдаленные резуль таты, преимущественно за счет локализованных стадий заболевания.
Во многих случаях, например при широком лимфогенном метастазировании с поражением забрюшинных лимфоколлекторов, большой площади выхода процесса на серозную оболочку желудка, некоторых формах роста опухоли (диффузно-инфильтративный рак типа linitis plastica — Боррманн IV) выполнение лимфодиссекции D2 не улучшает отдаленные результаты лечения. Эти больные быстро погибают на фоне локорегионарного прогрессирования процесса в забрюшинных парааортальных лимфоколлекторах, внутрибрюшного рецидива либо генерализации с поражением отдален ных органов. Некоторое улучшение результатов лече ния в этой группе больных возможно при выполнении расширенно-комбинированных операций с принципи альной превентивной комбинированной резекцией и даже эвисцирацией органов верхнего этажа брюшной полости с выполнением расширенной забрюшинной и парааортальной лимфодиссекции D3.
В последнее время в литературе встречаются пуб ликации об эффективности комбинированного подхода в лечении рака желудка. Так, на IV Международном конгрессе по раку желудка (2001) были представлены данные об улучшении безрецидивной и общей выжи ваемости при проведении послеоперационной химиолучевой терапии рака желудка после радикального и условно радикального хиругического лечения R0. Однако, по мнению самих авторов, основным принци пиальным компонентом комбинированной схемы
лечения является хирургический метод, который дол-
564
ирургическое лечение рака желудка: современные аспекты проблемы
жен выполняться с удалением зон регионарного лимфогенного метастазирования D2. Это положение является ключевым при планировании комбинированных про токолов, ведь общий успех во многом, если не во всем, определяется основным компонентом, позволяющим провести радикальное лечение, — хирургическим.
Все вышеизложенные факты позволяют рассмат ривать операции в объеме D2 как стандартные вмеша
тельства в хирургическом лечении рака желудка. После отработки методологии выполнения расширенных опе раций и тактики ведения послеоперационного периода целесообразным следует считать проведение проспек тивных рандомизированных исследований в достовер ных группах больных с целью выявления преимуществ и недостатков различных вариантов расширенных и расширенно-комбинированных операций.
565
РАДИКАЛЬНОЕ ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ РАКА ГРУДНОГО ОТДЕЛА ПИЩЕВОДА
А.Ф. Черноусое, Д.В. Ручкин
Злокачественные опухоли пищевода составляют 1,5—2% всех новообразований человеческого орга низма. Рак пищевода (РП) в структуре онкологических заболеваний желудочно-кишечного тракта занимает 7-е место, его доля составляет 5—7%. За последние два десятилетия тенденции к снижению заболеваемости РП не отмечено, в России она составляет в среднем 7 слу чаев на 100 тыс. населения.
В связи с совершенствованием технического обеспе чения вмешательств, успехами анестезиологии и реани матологии тактика лечения РП за последние 10—15 лет существенно изменилась— значительно расширились показания к радикальным и реконструктивным вмеша тельствам, а многоэтапные операции на пищеводе усту пили место одномоментным. Как альтернатива внутриплевральным резекциям пищевода широко применяется (суб)тотальная эзофагопластика.
Вмешательства на пищеводе относятся к одному из сложнейших разделов хирургии. Их выполнение требует не только знания сложной анатомии этого органа, но и владения современными принципами и приемами опериро вания. Сегодня считаются практически решенными основ ные технические и тактические аспекты эзофагопластики: выбор трансплантата, пути его проведения, способ форми рования пищеводного или глоточного соустья.
Современные исследования направлены на опти мизацию и стандартизацию объема радикальных вме шательств при РП. Дальнейшее улучшение результатов хирургического лечения больных РП связывают не толь ко с внедрением новых способов его ранней диагнос тики, например эндоскопической ультрасонографии, но и с разработкой оперативных методик, повышающих радикальность вмешательств, каковой и является рас ширенная регионарная лимфаденэктомия (ЛАЭ).
История хирургии пищевода
Хирургия пищевода весьма сложна и интересна, по количеству накопленного опыта являет собой одну из богатейших страниц истории мировой хирургии. Ее родоначальником по праву считается русский хирург
И.И. Насилов, разработавший технику дорсальной медиастинотомии и опубликовавший в 1888 г. свою известную работу «Эзофаготомия и иссечение пищево да внутри груди». В 1895 г. итальянский хирург Biondie доложил об иссечении кардиального отдела желудка вместе с нижним отрезком пищевода с прямым эзофагофундоанастомозом у собаки.
В1896 г. Levy разработал в эксперименте методику шейно-медиастинального туннелирования — выделе ния пищевода со стороны шеи и через разрез в диа фрагме. Этот метод впервые с благоприятным исходом был применен в СССР К.П. Сапожковым в 1929 г. За рубежом в 1933 г. Turner сообщил о первой успеш ной экстирпации пищевода из абдоминоцервикального доступа. Дальнейшее внедрение трансхиатальных вмешательств проведено А.Г. Савиных (1949), который выполнял широкую диафрагмотомию и удалял пищевод вплоть до шеи.
В1900 г. опубликована статья томского хирурга В.Д. Добромыслова, в которой он предложил разра ботанные в эксперименте чресплевральный доступ к пищеводу и методику его резекции. В 1908 г. Voelcker впервые произвел успешную трансабдоминальную резекцию кардии. В 1913 г. Torek впервые в клиничес ких условиях успешно выполнил удаление грудного отдела пищевода при раке.
Стоит заметить, что способы эзофагопластики созда вались практически одновременно с методиками резек ций пищевода и развивались в дальнейшем параллельно с ними. На протяжении XX столетия четко прослежива ются четыре основных направления реконструктивной хирургии пищевода, соответствующие используемому пластическому материалу — коже, тонкой и толстой кишке, желудку.
Bircher в 1894 г. создал на передней грудной стенке кожную трубку от шеи до эпигастральной области, дистальный конец которой вшил в желудок. Операция осталась незавершенной, т.к. пациент погиб от прогрессирования опухоли. Позднее кожная вставка исполь зовалась при недостаточной длине трансплантата. Сегодня от этого вида пластики полностью отказались в связи с частым рубцеванием и малигнизацией кожных фрагментов.
566
Радикальное хирургическое лечение рака грудного отдела пищевода
Тонкокишечная эзофагопластика была после довательно разработана тремя известными хирурга ми — Roux (1907), П.А. Герценом (1907) и С.С. Юдиным (1928) — и с тех пор носит их имя. Эта операция, широко распространенная в 1940—1950-х годах, в настоящее время находит применение лишь в тех случаях, когда для создания нового пищевода невозможно использо вать желудок или толстую кишку. Основными недостат ками тонкой кишки являются ее низкая устойчивость к гипоксии, сложность сосудистой архитектоники, исход ное наличие избыточных петель, трудоемкость форми рования трансплантата.
Первую попытку осуществить толстокишечную эзофагопластику у больной с РП предпринял в 1911 г. Kelling. В 1913 г. успешную пластику пищевода тол стой кишкой выполнил Hacker. Разработкой этого вида вмешательств занимались Orsoni, Toupet (1950), П.И. Андросов (1957), Б.А. Петров (1957), В.И. Попов (1957). В настоящее время колоэзофагопластика доста точно широко распространена. Мы не рассматриваем ее как альтернативу желудочной пластике, а применяем при непригодности желудка или в качестве загрудинного шунта при нерезектабельном РП.
Экспериментальная идея создания антиперисталь тической трубки из большой кривизны желудка в
виде питательной стомы с основанием в области кардиофундального отдела принадлежит Depage, Beck и Carrel (1905). В 1911 г. Hirsch предложил использовать желу дочную трубку для создания искусственного пищевода. В 1912 г. Jianu и Ю.Я. Гальперин независимо друг от друга предложил и формировать антиперистальтическую трубку из большой кривизны желудка с питанием на левой желу- дочно-сальниковой артерии. Именное название эта опе рация приобрела после того, как была усовершенствована Gavriliu (1951) и Heimlich (1955). Антиперистальтическая желудочная эзофагопластика исключает возможность удаления кардии и малой кривизны желудка, поэтому ее применение ограничено как несоответствующей принци пам онкологического радикализма.
В 1920 г. Kirschner предложил создавать пищевод за счет предгрудинного перемещения всего желудка с одномоментным соустьем его дна с шейной час тью пищевода. Доработка этой операции произведена Nakaiama (1974). Очевидно, что более перспективной оказалась идея использования расщепленного желу дочного лоскута с основанием в антральном отделе, принадлежащая Rutkowski (1923). Тремя десятилетиями позже Lortat-Jacob (1949) поместил эту трубку в заднее средостение и соединил с резецированным пищеводом. Boerema (1951) доказал возможность формирования соустья между желудочным трансплантатом и собс
твенным пищеводом на любом уровне вплоть до глотки. Но тогда эта операция широкого распространения не получила из-за отсутствия сшивающих аппаратов и необходимости накладывать большое количество руч ных швов.
Значительной вехой в развитии желудочной эзофагопластики явилось внедрение трансторакальных резекций пищевода. Последовательно Ohsawa (1933), Garlock (1937) и Sweet (1942) выполнили многочис ленные успешные резекции грудного отдела пищевода из левостороннего чресплеврального доступа с одно моментной эзофагогастростомией. В 1946 г. Lewis no поводу РП произвел успешную серию резекций ком бинированным доступом — из лапаротомии и право сторонней торакотомии. McManus в 1950 г. предложил выполнять эту операцию одномоментно.
Совершенствование способов одномоментных резекций пищевода в 1950-е годы неразрывно свя зано с именами представителей российской школы хирургов: А.А. Русанова, С.С. Юдина, Б.В. Петровского, П.И. Андросова, А.Г. Савиных, Е.Л. Березова. В России первую успешную резекцию кардии и нижней трети пищевода с одномоментным наложением внутриплеврального пищеводно-желудочного соустья выполнил Б.В. Петровский в 1946 г. В.И. Казанский первым среди отечественных хирургов в 1945 г. успешно экстирпировал пищевод по Добромыслову—Тореку. Развитие желу дочной эзофагопластики в 1960—1970-е гг. продолже но трудами многих отечественных и зарубежных хирур гов: В.И. Попова и В.И. Филина (1965); Э.Н. Ванцяна и O.K. Скобелкина (1975); Matsumoto (1965); Kakegawa (1973); Akiyama (1974), доказавших на практике воз можность одномоментного пластического замещения пищевода после его (суб)тотальной резекции.
Применение в 1940—1960 гг. травматичных вмеша тельств при РП ознаменовалось высокой летальностью, достигавшей 30—40%, и низкой пятилетней выживае мостью — 6—8%. Объяснимо внимание хирургов к таким малотравматичным вмешательствам, как трансхиатальная эзофагэктомия, дающим неплохие непосредственные результаты. Законченный вариант экстирпации пищевода с одномоментной пластикой желудочной трубкой явился логическим завершением предложенных ранее методик Kirschner—Nakaiama и Rutkowsky—Boerema. Он был тех нически доработан и внедрен в отечественную клини ческую практику B.C. Сильвестровым и А.Ф. Черноусовым в конце 1970-х начале 1980-х гг. Наибольшим опытом применения данного вмешательства за рубежом облада ли Stelzner (1981) и Oringer (1983).
История хирургии пищевода неразрывно связана с историей ЛАЭ, т.е. методики удаления регионарных лим-
567
Оннохирургия
фоузлов. В 1894 г. Halsted сообщил о первых положи тельных результатах радикальной мастэктомии с удале нием подмышечных и надключичных лимфоузлов. Miles в 1908 г. впервые предложил выполнять ЛАЭ в хирургии органов брюшной полости: при брюшно-промежност- ной экстирпации прямой кишки. Еще в 1916 г. Moym'han утверждал, что точное знание лимфатической системы органов является основой оперативного лечения опухо лей и во многом определяет его успех. Некоторых больных с метастазами удавалось излечить путем хирургического удаления пораженных лимфоузлов. О первом таком боль ном, благополучно перенесшем одномоментную эзофагэктомию с эзофагогастроанастомозом, доложили Adams и Phemister в 1938 г. Пациент прожил более 15 лет.
С момента основания Японского общества по изуче нию болезней пищевода (JSED) в 1965 г. и публикации
в1969 г. «Руководства по клиническому и патологичес кому изучению рака пищевода» ЛАЭ при эзофагэктомии стала применяться в Японии. В других странах эта методика вплоть до середины 80-х гг. не была широко распространена, что объяснялось ее технической слож ностью и угрозой тяжелых послеоперационных ослож нений. Но Nakayama (1962) и Logan (1963) уже тогда отстаивали важность медиастинальной и чревной ЛАЭ при РП. Logan впервые сообщил о выполнении резекции «en bloc» при дистальном РП и кардии. Он достиг пятилетней выживаемости 16% при высокой послеопераци онной летальности — 21%.
Вконце 1970-х гг. широкое распространение сначала
вЯпонии, а затем в США и в странах Западной Европы получили различные методики расширенных хирургических вмешательств при РП, включающих ЛАЭ. Тогда же, поданным JSED, резектабельность достигла 68%, а летальность снизи лась до 6,8%, при возросшей до 26% пятилетней выживае мости. Только с начала 1980-х гг. в европейских клиниках стали улучшаться результаты хирургического лечения РП, что выражалось в снижении послеоперационной леталь ности с 29 до 13% и повышении пятилетней выживаемости
с4 до 20%. Положительную роль в этом процессе сыграла дальнейшая разработка Skinner (1983,1991) приемов транс торакальной резекции пищевода «en bloc». Эта методика предполагала иссечение клетчатки средостения единым блоком с пораженным пищеводом. Таким образом ликви дировались не только пораженные лимфоузлы, но и периэзофагеальные ткани с микроскопическими опухолевыми эмболами. Технические приемы этой операции легли в осно ву современной методики медиастинальной ЛАЭ.
публикация Akiyama (1981) «Принципы хирургическо го лечения рака пищевода», в которой были описаны приемы двухзональной (торакоабдоминальной) ЛАЭ, выполнявшейся авторами с 1973 г. Был четко определен стандартный объем ЛАЭ в животе и доказано улучшение выживаемости после ее выполнения.
В период с 1962 по 1981 г. в Японии рутинной проце дурой являлось удаление вместе с пищеводом средних
инижних медиастинальных и абдоминальных лимфоуз лов. Пятилетняя выживаемость достигала 20%. В 1982 г., после изучения данных лимфосцинтиграфии пищевода
ихарактера рецидивов, зона ЛАЭ была расширена и на верхнее средостение. Sannohe в 1981 г. сообщил о первых результатах трехзональной (цервикоторакоабдоминальной) ЛАЭ, выполняемой им в течение 5 лет. Эта публикация поменяла взгляд на шейное метастазирование как на отдаленное и неизбежно приводящее к фатальному исходу. С этого момента шейная ЛАЭ стала применяться как стандартная методика. Так, Nashimaki выполняет трехзональную ЛАЭ при РП с 1982 г., Isono и Koide — с 1983 г., Akiyama — с 1984 г., Ando — с 1986 г. Среди европейских ученых расширенную ЛАЭ практику ют Lerut (1991), Collard (1995), Fraunberger (1996), Meyer (1996), Altorki и Skinner (1997), Jakab (1997).
Более чем 20-летний опыт использования методики ЛАЭ в Японии свидетельствует, что при раннем выявле нии опухоли с последующей радикальной операцией пятилетняя выживаемость достигает 70—80%. Тем не менее методика широкой ЛАЭ имеет своих оппонентов, указывающих на ее высокую трудоемкость и травматичность, а также бесперспективность в плане продления жизни пациентов (Orringer, 1993). Дискуссия по этому вопросу не утратила своей актуальности и сейчас.
Патогенез рака пищевода
Этиология
Мужчины болеют РП чаще женщин в соотношении 5 : 1 . Помимо известных факторов риска РП, таких, как наследственность, возраст старше 50 лет, особенности питания (острая, горячая и грубая пища), вредные при вычки (курение, алкоголь), хронические заболевания пищевода (ожоговые и пептические рубцовые стриктуры, кардиоспазм, грыжи пищеводного отверстия диафрагмы, дивертикулы), особое внимание уделяют патологическо му состоянию, именуемому «пищеводом Барретта».
В 1976 г. Kinoshita сообщил о значении лимфоузлов вдоль возвратных нервов и области шейно-грудного перехода как зоны интенсивного метастазирования. Основополагающей работой по методике ЛАЭ явилась
Сегодня под пищеводом Барретта понимают при обретенное состояние, являющееся осложнением реф- люкс-эзофагита и развивающееся в результате замещения разрушенного плоского эпителия нижней части пище-
568
Радикальное хирургическое лечение рана грудного отдела пищевода
вода специализированным цилиндрическим эпители ем. Специализированный цилиндрический эпителий представляет собой морфологический субстрат пищевода Барретта и является результатом метаплазии субмукозных стволовых клеток в пищеводе, которые трансформируются в цилиндрические клетки после выраженного повреж дения слизистой. Пищевод Барретта, в отличие от дру гих доброкачественных осложнений рефлюкс-эзофагита, имеет иной прогноз. Трансформация цилиндрического
эпителия в рак представляет собой единый неопласти ческий процесс, последовательно проходящий стадии метаплазии, дисплазии и аденокарциномы. По разным данным, частота развития аденокарциномы на фоне пище вода Барретта возрастает в 30—125 раз.
Современная классификация
Стадирование РП в настоящее время проводится в соот ветствии сдействующими патологоанатомическим и клини ческим вариантами TNM-классификации Международного противоракового союза (UICC) от 1989 г.
Современная техническая оснащенность ведущих клиник позволяет на диагностическом этапе диффе ренцировать «ранний» и «поздний» РП на основании критерия местной распространенности опухолевого процесса — глубины инвазии — и определять адек ватную тактику хирургического лечения. Ранним счи тают внутрислизистый РП, который во всей группе оперированных нами больных был выявлен только в 1% случаев. Опухоли, выходящие за пределы слизистой, относят к позднему РП. Так, у 99% наших больных диа гностирован поздний рак, причем у 1/3 из них опухоль распространялась за пределы пищевода и прорастала в соседние органы и структуры (III—IV стадия).
Сегодня назрела необходимость пересмотра дейс твующей TNM-классификации РП. Мы разделяем мнение зарубежных коллег, что глубокие шейные лимфоузлы
следует считать регионарными для грудного отдела пищевода, так же как чревные, входящие сегодня в М-компонент. Основанием этому служит одинаковая выживаемость пациентов с метастатическим пораже нием данных узлов и без такового после радикального вмешательства с трехзональной ЛАЭ. Хотя прогноз при поражении шейных и глубоких забрюшинных узлов оста ется неблагоприятным.
Неясно, может ли считаться радикальной операция, выполненная по поводу РП с М,-компонентом, и показа на ли она вообще в таком случае? На самом деле, отда ленное метастазирование не всегда считают противопо казанием к проведению радикального вмешательства. Операция, дополненная расширенной регионарной ЛАЭ
с удалением пораженных чревных узлов, может соот ветствовать всем критериям радикальности. Поэтому на практике перигастральные и чревные лимфатические коллекторы мы рассматриваем как регионарные для грудного отдела пищевода.
Канцерогенез (локализация, распространенность,
гистологическое строение, метастазирование)
У подавляющего большинства больных (80%) опу холи локализуются в средне- и нижнегрудном отделах пищевода. Частота шейного РП не превышает 10—15%. В 5—8% случае опухоли переходят на кардиальный отдел и малую кривизну желудка. В 90% случаев — это плоскоклеточный рак различных степеней дифференцировки, в 5%— аденокарцинома, располагающаяся как правило в нижней трети пищевода. Редко находят диморфные опухоли, лейомиосаркомы, лимфомы.
Заслуживает внимания классификация морфологическихтипов (форм) РП (Akiyama, 1992), имеющих прог ностическое значение: I тип — экзофитный; II тип — изъязвление с ровными краями; III тип — изъязвление \ с неровными краями; IV тип — поверхностный; Утип — эндофитный; VI тип — эндофитное образование. Кроме того, выделяют солитарный РП — в виде единичного I опухолевого очага и мультифокальный рак, представ ленный несколькими первичными фокусами опухолево го роста.
Отдаленные метастазы поражают печень (32%), легкие (21%) и кости (8%).
Общая частота лимфогенного метастазирования РП колеблется в интервале от 34 до 85%.
Метастатическое поражение регионарных лимфо узлов при РП — основной прогностический фак тор, оказывающий большее влияние на отдаленные результаты лечения, чем протяженность опухоли или глубина инвазии стенки органа.
Выделяют три анатомических региона лимфооттока пищевода — цервикальный, медиастинальный и абдо минальный. Под регионарными лимфоузлами понима ют группу узлов, в которые наряду с прямым лимфооттоком происходит прямое лимфогенное метастазирование опухоли. Метастазы в абдоминальных лимфоузлах при РП обнаруживаются с частотой 40—50%, в медиастинальных — 60—65%, в шейных — 25—30%.
Особенность лимфатической системы пищевода состоит в том, что в подслизистом и адвентициальном слоях органа располагаются крупные лимфатические
569
Оннохирургия
коллекторы, обеспечивающие преобладание продоль ного лимфооттока над сегментарным. Отсюда раннее, активное и часто интрамуральное (до 30%) метастазирование РП. Частоту лимфогенного метастазиро-
вания в большей степени определяет не размер опухоли, а глубина инвазии стенки пищевода. По мере прорастания стенки органа частота поражения регионарных лимфоузлов растет. Лишь при внутриэпителиальном РП не находят метастазов, но при врастании опухоли в слизистый и подслизистый слои лимфоузлы вовлекаются в 14 и 58% случаев соответственно.
Несмотря на то что лимфогенное метастазирование у пациентов с подслизистым распространением РП пред ставляет собой раннюю фазу опухолевой диссеминации, экстрамедиастинальныеузлы живота и шеи поражаются при этом достаточно часто. При изучении лимфогенного метастазирования РП появление отсевов зарегистри ровано уже при опухолях, врастающих в собственную мышечную пластинку слизистой оболочки.
Основная направленность и интенсивность метаста зирования детерминирована локализацией первичного очага. Тем не менее специальные исследования пока
зали, что регионы лимфооттока едины для всего пищевода и могут вовлекаться при любой локали зации опухоли, т.е. отсутствует последовательность
и избирательность их поражения. При раке нижне грудного отдела пищевода метастазы в лимфоузлах шеи выявляются в 15—20% наблюдений.
Парадоксальный характер лимфогенной диссемина ции РП состоит в преимущественном поражении не бли жайших к первичному очагу узлов, а удаленных от него. Свидетельством тому является высокая частота «прыга ющего» метастазирования, достигающая 30%. Поэтому нет порядкового разделения регионарных лимфоузлов по мере их удаления от основного очага, как при раке желуд ка. В настоящее время во многих клиниках мира при РП используют классификацию регионарных и отдаленных групп лимфоузлов, принятую 3SED (1978).
Алгоритм диагностики рака пищевода
Стандартный алгоритм инструментальной диагнос тики РП включает:
*полипозиционную рентгенографию пищевода с двойным контрастированием;
•эзофагоскопию с «Lugol-spray» — методом и био псией, которая позволяет при наличии повреждения слизистой поставить правильный диагноз в 100% случаев;
• УЗИ брюшной полости (с целью визуализации оча гового поражения печени, абдоминальных лимфо узлов, асцита).
При поражении грудного отдела пищевода на уровне бифуркации трахеи и выше показана бронхоскопия с целью исключения инвазии трахеобронхиального дере ва. В ряде случаев полезная информация о распростра ненности РП может быть получена при компьютерной томографии, которая выявляет медиастинальную инфиль трацию и поражение лимфоузлов в бб—80% случаев.
Весьма перспективным представляется внедрение в клиническую практику эндоскопической ультрасонографии, представляющей собой внутрипросветное УЗИ стенки пищевода при помощи специального дат чика, закрепленного на эндоскопе. Эта диагностичес кая методика широко распространена за рубежом и позволяет точно определять глубину инвазии стенки в 83—86% и поражение медиастинальных лимфоузлов в 60—76% случаев.
Принципы хирургического лечения рака пищевода
Низкая чувствительность РП к химиопрепаратам, паллиативный и кратковременный эффект лучевой терапии делают хирургическое вмешательство методом выбора. Современная агрессивная стратегия опе
ративной онкологии органов желудочно-кишечно го тракта состоит в максимизации хирургического воздействия на опухоль— радикальном удалении первичного очага роста с широкой диссекцией реги онов метастазирования.
Ключевые моменты оперативного вмешательства
Согласно данным современных публикаций, боль шинство практикующих хирургов придерживаются мне ния, что с онкологических позиций радикальная опера ция при РП должна отвечать следующим требованиям.
1.Быть одномоментной, т.е. включать как ради кальный, так и реконструктивный этапы. Сегодня нет таких больных, которые не могут быть по каким-либо причинам оперированы одномоментно. Следовательно,
обладая рядом неоспоримых преимуществ, одномо ментные вмешательства не имеют принципиальных противопоказаний.
2.Удалять пищевод следует целиком при раке вер хнегрудного отдела пищевода (тотальная резекция, эзофагэктомия) или выполнять субтотальную резек-
570
