
- •Вопрос 9. Терапевтическая школа г.А. Захарьина.
- •Вопрос 1. Значение основных разделов анамнеза для диагностики.
- •Вопрос 2. Схема последовательности собирания анамнеза.
- •Вопрос 3. Активные и «пассивные» жалобы.
- •Вопрос 4. Значение анамнеза болезни
- •Вопрос 5. Опрос по системам.
- •Вопрос 6. Основные вопросы при расспросе истории жизни.
- •7. Этические аспекты расспроса больного
- •Вопрос 1. Понятие «общее состояние больного», его разновидности, критерии тяжести.
- •Вопрос 2. Сознание.
- •Вопрос 3. Разновидности положения больного, их характеристика.
- •Вопрос 4. Телосложение. Конституциональные типы.
- •Вопрос 5. Осмотр головы, лица, шеи.
- •Вопрос 6. Осмотр кожных покровов и видимых слизистых.
- •Вопрос 7. Оценка степени питания обследуемого.
- •Вопрос 8. Пальпация лимфатических узлов.
- •Вопрос 9. Осмотр и ощупывание мышц, костей, суставов.
- •2.Характеристика и причина болей в области сердца.
- •3.Причины и особенности одышки у больных с заболеванием сердца.
- •4.Характеристика сердцебиения, перебоев в работе сердца, кашля, кровохарканья.
- •5.На какие вопросы следует обратить внимание при сборе анамнеза болезни и жизни.
- •6.Особенности положения больных, изменение окраски кожи и видимых слизистых, локализация и характеристика отеков.
- •7.11Методика определения верхушечного толчка, свойства верхушечного толчка и причины изменений.
- •8.Систолическое и диастолическое “кошачье мурлыканье”. Причины симптома и методика определения.
- •Вопрос 1. История перкуссии, как метода физикального обследования пациента.
- •Вопрос 2. Физическое обоснование перкуссии.
- •Вопрос 3. Методика и техника перкуссии.
- •Вопрос 4. Топография органов грудной клетки и проекция их на переднюю грудную стенку.
- •Вопрос 5. Правила перкуссии сердца
- •Вопрос 6. Порядок перкуссии сердца.
- •Вопрос 7. Методика определения границ отс.
- •Вопрос 8. Методика определения границ атс.
- •Вопрос 9. Методика определения ширины сосудистого пучка.
- •Вопрос 10. Методика определения правого и левого радиуса поперечника сердца.
- •Вопрос 1. Методика определения границ сердечно-сосудистого контура.
- •Вопрос 2. Методика определения «талии» и конфигурации сердца.
- •Вопрос 3. Перкуторная диагностика гипертрофии миокарда левого желудочка.
- •Вопрос 4. Перкуторная диагностика дилатации левого желудочка.
- •Вопрос 5. Перкуторная диагностика дилатации левого предсердия.
- •Вопрос 6. Перкуторная диагностика дилатации правого желудочка..
- •Вопрос 7. Перкуторная диагностика гидроперикарда.
- •Вопрос 8. Изменение данных перкуссии сосудистого пучка в патологии
- •Вопрос 1. Кинематика сердца. Фазы систолы и диастолы.
- •Вопрос 2. Компоненты I и II тонов, механизм возникновения III и IV тонов.
- •Вопрос 3. Причины усиления и ослабления тонов сердца. Причины усиления и ослабления I тона.
- •Вопрос 4. Причины ослабления и усиления (акцент) II тона.
- •Вопрос 5. Расщепление, раздвоение тонов сердца.
- •Вопрос 6. Трехчленные ритмы. Ритм галопа, его разновидности. Причины возникновения.
- •Вопрос 7. Трехчленный ритм «перепела». Причины возникновения.
- •Вопрос 8. Проекция клапанов на переднюю грудную стенку, точки выслушивания клапанов сердца.
- •Вопрос 9. Методика аускультации сердца по правилу «солнышка», отличия I и II тонов, характеристика III, IV тонов при аускультации.
- •Вопрос 10. Характеристика аускультативной картины сердца у здорового человека.
- •Вопрос 1. Определение шумов сердца. Гемодинамические механизмы возникновения шумов в сердце.
- •Вопрос 2. Классификация шумов сердца. Характеристика при аускультации.
- •Вопрос 3. Органические шумы сердца. Механизм возникновения.
- •Вопрос 4. Характеристика систолического шума при митральной регургитации.
- •Вопрос 5. Характеристика систолического шума при аортальном стенозе.
- •Вопрос 6. Характеристика диастолического шума при митральном стенозе.
- •Вопрос 7. Характеристика диастолического шума при аортальной регургитации.
- •Вопрос 8. Шум трения перикарда, характеристика, особенности аускультации.
- •Вопрос 9. Функциональные шумы, причины, классификация, особенности аускультации, характеристика.
- •Вопрос 10. Шумы относительной недостаточности клапанов.
- •Вопрос 11. Функциональная аускультация. Дифференциальная диагностика шумов.
- •Вопрос 1. Последовательность осмотра и пальпации артерий, перечень характеристик получаемых при исследовании артерий.
- •Вопрос 2. Пульс на лучевых артериях, его свойства: симметричность величины, ритм, частота, напряжение, наполнение, высота, форма.
- •Вопрос 3. Значение свойств пульса на лучевых артериях при патологии.
- •Вопрос 4. Свойства сосудистой стенки, ее изменение в патологии.
- •Вопрос 5. Понятие об артериальном давлении, физиологические основы его возникновения.
- •Вопрос 6. Среднее, пульсовое, основное и случайное артериальное давление.
- •Вопрос 7. Принцип метода измерения артериального давления.
- •Вопрос 9. Методика непрямого измерения артериального давления.
- •Вопрос 10. Значение самоконтроля артериального давления, измерение артериального давления на дому.
- •Вопрос 11. Мониторирование артериального давления, значения нормы, показания для проведения.
- •II. Раздел по проблеме стеноза митрального отверстия ( синдром митральной обструкции ).
- •Вопрос 1. Анатомо-функциональные особенности кровоснабжение миокарда.
- •Вопрос 2. Патоморфология атеросклеротического поражения сосудов.
- •Вопрос 3. Определение ибс.
- •Вопрос 4. Определение и патогенез синдрома стабильной стенокардии напряжения.
- •Вопрос 5. Значение анамнеза для выявления факторов риска атеросклротического поражения коронарных сосудов.
- •Вопрос 6. Особенности болевого синдрома при стабильной стенокардии напряжения.
- •Вопрос 7. Дифференциальная диагностика с другими клиническими состояниями, проявляющиеся болью в грудной клетке.
- •Вопрос 8. Значение физиального обследования сердечно-сосудистой системы у больных ибс.
- •Вопрос 9. Принципы лабораторной и инструментальной диагностики при синдроме стенокардии напряжения.
- •Вопрос 10. Функциональные классы при стабильной стенокардии напряжения.
- •Вопрос 1. Определение окс, нс и им.
- •Вопрос 2. Патоморфологию и патогенез нс и им.
- •Вопрос 3. Классификацию нс по e. Braunwald .
- •Вопрос 4. Особенности клинических проявлений различных форм нс.
- •Вопрос 5. Принципы лабораторной и инструментальной диагностики нс.
- •Вопрос 6. .Классификация им.
- •Вопрос 7. Симптоматология им.
- •Вопрос 8. Лабораторная и инструментальная диагностика им.
- •Вопрос 9. Первая догоспитальная помощь при подозрении на окс.
- •Вопрос 1. Виды недостаточности кровообращения.
- •Вопрос 3. Клиника острой левожелудочковой недостаточности.
- •Вопрос 4. Причины, клиника острой правожелудочковой недостаточности.
- •Вопрос 5. Клиника острой правожелудочковой недостаточности.
- •Вопрос 7. Лабораторно-инструментальная диагностика при синдроме осн.
- •Вопрос 8. Сосудистая недостаточность. Разновидности, краткая характеристика.
- •Вопрос 1. Определение хронической сердечной недостаточности. Причины хронической сердечной недостаточности.
- •Вопрос 2. Хроническая сердечная недостаточность. Жалобы, данные объективного обследования.
- •Вопрос 3. Классификация хронической сердечной недостаточности по стадиям.
- •Вопрос 4. Классификация хронической сердечной недостаточности функциональным классам.
- •Вопрос 5. Патогенез хронической сердечной недостаточности.
- •Вопрос 6. Лабораторная диагностика при синдроме хсн.
- •Вопрос 7. Инструментальная диагностика при синдроме хсн.
- •1.Причины и предраспологающие факторы острого простого и хронического гастритов.
- •2.Симптоматология простого острого гастрита.
- •3.Симптоматология хронического гастрита.
- •4.Особенности клинической симптоматологии хронического гастрита в зависимости от секреторной функции желудка.
- •5.Особенности болевого синдрома при язвенной болезни и его зависимость от локализации язвы в желудке или 12перстной кишке.
- •6.Осложнения язвенной болезни.
- •7.Симптоматология рака желудка.
- •8.Значение рентгеноскопии, фиброгастроскопии в диагностике гастритов, язвенной болезни и рака желудка.
- •9. Лабораторная диагностика при гастритах, язвенной болезни и раке желудка.
- •Вопрос 1. Анатомические особенности почек.
- •Вопрос 2. Строение и функция нефрона.
- •Вопрос 3. Функции почек.
- •Вопрос 4. Основные жалобы больных с заболеванием почек и мочевыводящих путей.
- •Вопрос 5. Факторы, предшествующие заболеванием почек и мочевыводящих путей.
- •Вопрос 6. Данные осмотра больных с заболеванием почек и мочевыводящих путей.
- •Вопрос 7. Особенности почечных отеков и их отличие от отеков другого происхождения.
- •Вопрос 8. Симптом сотрясения поясничной области и его патогенетическое значение.
- •Вопрос 9. Перкуссия мочевого пузыря. Диагностическое значение.
- •Вопрос 10. Проникающая пальпация мочеточниковых и почечных точек. Диагностическое значение.
- •Вопрос 1. Общий анализ мочи: особенности проведения анализа, критерии нормы, диагностическая ценность.
- •Вопрос 2. Анализ мочи по Нечипоренко: особенности проведения анализа, критерии нормы, диагностическая ценность.
- •Вопрос 3. Анализ мочи по Зимницкому, особенности проведения анализа, критерии нормы, диагностическая ценность.
- •Вопрос 4. Бактериоскопическое и бактериологические методы исследования мочи. Особенности проведения анализа, критерии нормы, диагностическая ценность.
- •Вопрос 6. Ультразвуковая диагностика в нефрологии. Особенности метода, показания для исследования, критерии нормы. Диагностическое значение.
- •Вопрос 1. Перечислить проявления мочевого синдрома.
- •Вопрос 2. Раскрыть патогенез почечных отеков.
- •Вопрос 3. Понятие о нефротическом синдроме, его основных проявлениях, патогенез, клиническое проявление.
- •Вопрос 4. Почечная артериальная гипертензия – как форма симптоматической артериальной гипертензии. Патогенез. Клинические, лабораторно-инструментальные особенности почечной артериальной гипертензии.
- •Вопрос 5. Патогенез почечной эклампсии. Клинические проявления.
- •Вопрос 6. Опн. Патогенез, клиника, стадии опн.
- •Вопрос 7. Хпн. Патогенез, клиника, стадии хпн.
- •Вопрос 1. Что понимается под острым гломерулонефритом, какие заболевания ему предшествуют.
- •Вопрос 2. Синдромный диагноз при остром гломерулонефрите. Данные объективного обследования.
- •Вопрос 3. Лабораторно-инструментальная диагностика при остром гломерулонефрите.
- •Вопрос 4. Клинические варианты хронического гломерулонефрита. Особенности мочевого синдрома в зависимости от клинического варианта хронического гломерулонефрита.
- •Вопрос 5. Значение лабораторных и инструментальных методов исследования при хроническом гломерулонефрите.
- •Вопрос 6. Что понимается под острым пиелонефритом. Жалобы, данные объективного обследования. Синдромный диагноз.
- •Вопрос 1. Какие железы входят в эндокринную систему, понятие о гипоталямо-гипофизарной оси.
- •Вопрос 2. Жалобы, объективное обследование пациентов с гиперфункцией щитовидной железы.
- •Вопрос 3. Объективное обследование пациентов с гиперфункцией щитовидной железы.
- •Вопрос 4. Жалобы, объективное обследование пациентов с гипофункцией щитовидной железы.
- •Вопрос 5. Понятие о тиреотоксическом кризе.
- •Вопрос 6. Лабораторная и инструментальная диагностика при поражении щитовидной железы.
- •Вопрос 7. Классификация тиреотоксикоза по лабораторным данным, по степени тяжести.
- •Вопрос 8. Причины, симптоматология надпочечникового (аддисонического) криза.
- •Вопрос 1. Жалобы, особенности анамнеза у пациентов с нарушенной функцией поджелудочной железы.
- •Вопрос 2. Объективное обследование пациентов с нарушенной функцией поджелудочной железы.
- •Вопрос 3. Лабораторная и инструментальная диагностика сахарного диабета.
- •Вопрос 4. Гипогликемическое состояние. Неотложная помощь.
- •Вопрос 5. Гипергликемическая кома. Неотложная помощь.
- •Вопрос 1. Анатомо-физиологические особенности системы крови.
Вопрос 8. Лабораторная и инструментальная диагностика им.
Лабораторное подтверждение острого ИМ основано на выявлении: 1) неспецифических показателей тканевого некроза и воспалительной реакции миокарда; 2) гиперферментемии и 3) увеличении содержания в крови миоглобина и тропонинов.
Неспецифическая реакция организма на возникновение острого ИМ связана, прежде всего, с распадом мышечных волокон, всасыванием продуктов расщепления белков в кровь и местным асептическим воспалением сердечной мышцы, развивающимся преимущественно в периинфарктной зоне. Основными лабораторными признаками, отражающими эти процессы, являются:
1. . Лейкоцитоз, не превышающий обычно 12–15 х 109/л.
2. Анэозинофилия.
3. Небольшой палочкоядерный сдвиг формулы крови влево.
4. Увеличение СОЭ.
Следует подчеркнуть, что выраженность всех приведенных лабораторных признаков ИМ прежде всего зависит от обширности очага поражения, поэтому при небольших по протяженности инфарктах эти изменения могут отсутствовать. Необходимо также помнить, что правильная трактовка этих неспецифических показателей возможна только при сопоставлении с клинической картиной заболевания и данными ЭКГ.
Маркеры некроза миокарда
Тропонины. Наиболее чувствительным и специфичным маркером некроза кардиомиоцитов является повышение концентрации тропонинов I и Т, входящих, как известно, в состав тропомиозинового комплекса сократительного миокарда. В норме кардиоспецифические тропонины в крови не определяются или их концентрация не превышает самых минимальных значений, устанавливаемых отдельно для каждой клинической лаборатории. Некроз кардиомиоцитов сопровождается сравнительно быстрым и значительным увеличением концентрации тропонинов I и Т, уровень которых начинает превышать верхнюю границу нормы уже через 2–6 ч после ангинозного приступа и сохраняется высоким в течение 1–2 недель от начала инфаркта (рис. 8 а).
Миоглобин. Очень чувствительным, но малоспецифичным маркером некроза является концентрация миоглобина в крови. Его повышение наблюдается через 2–4 ч после ангинозного приступа и сохраняется в течение 24–48 ч после него. Выход миоглобина из сердечной мышцы и повышение его концентрации в крови происходит еще до формирования очага некроза, т.е. на стадии выраженного ишемического повреждения сердечной мышцы. Следует также помнить, что увеличение концентрации миоглобина в крови может быть обусловлено и другими причинами (кроме инфаркта): болезнями и травмами скелетных мышц, большой физической нагрузкой, алкоголизмом, почечной недостаточностью. Изменение содержания миоглобина при остром ИМ представлено в табл. 3 и на рис. 10 а.
Таблица 2
Изменение содержания миоглобина и тропонинов при остром инфаркте миокарда
|
Белок |
Начало повышения концентрации, ч |
Пик увеличения концентрации, ч |
Возвращение к норме, сутки |
|
Миоглобин |
2–4 |
4–8 |
2 |
|
Тропонин I |
2–6 |
24–48 |
7–14 |
|
Тропонин Т |
2–6 |
24–48 |
7–14 |
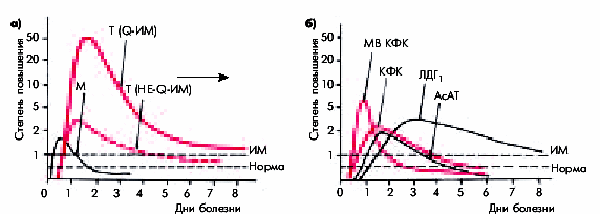
Рис. 10. Динамика концентрации тропонинов и миоглобина (а) и активности некоторых ферментов сыворотки крови (б) при остром инфаркте миокарда.
Красным цветом обозначены маркеры некроза, рекомендованные Европейским кардиологическим обществом и ВНОК РФ для лабораторной диагностики инфаркта миокарда (тропонины I и Т, МВ КФК,общая КФК). Пунктиром обозначены верхняя граница нормы и уровень, превышение которого следует расценивать как признак некроза сердечной мышцы («ИМ»). М — кривая концентрации миоглобина, Т — тропонинов
К сожалению, далеко не все клиники в настоящее время имеют возможность лабораторного определения концентрации тропонинов и миоглобина в крови. Поэтому на практике сохраняет свое значение определение других, менее чувствительных и специфичных, маркеров некроза миокарда. Наиболее ценным из них для диагностики острого ИМ является определение активности нескольких ферментов в сыворотке крови:
креатинфосфокиназы (КФК), особенно ее МВ-фракции (МВ КФК);
лактатдегидрогеназы (ЛДГ) и ее изофермента 1 (ЛДГ1);
аспартатаминотрансферазы (АсАТ).
Основной причиной повышения активности ферментов в сыворотке крови у больных острым ИМ является разрушение миокардиальных клеток и выход (вымывание) высвобождающихся клеточных ферментов в кровь. Динамика активности этих ферментов при остром ИМ представлена в табл. 3 и на рис.10 б.
Изменение активности некоторых ферментов при остром инфаркте миокарда (по И.С. Балаховскому; в модификации)
|
Фермент |
Начало повышения активности, ч |
Пик увеличения активности, ч |
Возвращение к норме, сутки |
|
МВ-фракция КФК |
4–6 |
12–18 |
2–3 |
|
КФК |
6–12 |
24 |
3–4 |
|
ЛДГ |
8–10 |
48–72 |
8–14 |
|
ЛДГ1 |
8–10 |
24–84 |
10–12 |
|
АсАТ |
4–12 |
24–36 |
4–7 |
Креатинфосфокиназа (КФК) и ее фракция МВ КФК. Более специфичным лабораторным тестом острого ИМ является определение МВ-фракции КФК (МВ КФК). Ее активность начинает возрастать уже через 4–6 ч, достигает максимума через 12–18 ч и возвращается к исходным цифрам через 48–72 ч от начала ангинозного приступа. Особое значение придается динамике активности фермента: достоверными признаками острого ИМ считают нарастание активности МВ КФК на 25% в двух пробах, взятых с 4-часовым интервалом или постепенное нарастание активности фермента на протяжении 24 ч. Информативным является повышение активности МВ КФК более 10–13 ЕД/л.
Активность общей КФК при ИМ претерпевает сходную динамику: уже к концу первых суток уровень фермента в 3–20 раз превышает норму, а через 3–4 суток от начала заболевания возвращается к исходным значениям (рис. 8 б).
Как известно, КФК в большом количестве содержится в скелетных мышцах, миокарде, головном мозге и щитовидной железе. Поэтому увеличение активности этого фермента в сыворотке крови возможно не только при остром ИМ, но и при целом ряде других клинических ситуаций. В противоположность этому повышение активности МВ-фракции КФК, содержащейся преимущественно в миокарде, специфично для повреждения сердечной мышцы, в первую очередь, для острого ИМ. МВ-фракция КФК не реагирует на повреждение скелетных мышц, головного мозга и щитовидной железы. Степень повышения активности МВ КФК в крови в целом хорошо коррелирует с размером ИМ: чем больше объем поражения сердечной мышцы, тем выше активность МВ КФК.
Аспартатаминотрансфераза (АсАТ) также относится к числу ферментов с относительно быстро наступающим пиком повышения активности (24–36 ч от начала инфаркта). Через 4–7 суток концентрация АсАТ возвращается к исходному уровню.
Изменение активности АсАТ также не специфично для острого ИМ: уровень АсАТ вместе с активностью АлАТ повышается при многих патологических состояниях, в том числе при заболеваниях печени. Все же следует помнить, что при поражениях паренхимы печени в большей степени возрастает активность АлАТ, а при заболеваниях сердца — АсАТ. При ИМ коэффициент Ритиса (отношение АсАТ/АлАТ) больше 1,33, а при заболеваниях печени — меньше 1,33.
Следует помнить, что окончательная трактовка результатов исследования ферментов и сократительных белков в сыворотке крови при остром ИМ возможна только в комплексе с оценкой клинической картины заболевания, изменений ЭКГ и данных других лабораторных и инструментальных методов исследования.
Следует отметить, что в стандарты клинической практики вошло определение уровня КФК МВ и тропонинов. Для постановки диагноза ИМ значимо разовое двухкратное увеличение КФК МВ или любое увеличение этого фермента в динамике с интервалом 12 часов, а также любой уровень увеличения тропонинов.
ЭКГ диагностика
Инфаркт миокарда с зубцом Q
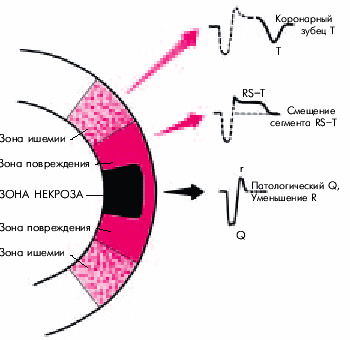
Согласно представлениям Bayley, нарушение коронарного кровообращения при ИМ приводит к формированию трех зон патологических изменений: вокруг участка некроза располагаются зоны ишемического повреждения и ишемии (рис. 11). В отведениях, активный электрод которых расположен непосредствено над областью ИМ, каждая из этих зон участвует в формировании следующих ЭКГ-изменений.
1. Зона некроза — патологический зубец Q (продолжительностью больше 30 мс) и резкое уменьшение амплитуды зубца R или комплекс QS.
2. Зона ишемического повреждения — смещение сегмента RS–T выше (при трансмуральном ИМ) или ниже изолинии (при субэндокардиальном поражении сердечной мышцы).
3. Зона ишемии — “коронарный” (равносторонний и остроконечный) зубец Т (высокий положительный при субэндокардиальном ИМ и отрицательный — при трансмуральном ИМ).
Рис. 11. Три зоны патологических изменений в сердечной мышце при остром инфаркте миокарда (по Bayley) и их отражение на ЭКГ (схема)
ЭКГ изменяется в зависимости от времени, прошедшего от начала формирования ИМ. Динамика ЭКГ в зависимости от стадии инфаркта представлена на рис. 10.
Острейшая стадия (до 2-х ч от начала ИМ). В течение нескольких минут после прекращения коронарного кровотока и возникновения ангинозного приступа в сердечной мышце обычно выявляется зона субэндокардиальной ишемии, для которой характерно появление высоких коронарных зубцов Т и смещение сегмента RS–Т ниже изоэлектрической линии (рис. 12, а, б). На практике эти изменения по понятным причинам регистрируются достаточно редко, и врач, как правило, имеет дело с более поздними электрокардиографическими признаками острейшей стадии ИМ. Когда зона ишемического повреждения распространяется до эпикарда, на ЭКГ фиксируется смещение сегмента RS–Т выше изолинии (трансмуральное ишемическое повреждение). Сегмент RS–Т при этом сливается с положительным зубцом Т, образуя так называемую монофазную кривую, напоминающую по форме ТМПД (рис. 12, в).
Острая стадия характеризуется быстрым, в течение 1 — 2 суток, формированием патологического зубца Q или комплекса QS и снижением амплитуды зубца R, что указывает на образование и расширение зоны некроза (рис.10, г, д). Одновременно в течение нескольких дней сохраняется смещение сегмента RS–T выше изолинии и сливающегося с ним вначале положительного, а затем отрицательного зубца Т. Через несколько дней сегмент RS–T приближается к изолинии, а к концу 1-й недели или в начале 2-й недели заболевания становится изоэлектричным, что свидетельствует об уменьшении зоны ишемического повреждения (рис. 12, е). Отрицательный коронарный зубец Т резко углубляется и становится симметричным и заостренным (повторная инверсия зубца Т).
В подострой стадии ИМ регистрируется патологический зубец Q или комплекс QS (некроз) и отрицательный коронарный зубец Т (ишемия), амплитуда которого, начиная с 20–25-х суток инфаркта миокарда, постепенно уменьшается. Сегмент RS–T расположен на изолинии (рис. 12, ж).
Рубцовая стадия ИМ характеризуется сохранением в течение многих лет патологического зубца Q или комплекса QS и наличием отрицательного, сглаженного или положительного зубца Т (рис. 12, з).
Таким образом, прямыми признаками острой стадии ИМ с зубцом Q являются:
патологический зубец Q (или комплекс QS);
элевация (подъем) сегмента RS–T и
отрицательный (коронарный) зубец Т.
В зависимости от локализации ИМ и его распространенности эти изменения обнаруживаются в различных ЭКГ-отведениях (табл. 4).
Прямые и реципрокные ЭКГ-признаки инфаркта миокарда с зубцом Q различной локализации
|
Локализация ИМ |
Отведения, в которых обнаруживают признаки ИМ | |
|
|
Прямые признаки: патологический Q (QS); элевация RS–T; отрицательный коронарный Т |
Реципрокные признаки: депрессия RS–T; высокий положительный Т; высокий R (при задних ИМ) |
|
Инфаркт миокарда передней стенки ЛЖ | ||
|
Переднеперегородочный |
V1 — V3 |
|
|
Передневерхушечный |
V3, V4 |
|
|
Переднебоковой |
I, aVL, V5, V6 |
|
|
Переднебазальный (высокий передний) |
V24 — V26 и/или V34 — V36 |
|
|
Распространенный передний |
I, aVL, V1 — V6 |
III, aVF, II |
|
Инфаркт миокарда задней стенки ЛЖ | ||
|
Заднедиафрагмальный (нижний) |
III, aVF, II |
|
|
Заднебазальный |
V7 — V9 |
V1 — V3 |
|
Заднебоковой |
V5, V6, III, aVF |
|
|
Распространенный задний |
III, aVF, II, V5, V6, V7 — V9 |
V1 — V3 |
Инфаркт миокарда без зубца Q
Инфаркт миокарда без зубца Q характеризуется развитием в сердечной мышце нетрансмуральных очагов некроза, локализующихся субэндокардиально или интрамурально. В отличие от трансмурального ИМ эти очаги некроза не нарушают процесс распространения по сердцу волны деполяризации, поэтому патологический зубец Q или комплекс QS отсутствуют. Значительные нарушения выявляются только в период формирования сегмента RS–T и во время фазы конечной реполяризации желудочков (зубец Т).
Наиболее типичными ЭКГ-признаками ИМ без зубца Q являются:
смещение сегмента RS–T ниже изолинии (в редких случаях возможна элевация сегмента RS–Т);
разнообразные патологические изменения зубца Т (чаще отрицательный симметричный и заостренный коронарный зубец Т);
появление этих изменений на ЭКГ после длительного и интенсивного болевого приступа и их сохранение в течение 2–5 недель.
Диагностика локализации ИМ без зубца Q основана на тех же принципах, что и трансмурального ИМ (см. выше). На рис. 13 представлены ЭКГ больного с ИМ без зубца Q передней локализации.
Заметна выраженная депрессия сегмента RS–Т и отрицательный (коронарный) зубец Т в грудных отведениях и в отведениях I, II, aVL
Эхокардиография
![]()
Эхокардиография относится к числу обязательных методов исследования, которые используются для диагностики острого ИМ и оценки гемодинамических и структурных нарушений при этом заболевании. Применение двухмерной, одномерной и допплер-эхокардиографии при ИМ позволяет:
выявить локальные нарушения сократимости ЛЖ;
количественно оценить систолическую и диастолическую функции ЛЖ;
выявить признаки ремоделирования ЛЖ (дилатацию полости желудочка, изменение геометрии ЛЖ и т.д.);
выявить эхокардиографические признаки аневризмы ЛЖ;
оценить состояние клапанного аппарата и наличие относительной недостаточности митрального клапана или дефекта МЖП;
оценить уровень давления в ЛА и выявить признаки легочной гипертензии;
выявить морфологические изменения перикарда и наличие жидкости в полости перикарда;
выявить наличие внутрисердечных тромбов;
оценить морфологические и функциональные изменения магистральных и периферических артерий и вен.
