- •1. Общие методические указания
- •Рекомендуемая литература
- •2. Методические указания по изучению дисциплины
- •Названия солей по международной номенклатуре Средняя или нормальная соль
- •Кислая соль
- •Основная соль
- •Названия солей по русской номенклатуре
- •Кислая соль
- •Основная соль
- •Примечание:
- •Энергетические уровни и электронная конфигурация атома
- •Квантовые числа
- •Магнитные и энергетические состояния атома
- •Размеры атома
- •Задачи и упражнения
- •Вопросы для самопроверки
- •Геометрические формы молекул
- •Тема 4. Химическая термодинамика и кинетика
- •4.1 Химическая термодинамика
- •4.2. Химическая кинетика
- •Задачи и упражнения
- •Вопросы для самопроверки
- •Тема 5. Растворы
- •5.1. Теория электролитической диссоциации. Реакции ионного обмена
- •5.2. Водородный показатель
- •5.3. Растворимость и гидролиз
- •5.4. Растворы неэлектролитов и электролитов
- •Растворы неэлектролитов
- •Растворы электролитов
- •Активность и ионная сила
- •5.5. Буферные растворы
- •Задачи и упражнения
- •0,2432 Г эМе --------0,0200 г водорода.
- •Вопросы для самопроверки
- •Тема 6. Окислительно-восстановительные реакции
- •Задачи и упражнения
- •Вопросы для самопроверки
- •Тема 7. Общие свойства металлов. Электрохимия. Коррозия металлов Электролиз
- •7.1 Основные понятия электрохимии.
- •Уравнение Нернста
- •7.2 Коррозия.
- •7.3 Электролиз
- •7.4 Химические источники тока
- •Задачи и упражнения
- •Вопросы для самопроверки
- •Тема 8. Агрегатные состояния вещества. Коллоидные системы Комплексные и высокомолекулярные соединения
- •8.1 Агрегатные состояния вещества
- •8.2 Коллоидные системы
- •Классификация дисперсных систем по агрегатному состоянию
- •Характеристика дисперсных систем
- •Задачи и упражнения
- •Вопросы для самопроверки
- •Тема 9. Обзор свойств элементов и их соединений. Минеральные удобрения
- •Тема 10. Органические соединения.
Магнитные и энергетические состояния атома
Магнитные свойства атомов характеризуют их поведение во внешнем магнитном поле. Если вещество выталкивается из внешнего неоднородного магнитного поля, то атомы этого вещества называют диамагнитными. Если вещество втягивается во внешнее неоднородное магнитное поле, то атомы называют парамагнитными. Диамагнитные свойства вызваны движением спаренных электронов, а парамагнитные – движением неспаренных электронов. Чем больше у атома неспаренных электронов, тем в большей степени проявляется парамагнетизм у вещества. Особенности электронной структуры различных атомов находят отражение в таких их энергетических характеристиках, как энергия ионизации Еи и сродство к электрону. Их значения принято измерять в килоджоулях на моль (кДж/моль).
Энергия ионизации – минимальная энергия, необходимая для удаления электрона из нейтрального несвязанного (газофазного) атома, находящегося в основном состоянии. Значение Eи всегда является положительным. Например, энергия ионизации атома водорода
Н (г.) = Н+ (г.) + e,
равная
+1312,1 кДж/моль, относится к переходу с
1s-атомной
орбитали (АО) на АО с n
=
![]() ,
которой отвечаетE
,
которой отвечаетE![]() = 0. У многоэлектронных атомов различают
первую (Е1и),
вторую (Е2и),
третью (Е3и)
и т.д. энергии ионизации по последовательному
удалению электронов из атома. При этом
всегда для одного и того же атома Е1и
< Е2и
<
Е3и,
поскольку второй, третий и т.д. электроны
приходится отрывать от положительно
заряженного иона. Наибольшими значениями
энергии ионизации обладают атомы
благородных газов, имеющие полностью
заселенные электронные оболочки.
Наименьшие значения энергии ионизации
имеют атомы щелочных металлов с одним
валентным электроном, надежно
экранированным от сильного воздействия
ядра предыдущими заполненными электронными
оболочками.
= 0. У многоэлектронных атомов различают
первую (Е1и),
вторую (Е2и),
третью (Е3и)
и т.д. энергии ионизации по последовательному
удалению электронов из атома. При этом
всегда для одного и того же атома Е1и
< Е2и
<
Е3и,
поскольку второй, третий и т.д. электроны
приходится отрывать от положительно
заряженного иона. Наибольшими значениями
энергии ионизации обладают атомы
благородных газов, имеющие полностью
заселенные электронные оболочки.
Наименьшие значения энергии ионизации
имеют атомы щелочных металлов с одним
валентным электроном, надежно
экранированным от сильного воздействия
ядра предыдущими заполненными электронными
оболочками.
Сродство к электрону – энергия, выделяемая или поглощаемая (отрицательное сродство) при присоединении электрона к нейтральному несвязанному атому, находящемуся в газовой фазе, с образованием отрицательно заряженного иона. Наибольшим сродством к электрону обладают галогены. Например:
F (г.) + e = F– (г.) + 345,7 кДж/моль.
Размеры атома
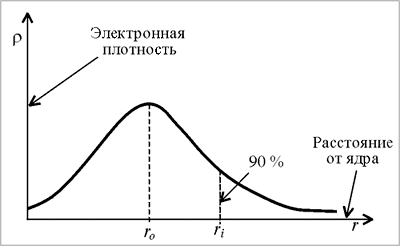
1. За радиус атома (ri) принимают такое расстояние от ядра, при котором учитывается 90% его плотности (рис. 2.6)
|
|
|
Рис. 2.6. Зависимость электронной плотности в атоме от расстояния от ядра |
2. Металлический радиус равен половине межъядерного расстояния между соседними атомами в кристаллической решетке металла.
3. Ковалентный (атомный) радиус определяется как половина межъядерного расстояния между двумя одинаковыми атомами, связанными ковалентной связью.
4. Возможны измерения и расчеты радиусов соседних ионов в соли. Металлические и ковалентные радиусы определяются, как правило, экспериментально и называются еще эффективными.
Задачи и упражнения
1. Дать характеристику, исходя из положения в периодической системе, элементу с порядковым номером 12.
Решение: Элемент S-семейства магний.
12Mg 1s22s22p63s2
|
|
|
|
|
|
↑↓ |
|
|
|
3s 3p
|
|
↑ |
|
|
|
↑ |
|
|
|
3s 3p
Mg может иметь одно возбужденное сотояние. В возбужденном состоянии два неспаренных электрона, следовательно, валентность его равна 2. Ей соответствует степень окисления +2.
Пример соединения Mg+2O-2 – основной оксид. Ему соответствует Mg(OH)2 – гидроксид магния.
2. Дать характеристику элементу p – семейства: сера.
Решение:
16S 1s22s22p63s23p4
S – неметалл, так как на внешнем уровне более 4 электронов (6 электронов).
Min B = 2.
|
|
|
|
|
|
|
|
|
|
|
|
↑↓ |
↑ |
↑ |
|
|
|
|
|
|
↑↓ |
|
|
|
|
|
|
|
|
S
3s 3p 3d
Степень окисления -2, +2. Примеры соединений: H2+1S-2, (S+2O-2 – неустойчив).
Атом серы может иметь два возбужденных состояния (две неподеленные пары электронов на внешнем уровне).
|
|
|
|
|
↑ |
|
|
|
|
|
|
↑ |
↑ |
↑ |
|
|
|
|
|
|
↑↓ |
|
|
|
|
|
|
|
|
S٭
3s 3p 3d
В = 4, степень окисления +4. S+4O2-2 – кислотный оксид, H2SO3 –сернистая кислота.
|
|
|
|
|
↑ |
↑ |
|
|
|
|
|
↑ |
↑ |
↑ |
|
|
|
|
|
|
↑ |
|
|
|
|
|
|
|
|
S٭٭
3s 3p 3d
Мaх В = 6, так как больше возбуждение не возможно, степень окисления +6.
S+6O3-2 – кислотный оксид
H2SO4 – серная кислота.