- •1. Общие методические указания
- •Рекомендуемая литература
- •2. Методические указания по изучению дисциплины
- •Названия солей по международной номенклатуре Средняя или нормальная соль
- •Кислая соль
- •Основная соль
- •Названия солей по русской номенклатуре
- •Кислая соль
- •Основная соль
- •Примечание:
- •Энергетические уровни и электронная конфигурация атома
- •Квантовые числа
- •Магнитные и энергетические состояния атома
- •Размеры атома
- •Задачи и упражнения
- •Вопросы для самопроверки
- •Геометрические формы молекул
- •Тема 4. Химическая термодинамика и кинетика
- •4.1 Химическая термодинамика
- •4.2. Химическая кинетика
- •Задачи и упражнения
- •Вопросы для самопроверки
- •Тема 5. Растворы
- •5.1. Теория электролитической диссоциации. Реакции ионного обмена
- •5.2. Водородный показатель
- •5.3. Растворимость и гидролиз
- •5.4. Растворы неэлектролитов и электролитов
- •Растворы неэлектролитов
- •Растворы электролитов
- •Активность и ионная сила
- •5.5. Буферные растворы
- •Задачи и упражнения
- •0,2432 Г эМе --------0,0200 г водорода.
- •Вопросы для самопроверки
- •Тема 6. Окислительно-восстановительные реакции
- •Задачи и упражнения
- •Вопросы для самопроверки
- •Тема 7. Общие свойства металлов. Электрохимия. Коррозия металлов Электролиз
- •7.1 Основные понятия электрохимии.
- •Уравнение Нернста
- •7.2 Коррозия.
- •7.3 Электролиз
- •7.4 Химические источники тока
- •Задачи и упражнения
- •Вопросы для самопроверки
- •Тема 8. Агрегатные состояния вещества. Коллоидные системы Комплексные и высокомолекулярные соединения
- •8.1 Агрегатные состояния вещества
- •8.2 Коллоидные системы
- •Классификация дисперсных систем по агрегатному состоянию
- •Характеристика дисперсных систем
- •Задачи и упражнения
- •Вопросы для самопроверки
- •Тема 9. Обзор свойств элементов и их соединений. Минеральные удобрения
- •Тема 10. Органические соединения.
Примечание:
٭С водой взаимодействуют только оксиды щелочных металлов (I гр. элементы от Li – Fr) и щелочно-земельные (II гр. – от Са-Rа)
٭٭Щелочи – это растворимые в воде основания, образованные элементами I группы от Li – Fr и II группы от Са-Rа.
٭٭٭Таблица с названиями кислот и их соответствующих солей представлена в приложении (прил., табл.16)
Задачи и упражнения
1. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения:
Cu → CuO → CuSO4 → Cu(OH)2 → Cu(NO3)2
Решение: 1) Сначала получаем оксид меди: 2Сu + O2= 2CuO
2) Действуем на оксид меди серной кислотой:
2CuO + H2SO4 = CuSO4 + H2O
3) На соль действуем щелочью:
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
4) На гидроксид меди действуем азотной кислотой:
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2 H2O
2. Составить формулу кислой соли кальция и угольной кислоты и написать уравнение реакции ее получения.
Решение: Формула угольной кислоты H2CO3. Прибавляя к ней гидроксид кальция Ca(OH)2 и замещая один ион водорода кислоты на ион кальция, получим кислую соль:
2H2CO3 + Ca(OH)2 = Ca(HCO3)2 + 2H2O
Вопросы для самопроверки
1. Написать уравнения реакции получения гидроксида меди (II).
2. Охарактеризовать химические свойства оксида углерода (IV).
3. Написать ангидриды и кислотные остатки следующих кислот: кремниевой, сернистой, ортофосфорной.
4. Написать графическое изображение формулы серной кислоты.
5. Составить формулы оксидов: серы (IV), марганца (VII), железа (II).
6. Определить степень окисления центрального атома в следующих соединениях: KMnO4, H3PO4, К2Сr2O7.
7. Написать уравнения реакции получения всех возможных (средних, кислых и основных) солей из гидроксида натрия и кремниевой кислоты. Назвать все соединения.
8. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения:
Аl → Al2(SO4)3 → Al(OH)3→ NaAlO2 → Al(OH)3.
Тема 2. Строение атома. Периодический закон Д. И. Менделеева Электронная оболочка атома
Методические советы (Л.1, с. 37-96)
Изучение темы необходимо начать с краткого исторического обзора развития учения о строении атома. Особое внимание надо обратить на физический смысл порядковых номеров элементов. Надо отметить, что положительный заряд ядра атома численно равен порядковому номеру элемента в периодической системе Д.И. Менделеева. Необходимо проследить, как идет постепенное заполнение электронами энергетических уровней в периодах, в группах и сопоставить это с изменением свойств элементов. Надо знать массу и заряд элементарных частиц, входящих в состав атома (протоны, нейтроны, электроны). На основе строения атома и состава ядер ознакомиться с изотопами. Знать валентность и объяснять ее с точки зрения учения о строении атомов.
Необходимо знать периодический закон Д.И. Менделеева, на основании которого были классифицированы элементы в периодической системе. Четко представлять структуру периодической системы: группы, большие и малые периоды, четные и нечетные ряды. Разобраться в постепенном изменении свойств элементов от первого элемента к последующему в малых и больших периодах, а также в группах и подгруппах. Обосновать периодичность изменения свойств элементов периодически повторяющейся структуры электронных слоев атомов. Надо знать различие в свойствах элементов главных и побочных подгрупп больших периодов на основе различного распределения валентных электронов в их атомах. Уяснить сущность современной формулировки периодического закона Д.И. Менделеева.
Научиться изображать схему строения атома и давать характеристику элемента по электронному строению атома.
Теоретические аспекты.
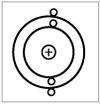
Модель Бора. Н. Бор в 1913 г. установил соответствие между линиями атомного спектра и энергиями электронов, предложил планетарную квантовую модель атома, согласно которой электроны движутся вокруг ядра по стационарным круговым орбитам (рис. 2.1).
|
|
|
Рис. 2.1. Планетарная квантовая модель атома |
Постулаты Бора:
1. Электроны способны находиться в атоме только на некоторых разрешенных стационарных орбитах; по этим орбитам электроны движутся, не испуская и не поглощая энергии.
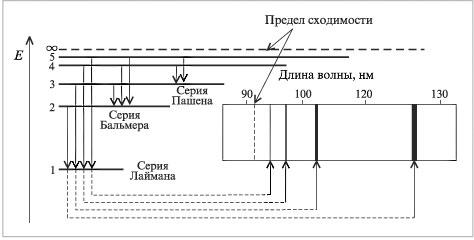
2. Излучение или поглощение порции (кванта) энергии происходит при переходе электрона с одной стационарной орбиты на другую. Атомный спектр испускания водорода представляет собой совокупность линий, среди которых можно различить три группы или серии. Серия линий, находящихся в ультрафиолетовой области, называется серией Лаймана. Серия, находящаяся в видимой области, – серия Бальмера, а в инфракрасной – серия Пашена (рис. 2.2). Серии линий, лежащие в ультрафиолетовой, видимой и инфракрасной областях, описываются единым уравнением:
1/![]() = P
= P![]() (1/N2
– 1/n2),
(1/N2
– 1/n2),
где
![]() –
длина волны, P
–
длина волны, P![]() – постоянная Ридберга, N
– номер электронного уровня, на который
осуществляется переход электрона (для
серии Лаймана N
= 1, для серии Бальмера N
= 2, для серии Пашена N
= 3), n
– целое число, номер электронного
уровня, с которого возбуждается электрон.
– постоянная Ридберга, N
– номер электронного уровня, на который
осуществляется переход электрона (для
серии Лаймана N
= 1, для серии Бальмера N
= 2, для серии Пашена N
= 3), n
– целое число, номер электронного
уровня, с которого возбуждается электрон.
|
|
|
Рис. 2.2. Соответствие между электронными переходами и спектральными линиями атома водорода |
Бор связал электронные переходы со спектральными линиями атомарного водорода. Линии каждой серии (рис. 2.2) по мере уменьшения длины волны постепенно приближаются к некоторому пределу сходимости. С увеличением номера энергетических уровней наблюдается их сгущение. Так, переход с первого энергетического уровня на второй требует большей энергии, чем со второго на третий, а со второго на третий – большей энергии, чем с третьего на четвертый, и т. д. Пределы сходимости спектральных линий соответствуют энергиям электронов, находящихся на самых высоких энергетических уровнях.
Недостатки модели Бора.
1. Эта модель не позволяет объяснить некоторые особенности в спектрах более тяжелых элементов, чем водород.
2. Экспериментально не подтверждается, что электроны в атомах вращаются вокруг ядра по круговым орбитам со строго определенным угловым моментом. Более того, если бы это было так, то электрон должен был бы постепенно терять энергию и замедляться. В конце концов он оказался бы притянутым к ядру, что означает разрушение атома. На самом деле этого не происходит.
Двойственная
природа электрона.
К 1925 г. было уже известно, что электромагнитное
излучение способно проявлять как
волновые, так и корпускулярные свойства
(подобные свойствам частиц). В последнем
случае оно ведет себя как поток частиц
– фотонов. Энергия фотона связана с его
длиной волны
![]() или
частотой
или
частотой![]() соотношением:
соотношением:
E
= h![]() =hc/
=hc/![]() (с
=
(с
=
![]()
![]() ),
),
где
h
– поcтоянная Планка, c
– скорость света. Луи де Бройль высказал
смелое предположение, что аналогичные
волновые свойства можно приписать и
электрону. Он объединил уравнения
Эйнштейна (E
= mc2)
и Планка (E
= h![]() )
в одно:
)
в одно:
h![]() = mc2
= mc2
![]() hс/
hс/![]() = mc2
= mc2
![]()
![]() =
h/mc.
=
h/mc.
Далее, заменив скорость cвета на скорость электрона, он получил:
![]() =
h/m
=
h/m![]() ,
,
где
![]() –
скорость электрона.
–
скорость электрона.
Это
уравнение, связывающее длину волны с
его импульсом (m![]() ),
и легло в основу волновой теории
электронного строения атома. Де Бройль
предложил рассматривать электрон как
стоячую волну, которая должна умещаться
на атомной орбите целое число раз,
соответствующее номеру электронного
уровня.
),
и легло в основу волновой теории
электронного строения атома. Де Бройль
предложил рассматривать электрон как
стоячую волну, которая должна умещаться
на атомной орбите целое число раз,
соответствующее номеру электронного
уровня.
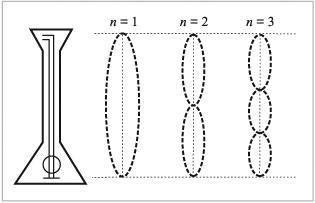
Так, электрону, находящемуся на первом электронном уровне (n = 1), соответствует в атоме одна длина волны, на втором (n = 2) – две и т. д. (рис. 2.3).
|
|
|
Рис. 2.3. Соотнесение номера атомной орбиты с колебанием струны |
Согласно принципу неопределенности Гейзенберга положение и импульс электрона не поддаются одновременному определению с абсолютной точностью. Однако, несмотря на невозможность точного определения положения электрона, можно указать вероятность нахождения электрона в определенном положении в любой момент времени. Из принципа неопределенности Гейзенберга вытекают два важных следствия:
1. Движение электрона в атоме – движение без траектории. Вместо траектории в квантовой механике введено другое понятие – вероятность пребывания электрона в определенной части объема атома, которая коррелирует с электронной плотностью при рассмотрении электрона в качестве электронного облака.
2. Электрон не может упасть на ядро. Теория Бора не объяснила это явление. Квантовая механика дала объяснение и этому явлению. Увеличение степени определенности координат электрона при его падении на ядро вызвало бы резкое возрастание энергии электрона до 1011 кДж/моль и больше. Электрон с такой энергией вместо падения на ядро должен будет покинуть атом. Отсюда следует, что усилие необходимо не для того, чтобы удержать электрон от падения на ядро, а для того, чтобы «заставить» электрон находиться в пределах атома.
Функция, зависящая от координат электрона, через которую определяется вероятность его нахождения в той или иной точке пространства, называется орбиталью. Понятие «орбиталь» не следует отождествлять с понятием «орбита», которое используется в теории Бора. Под орбитой в теории Бора понимается траектория (путь) движения электрона вокруг ядра. Часто принято рассматривать электрон как размытое в пространстве отрицательно заряженное облако с общим зарядом, равным заряду электрона. Тогда плотность такого электронного облака в любой точке пространства пропорциональна вероятности нахождения в ней электрона. Модель электронного облака очень удобна для наглядного описания распределения электронной плотности в пространстве.
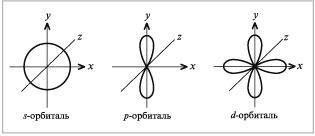
При этом s-орбиталь имеет сферическую форму, р-орбиталь – форму гантели, d-орбиталь – четырехлепесткового цветка или удвоенной гантели (рис. 2.4).
Таким образом, s-подоболочка состоит из одной s-орбитали, p-подоболочка – из трех p-орбиталей, d-подоболочка – из пяти d-орбиталей, f-подоболочка – из семи f-орбиталей.
|
|
|
Рис. 2.4. Формы s-, p- и d-орбиталей |