- •Химия Учебное наглядное пособие
- •Содержание
- •Раздел 1. Основные понятия и законы химии
- •1.1. Атомно-молекулярное учение
- •1.2. Законы химии
- •Закон сохранения массы вещества
- •Способы выражения количества вещества эквивалентов
- •Раздел 2. Классификация неорганических веществ
- •2.1.Оксиды
- •Химические свойства оксидов
- •2.2. Гидроксиды металлов
- •Химические свойства гидроксидов
- •Доказательство амфотерности
- •2.3. Кислоты
- •2.4. Соли
- •Средние кислые основные
- •Получение солей
- •2.5. Комплексные соединения
- •Раздел 3. Растворы
- •3.1. Способы выражения концентрации растворов
- •3.2. Растворы неэлектролитов
- •3.3. Растворы электролитов. Электролитическая диссоциация
- •3.4. Ионно-молекулярные уравнения реакций
- •3.5. Гидролиз
- •Раздел 4. Элекрохимические системы
- •Законы Фарадея
- •4.1. Степень окисления
- •4.2. Окислительно-восстановительные реакции (овр)
- •Направление овр
- •4.3. Гальванический элемент Даниэля-Якоби
- •4.4. Электродвижущая сила (эдс)
- •Стандартный водородный электрод
- •4.5. Электролиз
- •Электролиз с инертным анодом
- •Электролиз с растворимым анодом
- •4.6. Коррозия и защита металлов от коррозии
- •Защита металлов от коррозии
- •Раздел 5. Периодический закон д.И.Менделеева
- •5.1. Строение атома
- •Состав ядра
- •5.2. Модель состояния электрона в атоме Квантовые числа
- •Возможные значения квантовых чисел
- •5.3.Основные положения строения электронных оболочек атома
- •Ряд последовательного заполнения электронами орбиталей
- •Раздел 6. Химическая связь
- •Раздел 7. Химическая кинетика и равновесие
- •Раздел 8. Химическая термодинамика
- •8.1. Параметры состояния системы
- •8.2. Закон Гесса
- •Раздел 9. Химия элементов
- •Углерод c
- •Физические свойства аллотропных модификаций c
- •Химические свойства с
- •Соединения с
- •Кремний Si
- •Соединения Si
- •Соединения n
- •Соли аммония
- •Особые химические свойства
- •Разложение нитратов: фосфор p
- •Соединения р
- •Халькогены
- •Кислород
- •Соединения s
- •Галогены f, Cl, Br, I хлор Cl2
- •Соединения Cl
- •Подгруппа хрома
- •Хром Cr
- •Подгруппа железа
- •Железо Fe
- •Раздел 10. Органическая химия
- •10.1.Углеводороды Предельные углеводороды. Алканы
- •Непредельные углеводороды. Алкены
- •Диеновые углеводороды
- •Ароматические углеводороды. Ряд бензола. Арены
- •Нефть и ее переработка
- •10.2. Кислородсодержащие органические соединения Спирты
- •Альдегиды
- •Формальдегид
- •Ацетальдегид
- •Поликонденсация
- •Кетоны r – c – r
- •Карбоновые кислоты
- •Определение строения веществ
- •11.1. Методы качественного анализа (реакции обнаружения) Окрашивание пламени (предварительная проба)
- •Реакции осаждения
- •Реакции с выделением газа
- •Качественный элементный анализ
- •Цветные реакции
- •Обнаружения газов
- •Реакции обнаружения органических соединений
- •Индентификация синтетических материалов
- •11.2. Методы количественного анализа Титриметрический анализ (объемный анализ)
- •Кондуктометрическое титрование
- •Потенциометрия
- •Окислительно-восстановительное титрование
- •Комплексонометрия
- •Осадительное титрование
- •Аргентометрия
- •Гравиметрия
- •11.3. Спектроскопические методы анализа
- •Ультрафиолетовая спектроскопия и абсорбционная спектроскопия в видимой области
- •Характерные инфракрасные полосы поглощения
- •Спектроскопия ядерного магнитного резонанса
- •11.4. Дифрактометрический метод анализа
- •Дифракция рентгеновых лучей для определения типа кристаллической решетки
- •Дифракция рентгеновых лучей для определения электронной плотности
- •Раздел 12. Химия окружающей среды Глобальные аспекты
- •Загрязнение окружающей среды
- •Охрана окружающей среды
- •Атмосфера как область окружающей среды
- •Загрязнение воздуха
- •Влияние вредных веществ на окружающую среду
- •Методы очистки воздуха
- •Гидросфера как область окружающей среды
- •Вредные примеси питьевой воды
- •Жёсткость воды
- •Сточные воды
- •Вредные вещества в сточных водах
- •Поступления сточных вод
- •Литосфера как область окружающей среды
- •Удобрения
- •Загрязнение стойкими биоцидами
- •Заражение ядовитыми тяжелыми металлами
- •Методы санации зараженных почв
- •Отходы в окружающей среде
- •Вторичное использование
- •Продовольствие и питание
- •Углеводы в качестве пищевого продукта
- •Жиры в качестве пищевого продукта
- •Протеины как продукт питания
- •Витамины
- •Минеральные вещества
- •Микроэлементы
- •Пищевые добавки
- •Консерванты
- •Раздел 13. Коллоидная химия
- •Адсорбция, ее виды
- •Дисперсные системы
- •Коллоидные растворы
- •Строение коллоидных частиц
- •Приложение а Физико-химические постоянные
- •Групповые названия химических элементов
- •Растворимость веществ в воде при температуре 25 °с
- •Эбуллиоскопические (Кэ) и криоскопические (Ккр) константы некоторых растворителей
- •Произведения растворимости некоторых малорастворимых электролитов при 25 °с
- •Возможные степени окисления элементов
- •Электронное строение атомов в основном состоянии
- •Стандартные термодинамические функции образования
- •Нормальные (стандартные) окислительно-восстановительные потенциалы е0 в водных растворах при 25 0с по отношению к нормальному водородному электроду
- •Рыбалкин Евгений Михайлович Ковалик Ольга Юрьевна химия
- •654007, Г. Новокузнецк, ул. Кирова, 42
2.4. Соли
|
Солями называют соединения, состоящие из катиона металла и аниона кислотного остатка. |
соли


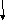
Средние кислые основные
|
Средняя соль или нормальная – сильный или слабый электролит, который при электролитической диссоциации образует положительные ионы основного остатка и отрицательные ионы кислотного остатка. Среднюю соль принято определять как продукт полной нейтрализации кислоты щелочью.
|
Кислые соли – продукт неполного замещения ионов водорода кислоты на металл: NaНSО4, СаНРО4, Са(Н2РО4)2. Названия кислых солей: Перед названием кислой соли ставится приставка «гидро», если в молекуле остался один атом водорода, и «дигидро», если осталось два атома водорода, например: NaHSO4 – гидросульфат натрия, K2HPO4 – гидрофосфат калия, KH2PO4 – дигидрофосфат калия. |
Основные соли – продукты неполного замещения гидроксогрупп основания на кислотный остаток: MgOHCl, BiOHCl2. Названия основных солей: Перед названием основной соли ставится приставка «гидроксо», например: MgOHCl – гидроксохлорид магния, Bi(OH)2NO3 – дигидроксонитрат висмута. |
Получение солей
|
нормальных или средних |
|
При взаимодействии: 1) металла с неметаллом Fe + S = FeS; 2) кислоты с металлом Zn + H2SO4 = ZnSO4 + Н2↑; 3) кислоты с основанием HCl + NaOH = NaCl + Н2О; 4) кислоты с основным оксидом 2 HCl + СuО = CuCl2 +Н2О; 5) кислотного оксида с основным оксидом SO3 + СuО = СuSO4; 6) кислотного оксида с основанием СO2 + Ca(ОН)2 = СаСО3 + Н2О; 7) кислоты с солью H2SO4 + BaCl2 = BaSO4↓ + 2 HCl; 8) щелочи с солью 2 NaOH + CuSО4 = Сu(ОН)2 ↓ +Na2SО4; 9) двух солей АgNО3 + NaCl = AgCl ↓ + NaNО3; 10) соли с металлом CuSO4 + Fe = FeSО4 + Сu ↓. |
|
основных |
|
Только многокислотные основания дают основные соли. l) кислоты с избытком основания: HCl + Мg(ОН)2 = MgOHCl + Н2О; 2) нормальной соли с недостаточным количеством основания: Вi(NО3)3 + 2 NaOH = Вi(ОН)2NО3 + 2 NaNО3; CаCl2 + КОН = СаОНСl + KCl. |
|
кислых |
|
Только многоосновные кислоты дают кислые соли. l) при взаимодействии основания с избытком кислоты: NaOH + H2SО4 = NaНSO4 + Н2О; 2) при действии на нормальную соль избытка той же кислоты: ↓СаСО3 + СО2 + Н2О = Са(НСО3)2.
|
|
получение нормальных солей из кислых |
|
При действии основания на кислую соль получаются нормальные соли: 2 СаНРО4 + Са(ОН)2 = Са3(РО4)2 + 2 Н2О. |
|
получение нормальных солей из основных |
|
Нормальные соли из основных получаются при действии кислоты на основную соль: MgOHCl + НСl = MgC12 + Н2О; FеОН(NО3)2 + НNО3 = Fе(NО3)3 + Н2O. |
2.5. Комплексные соединения
|
Комплексные соединения – определенные химические соединения, образованные сочетанием отдельных компонентов и представляющие собой сложные ионы или молекулы, способные к существованию как в кристаллическом, так и в растворенном состоянии. | |
|
Комплексообразователь (центральный атом) – один из атомов, обычно положительно заряженный, занимающий центральное место в молекуле комплексного соединения. | |
|
Лиганды – противоположно заряженные ионы или нейтральные молекулы, расположенные вокруг комплексообразователя. | |
|
Координационное число центрального иона – общее число σ-связей, образуемых комплексообразователем с лигандами. | |
|
внутренняя сфера ион-комплексообразователь + лиганды = комплексный ион |
внешняя сфера противоионы (катион или анион соли) |
|
Например:[Cu(NH3)4]Cl2 – хлорид тетраамин меди (II) внутренняя сфера внешняя сфера
Образование комплексных соединений связано со способностью катионов металлов присоединять определенные молекулы и/или отрицательно заряженные ионы. Cu2++4NH3 = [Cu(NH3)4]2+ [Cu(NH3)4]2+ + 2Cl– = [Cu(NH3)4]Cl2 [ ] – комплексный ион – донорно-акцепторная связь, Cu2+ – комплексообразователь, NH3 – лиганды, 4 – координационное число (к/ч) [Cu(NH3)m]. Заряд комплексного иона равен алгебраической сумме зарядов иона-комплексообразователя и лигандов. | |
|
Ион |
К/ч |
Ион |
К/ч |
|
Al3+ |
4,6 |
Ag+ |
2 |
|
Zn2+ |
4 |
Hg+ |
2 |
|
Fe2+ |
4,6 |
Hg2+ |
4 |
|
Fe3+ |
4,6 |
Cr3+ |
4,6 |
|
Комплексные соединения могут относиться к различным классам: солям, основаниям, кислотам. Комплексные ионы могут быть как положительными, так и отрицательными, т.е. выступать в соединениях в виде катионов и в виде анионов, например: Na[Аu(CN)2] = Na+ + [Аu(CN)2]–; К2[HgI4] = 2К+ + [HgI4]2–; [Сu(NН3)4]SO4 = [Сu(NН3)4]2+ + SO42–.
|
|
Получение комплексных соединений |
|
Один из способов получения комплексных соединений основан на введении в химическую систему избытка лигандов для создания соотношения, соответствующего координационному числу. На этом принципе основаны реакции растворения некоторых осадков, в т.ч. амфотерных гидроксидов в растворах щелочей. а) Zn(OH)2(осадок)+2KOH = K2[Zn(OH)4] Zn(OH)2+2OH– = [Zn(OH)4]2–; б) AlCl3+3KOH =↓Al(OH)3+3KCl Al(OH)3+KOH = K[Al(OH)4] или Al(OH)3+3KOH = K3[Al(OH)6] Al(OH)3 + 3ОН– = [Al(OH)6]3–; в) HgI2(осадок)+2KI = K2[HgI4] – тетрайодогидроаргат(II) калия HgI2+2I– = [HgI4]2–. |
|
Другой из способов – взаимодействие металлов с водными растворами щелочей. Металлы, оксиды которых обладают амфотерными свойствами, взаимодействуют с водными растворами щелочей, образуя гидроксокомплексы. В этих реакциях окислителем является вода, из которой восстанавливается водород: Zn + 2H2O + 2KOH → K2[Zn(OH)4] + H2↑. |
|
Химические свойства комплексных соединений |
|
Комплексным соединениям присущи многие свойства обычных соединений. Например, реакции обмена с участием двух солей: 3FeCl2+2K3[Fe(CN)6] = Fe3[Fe(CN)6]2+6KCl; 3Fe2++2[Fe(CN)6]3– = Fe3[Fe(CN)6]2. |
|
Для комплексных соединений характерны специфические реакции, связанные с замещением одного лиганда другим. [Cu(H2O)4]SO4+4NH3=[Cu(NH3)4]SO4+4H2O; [Cu(H2O)4]2++4NH3=[Cu(NH3)4]2+ + 4H2O. Координационное число комплексного иона возрастает с увеличением силы лиганда. CN– > NO2– > NH3 > CNS– > H2O > OH– > CL– > Br– > I–. Лиганды, расположенные в левой части называют сильными, в правой – слабыми (относительно середины). |
|
В водных растворах комплексные соединения диссоциируют на комплексные ионы и ионы внешней сферы; [Сu(NН3)4]C12 ↔ [Сu(NН3)4]2+ + 2Cl–. Ионы внешней сферы присоединены к комплексному иону ионной связью. В незначительной степени комплексный ион тоже может диссоциировать:[Сu(NН3)4]2+ ↔ Сu2+ + 4NН3. Константа равновесия данной системы определяет прочность комплексного иона и называется константа нестойкости:
Чем больше Кнест, тем менее прочен комплексный ион. |
|
Номенклатура комплексных соединений |
|
В названии комплексных соединений отражается его состав справа налево, в названии комплексного иона (то, что в […]) последовательно перечисляется число лигандов, название лиганда, название иона-комплексообразователя, причем, для аниона используются латинская основа слова, а для катиона – русская. |
|
Например:[Cu(NH3)4]2+ – ион тетрааминмеди (II); NH3 – амин; CN– – циано; [Ag(NH3)2]+ – ион диамин серебра; [Al(H2O)6]3+ – ион гексааква алюминия; [Al(OH)4]– – тетрагидроксоалюминат; [Cu(NH3)4](OH)2 – гидроксидтетраамин меди (II); H2[TiCl6] – гексахлортитановая кислота. |