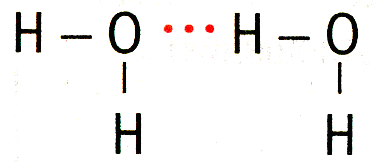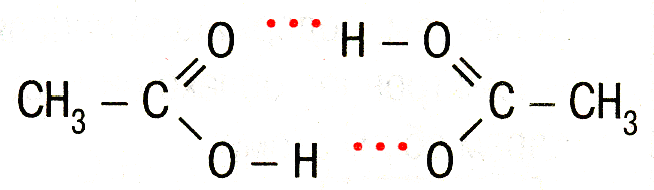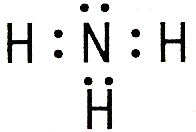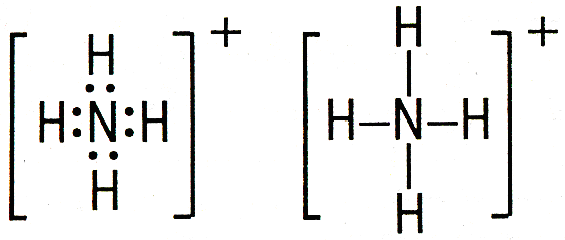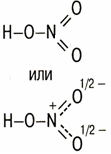- •Химия Учебное наглядное пособие
- •Содержание
- •Раздел 1. Основные понятия и законы химии
- •1.1. Атомно-молекулярное учение
- •1.2. Законы химии
- •Закон сохранения массы вещества
- •Способы выражения количества вещества эквивалентов
- •Раздел 2. Классификация неорганических веществ
- •2.1.Оксиды
- •Химические свойства оксидов
- •2.2. Гидроксиды металлов
- •Химические свойства гидроксидов
- •Доказательство амфотерности
- •2.3. Кислоты
- •2.4. Соли
- •Средние кислые основные
- •Получение солей
- •2.5. Комплексные соединения
- •Раздел 3. Растворы
- •3.1. Способы выражения концентрации растворов
- •3.2. Растворы неэлектролитов
- •3.3. Растворы электролитов. Электролитическая диссоциация
- •3.4. Ионно-молекулярные уравнения реакций
- •3.5. Гидролиз
- •Раздел 4. Элекрохимические системы
- •Законы Фарадея
- •4.1. Степень окисления
- •4.2. Окислительно-восстановительные реакции (овр)
- •Направление овр
- •4.3. Гальванический элемент Даниэля-Якоби
- •4.4. Электродвижущая сила (эдс)
- •Стандартный водородный электрод
- •4.5. Электролиз
- •Электролиз с инертным анодом
- •Электролиз с растворимым анодом
- •4.6. Коррозия и защита металлов от коррозии
- •Защита металлов от коррозии
- •Раздел 5. Периодический закон д.И.Менделеева
- •5.1. Строение атома
- •Состав ядра
- •5.2. Модель состояния электрона в атоме Квантовые числа
- •Возможные значения квантовых чисел
- •5.3.Основные положения строения электронных оболочек атома
- •Ряд последовательного заполнения электронами орбиталей
- •Раздел 6. Химическая связь
- •Раздел 7. Химическая кинетика и равновесие
- •Раздел 8. Химическая термодинамика
- •8.1. Параметры состояния системы
- •8.2. Закон Гесса
- •Раздел 9. Химия элементов
- •Углерод c
- •Физические свойства аллотропных модификаций c
- •Химические свойства с
- •Соединения с
- •Кремний Si
- •Соединения Si
- •Соединения n
- •Соли аммония
- •Особые химические свойства
- •Разложение нитратов: фосфор p
- •Соединения р
- •Халькогены
- •Кислород
- •Соединения s
- •Галогены f, Cl, Br, I хлор Cl2
- •Соединения Cl
- •Подгруппа хрома
- •Хром Cr
- •Подгруппа железа
- •Железо Fe
- •Раздел 10. Органическая химия
- •10.1.Углеводороды Предельные углеводороды. Алканы
- •Непредельные углеводороды. Алкены
- •Диеновые углеводороды
- •Ароматические углеводороды. Ряд бензола. Арены
- •Нефть и ее переработка
- •10.2. Кислородсодержащие органические соединения Спирты
- •Альдегиды
- •Формальдегид
- •Ацетальдегид
- •Поликонденсация
- •Кетоны r – c – r
- •Карбоновые кислоты
- •Определение строения веществ
- •11.1. Методы качественного анализа (реакции обнаружения) Окрашивание пламени (предварительная проба)
- •Реакции осаждения
- •Реакции с выделением газа
- •Качественный элементный анализ
- •Цветные реакции
- •Обнаружения газов
- •Реакции обнаружения органических соединений
- •Индентификация синтетических материалов
- •11.2. Методы количественного анализа Титриметрический анализ (объемный анализ)
- •Кондуктометрическое титрование
- •Потенциометрия
- •Окислительно-восстановительное титрование
- •Комплексонометрия
- •Осадительное титрование
- •Аргентометрия
- •Гравиметрия
- •11.3. Спектроскопические методы анализа
- •Ультрафиолетовая спектроскопия и абсорбционная спектроскопия в видимой области
- •Характерные инфракрасные полосы поглощения
- •Спектроскопия ядерного магнитного резонанса
- •11.4. Дифрактометрический метод анализа
- •Дифракция рентгеновых лучей для определения типа кристаллической решетки
- •Дифракция рентгеновых лучей для определения электронной плотности
- •Раздел 12. Химия окружающей среды Глобальные аспекты
- •Загрязнение окружающей среды
- •Охрана окружающей среды
- •Атмосфера как область окружающей среды
- •Загрязнение воздуха
- •Влияние вредных веществ на окружающую среду
- •Методы очистки воздуха
- •Гидросфера как область окружающей среды
- •Вредные примеси питьевой воды
- •Жёсткость воды
- •Сточные воды
- •Вредные вещества в сточных водах
- •Поступления сточных вод
- •Литосфера как область окружающей среды
- •Удобрения
- •Загрязнение стойкими биоцидами
- •Заражение ядовитыми тяжелыми металлами
- •Методы санации зараженных почв
- •Отходы в окружающей среде
- •Вторичное использование
- •Продовольствие и питание
- •Углеводы в качестве пищевого продукта
- •Жиры в качестве пищевого продукта
- •Протеины как продукт питания
- •Витамины
- •Минеральные вещества
- •Микроэлементы
- •Пищевые добавки
- •Консерванты
- •Раздел 13. Коллоидная химия
- •Адсорбция, ее виды
- •Дисперсные системы
- •Коллоидные растворы
- •Строение коллоидных частиц
- •Приложение а Физико-химические постоянные
- •Групповые названия химических элементов
- •Растворимость веществ в воде при температуре 25 °с
- •Эбуллиоскопические (Кэ) и криоскопические (Ккр) константы некоторых растворителей
- •Произведения растворимости некоторых малорастворимых электролитов при 25 °с
- •Возможные степени окисления элементов
- •Электронное строение атомов в основном состоянии
- •Стандартные термодинамические функции образования
- •Нормальные (стандартные) окислительно-восстановительные потенциалы е0 в водных растворах при 25 0с по отношению к нормальному водородному электроду
- •Рыбалкин Евгений Михайлович Ковалик Ольга Юрьевна химия
- •654007, Г. Новокузнецк, ул. Кирова, 42
Раздел 6. Химическая связь
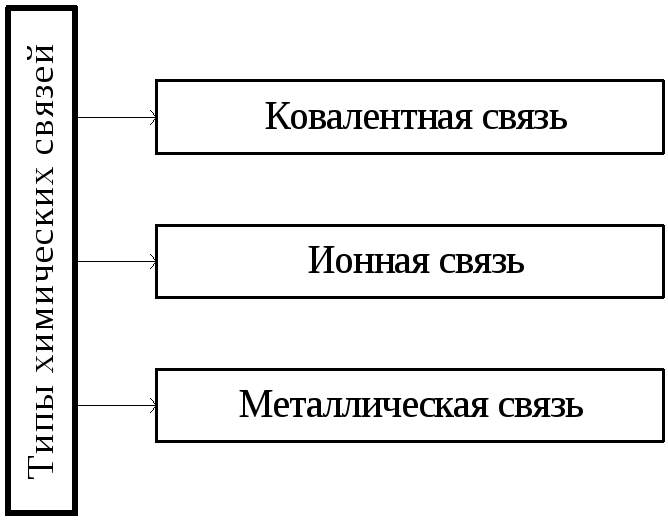
Ковалентная связь – химическая связь, осуществляемая за счет образования общей электронной пары.
Соединения с ковалентной связью образуют молекулярные или атомные кристаллические решетки.
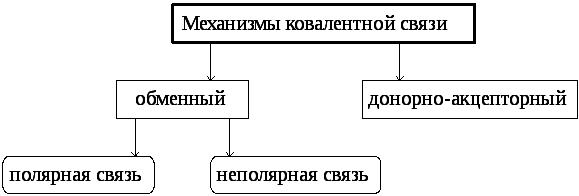
Обменный механизм происходит за счет перекрывания электронных облаков.
|
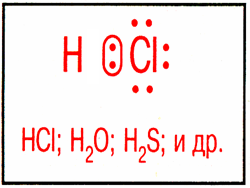
Неполярная ковалентная связь – электронное облако, образованное общей парой электронов, распределяется в пространстве симметрично относительно ядер обоих атомов.
|
Полярная ковалентная связь – электронное облако связи смещено к атому с большей относительной электроотрицательностью. |

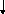
![]()

|
Донорно-акцепторный механизм происходит за счёт двухэлектронного облака атома (донора) и свободной орбитали другого атома (акцептора). Связь называется донорно-акцепторной или координационной.
|
|
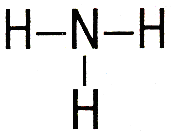
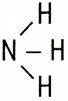
Например, ион NH4+ образуется за счёт образования четвёртой связи азотом из аммиака с ионом водорода:
В данном случае азот является донором, а водород – акцептором. Ион, образованный за счет координационной связи, называется комплексным ионом, а соединения, содержащие подобные ионы, – комплексными соединениями.
|
|
Изображение химической связи |
|
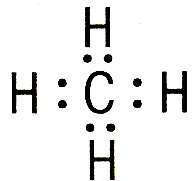
1) С помощью электронов в виде точек, поставленных у знака химического элемента.
|
|
2
или
|
|
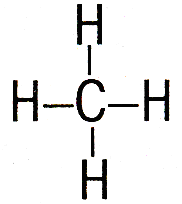
3) В виде чёрточки, которая символизирует пару электронов.
|
|
Свойства ковалентной связи |
|
1) Длина связи – это межъядерное расстояние. |
|
2) Энергия связи – количество энергии, которое необходимо для разрыва связи; измеряется в кДж/моль. |
|
3) Насыщаемость – способность атомов образовать ограниченное число ковалентных связей. Например: Н образует 1 связь, С - не более 4 связей. |
|
4) Направленность связи обусловливает пространственную структуру молекул, т. е. их геометрию (форму). |
|
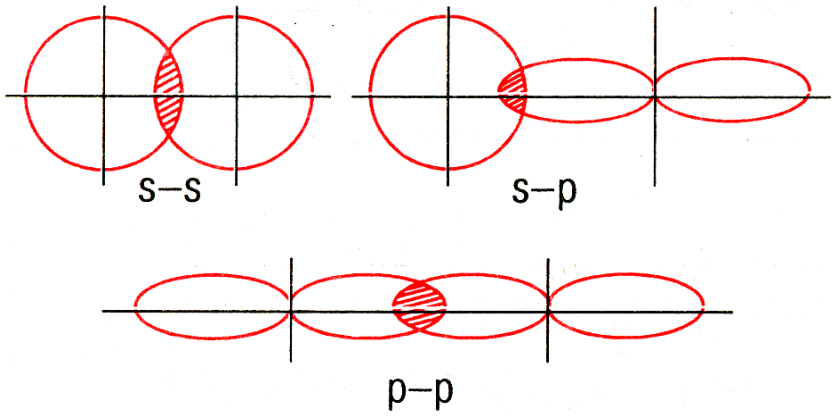
Способы перекрывания электронных облаков | |
|
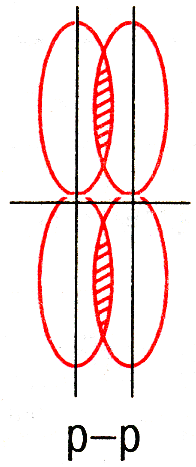
σ -связь – перекрывание электронных облаков вдоль оси, соединяющей центры атомов. |
π -связь – связь, возникающая между атомами, когда перекрывание электронных облаков происходит по обе стороны от линии, соединяющей ядра обоих атомов. |
|
|
|
|
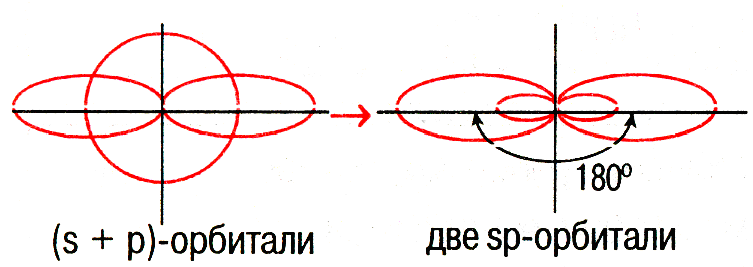
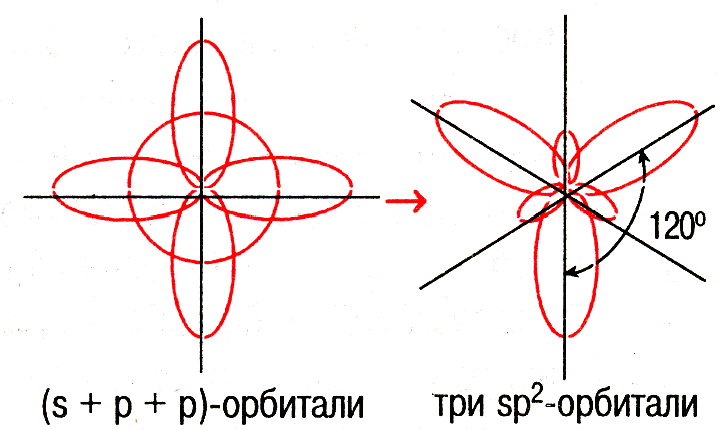
Гибридизация – выравнивание взаимодействующих орбиталей разных подуровней по форме и энергии. При этом расчетные формы новых орбиталей отличаются от исходных. | |
|
sp-гибридизация |
sp2- гибридизация |
|
|
|
|
Ионная или электровалентная связь – химическая связь между ионами, осуществляемая электростатическим притяжением. Образуется при взаимодействии атомов, которые сильно различаются по электроотрицательности. |
|
Н электроотрицтельность N
ионы Cl 1s22s22p63s23p5 → Cl0 + ē → Cl– 1s22s22p63s23p6
|
|
Свойства ионной связи | |
|
Ненаправленность. Каждый ион, представляющий как бы заряженный шар, может притягивать ион противоположного знака по любому направлению. | |
|
Ненасыщаемость. Взаимодействие ионов противоположного знака не приводит к компенсации силовых полей, способность притягивать по другим направлением остается. | |
|
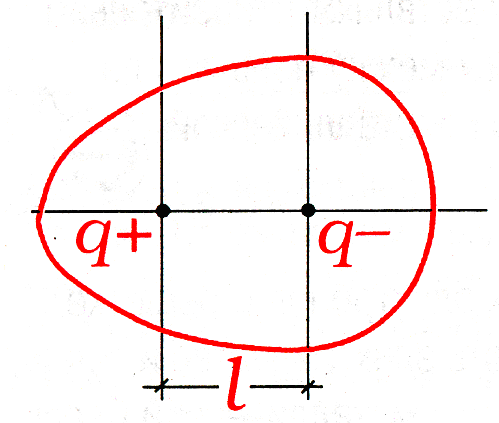
Полярные молекулы – молекулы при общей нейтральности представляют собой электрический диполь. Например: HCl.
|
|
|
μ = q∙l
где μ – электрический момент диполя. Мера полярности связи и молекулы. Выражается в Кл·м (Кулон-метр) от 0 до 3,33 Кл·м; q – эффективный заряд, заряд атома в молекуле; l – расстояние между противоположно заряженными центрами диполя. |
|
Поляризуемость – способность атомов, ионов и молекул приобретать дипольный момент (µ) в электрическом поле. |
|
Неполярные молекулы – молекулы, содержащие неполярную ковалентную связь – электронное облако симметрично по отношению к ядрам обоих атомов, µ = 0. Например: H2, O2, F2, Cl2 и др. |
|
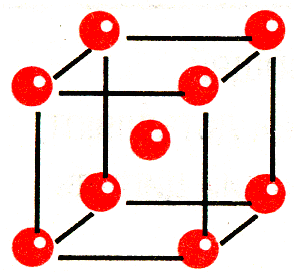
Металлическая связь – связь, которую осуществляют относительно свободные электроны между ионами или атомами металлов в кристаллической решетке. Наличие свободных электронов в решетки обуславливает проводимость электричества и тепла, металлический блеск. Ионы и атомы металла непосредственно не связаны, и их слои могут отдельно перемещаться относительно друг друга, отсюда ковкость и пластичность металлов. |
Кристаллическая решетка Na
Схема
|
|
Водородная связь – связь между атомом водорода, соединенным с атомом сильно электроотрицательного элемента, одной молекулы и сильно электроотрицательными (F, O, N) элементами другой молекулы. Возможно образование внутримолекулярной водородной связи. Обозначают точками, так как водородная связь в 15-20 раз слабее ковалентной. Водородная связь оказывает влияние на свойства вещества, так как нужна дополнительная энергия для разрыва водородной связи. |
Вода – Н2О
уксусная кислота – СН3СООН
|
|
Кристаллическая решетка – пространственный каркас, который возникает, если обозначить все частицы в кристалле в виде точек и соединить эти точки пересекающимися прямыми линиями. Узлы кристаллической решетки – точки, в которых размещены частицы. |
|
Типы кристаллических решеток | |
|
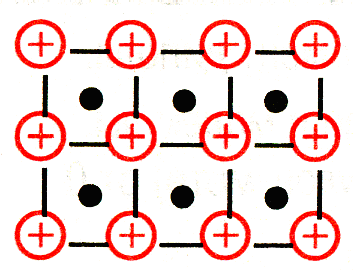
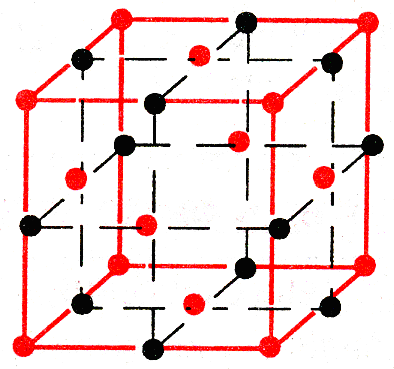
Ионная решетка – состоит из ионов, ее образуют вещества с ионной связью. |
Кристаллическая решетка NaCl
– Na+ –-
Cl– |
|
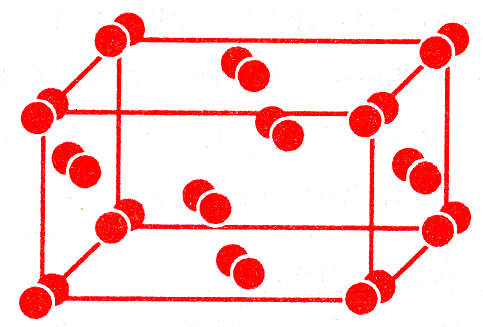
Молекулярная решетка – состоит из молекул, соединенных между собой слабыми межмолекулярными силами. |
Кристаллическая решетка йода I2
|
|
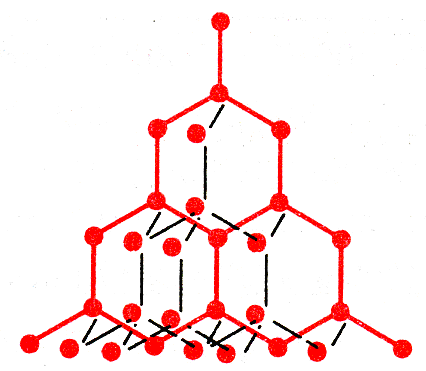
Атомная решетка – в узлах находятся атомы, которые соединены между собой прочной ковалентной связью; вещества тверды, прочны, не растворимы в воде, имеют высокую температуру плавления. |
Кристаллическая решетка алмаза С
|
|
Структурные формулы | ||||
|
Название |
молекула | |||
|
водорода |
воды |
аммиака |
метана | |
|
эмпирические формулы
|
H2 |
H2O |
NH3 |
CH4 |
|
электронные формулы |
H : H |
|
|
|
|
структурные формулы |
Н – Н |
Н – О – Н |
|
|
|
Степень окисления – это условный заряд атома в соединении, вычисленный исходя из предположения, что оно состоит только из ионов.
| |||
|
Отрицательное значение степени окисления имеют атомы, которые приняли электроны от других атомов, то есть в их сторону смещено связующее электронное облако. Например:Na+ |
Положительное значение степени окисления имеют атомы, отдающие свои электроны другим атомам, то есть связующее электронное облако оттянуто от них. Например:Cl– |
Нулевое значение степени окисления имеют атомы в молекулах простых веществ, электронное облако в равной мере принадлежит обоим атомам. Например: Na, Cl2, O2, H2
| |
|
Алгебраическая сумма степеней окисления атомов в соединении всегда равна нулю:
а в сложном ионе – заряду иона:
x= +6. | |||
|
Валентность – способность атомов элемента образовывать химические связи. Количественной мерой является число связей, образованных данным атомом с другими атомами или атомными группами. Валентность химических элементов принято определять числом ковалентных связей, которыми данный атом соединен с другими атомами. Валентность элементов определяется также числом электронных пар, образующих химическую связь. | |||
|
Например:
азот
–
N
7N
1s22s22p3 | |||
|
Валентность N = 3 | |||
|
Азот – N2 |
| ||
|
Гидразин – N2H4 |
| ||
|
Аммиак – NH3 |
| ||
|
Валентность N = 4 | |||
|
Ион
аммония – NH |
| ||
|
Валентность N = 5 | |||
|
Азотная кислота – HNO3 |
| ||


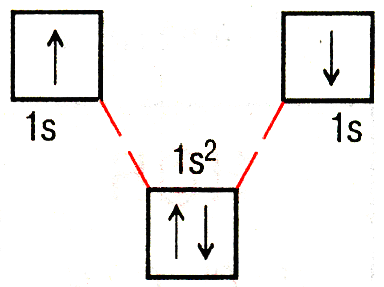 )
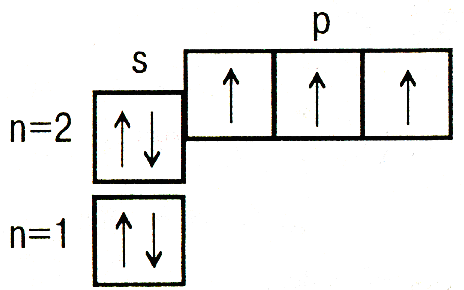
С помощью кватовых ячеек.
)
С помощью кватовых ячеек.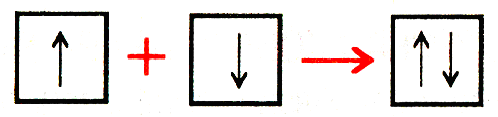
 Х(Сl)
= 2,85
Х(Сl)
= 2,85