- •Химия Учебное наглядное пособие
- •Содержание
- •Раздел 1. Основные понятия и законы химии
- •1.1. Атомно-молекулярное учение
- •1.2. Законы химии
- •Закон сохранения массы вещества
- •Способы выражения количества вещества эквивалентов
- •Раздел 2. Классификация неорганических веществ
- •2.1.Оксиды
- •Химические свойства оксидов
- •2.2. Гидроксиды металлов
- •Химические свойства гидроксидов
- •Доказательство амфотерности
- •2.3. Кислоты
- •2.4. Соли
- •Средние кислые основные
- •Получение солей
- •2.5. Комплексные соединения
- •Раздел 3. Растворы
- •3.1. Способы выражения концентрации растворов
- •3.2. Растворы неэлектролитов
- •3.3. Растворы электролитов. Электролитическая диссоциация
- •3.4. Ионно-молекулярные уравнения реакций
- •3.5. Гидролиз
- •Раздел 4. Элекрохимические системы
- •Законы Фарадея
- •4.1. Степень окисления
- •4.2. Окислительно-восстановительные реакции (овр)
- •Направление овр
- •4.3. Гальванический элемент Даниэля-Якоби
- •4.4. Электродвижущая сила (эдс)
- •Стандартный водородный электрод
- •4.5. Электролиз
- •Электролиз с инертным анодом
- •Электролиз с растворимым анодом
- •4.6. Коррозия и защита металлов от коррозии
- •Защита металлов от коррозии
- •Раздел 5. Периодический закон д.И.Менделеева
- •5.1. Строение атома
- •Состав ядра
- •5.2. Модель состояния электрона в атоме Квантовые числа
- •Возможные значения квантовых чисел
- •5.3.Основные положения строения электронных оболочек атома
- •Ряд последовательного заполнения электронами орбиталей
- •Раздел 6. Химическая связь
- •Раздел 7. Химическая кинетика и равновесие
- •Раздел 8. Химическая термодинамика
- •8.1. Параметры состояния системы
- •8.2. Закон Гесса
- •Раздел 9. Химия элементов
- •Углерод c
- •Физические свойства аллотропных модификаций c
- •Химические свойства с
- •Соединения с
- •Кремний Si
- •Соединения Si
- •Соединения n
- •Соли аммония
- •Особые химические свойства
- •Разложение нитратов: фосфор p
- •Соединения р
- •Халькогены
- •Кислород
- •Соединения s
- •Галогены f, Cl, Br, I хлор Cl2
- •Соединения Cl
- •Подгруппа хрома
- •Хром Cr
- •Подгруппа железа
- •Железо Fe
- •Раздел 10. Органическая химия
- •10.1.Углеводороды Предельные углеводороды. Алканы
- •Непредельные углеводороды. Алкены
- •Диеновые углеводороды
- •Ароматические углеводороды. Ряд бензола. Арены
- •Нефть и ее переработка
- •10.2. Кислородсодержащие органические соединения Спирты
- •Альдегиды
- •Формальдегид
- •Ацетальдегид
- •Поликонденсация
- •Кетоны r – c – r
- •Карбоновые кислоты
- •Определение строения веществ
- •11.1. Методы качественного анализа (реакции обнаружения) Окрашивание пламени (предварительная проба)
- •Реакции осаждения
- •Реакции с выделением газа
- •Качественный элементный анализ
- •Цветные реакции
- •Обнаружения газов
- •Реакции обнаружения органических соединений
- •Индентификация синтетических материалов
- •11.2. Методы количественного анализа Титриметрический анализ (объемный анализ)
- •Кондуктометрическое титрование
- •Потенциометрия
- •Окислительно-восстановительное титрование
- •Комплексонометрия
- •Осадительное титрование
- •Аргентометрия
- •Гравиметрия
- •11.3. Спектроскопические методы анализа
- •Ультрафиолетовая спектроскопия и абсорбционная спектроскопия в видимой области
- •Характерные инфракрасные полосы поглощения
- •Спектроскопия ядерного магнитного резонанса
- •11.4. Дифрактометрический метод анализа
- •Дифракция рентгеновых лучей для определения типа кристаллической решетки
- •Дифракция рентгеновых лучей для определения электронной плотности
- •Раздел 12. Химия окружающей среды Глобальные аспекты
- •Загрязнение окружающей среды
- •Охрана окружающей среды
- •Атмосфера как область окружающей среды
- •Загрязнение воздуха
- •Влияние вредных веществ на окружающую среду
- •Методы очистки воздуха
- •Гидросфера как область окружающей среды
- •Вредные примеси питьевой воды
- •Жёсткость воды
- •Сточные воды
- •Вредные вещества в сточных водах
- •Поступления сточных вод
- •Литосфера как область окружающей среды
- •Удобрения
- •Загрязнение стойкими биоцидами
- •Заражение ядовитыми тяжелыми металлами
- •Методы санации зараженных почв
- •Отходы в окружающей среде
- •Вторичное использование
- •Продовольствие и питание
- •Углеводы в качестве пищевого продукта
- •Жиры в качестве пищевого продукта
- •Протеины как продукт питания
- •Витамины
- •Минеральные вещества
- •Микроэлементы
- •Пищевые добавки
- •Консерванты
- •Раздел 13. Коллоидная химия
- •Адсорбция, ее виды
- •Дисперсные системы
- •Коллоидные растворы
- •Строение коллоидных частиц
- •Приложение а Физико-химические постоянные
- •Групповые названия химических элементов
- •Растворимость веществ в воде при температуре 25 °с
- •Эбуллиоскопические (Кэ) и криоскопические (Ккр) константы некоторых растворителей
- •Произведения растворимости некоторых малорастворимых электролитов при 25 °с
- •Возможные степени окисления элементов
- •Электронное строение атомов в основном состоянии
- •Стандартные термодинамические функции образования
- •Нормальные (стандартные) окислительно-восстановительные потенциалы е0 в водных растворах при 25 0с по отношению к нормальному водородному электроду
- •Рыбалкин Евгений Михайлович Ковалик Ольга Юрьевна химия
- •654007, Г. Новокузнецк, ул. Кирова, 42
Раздел 7. Химическая кинетика и равновесие
|
Учение о скоростях и механизмах химических реакций называется химической кинетикой. | |
|
Под скоростью химической реакции понимают изменения концентрации одного из реагирующих веществ в единицу времени в единице объема для гомогенной (однородной) системы и на границе раздела фаз для гетерогенной системы. | |
|
Фаза – совокупность всех однородных частей системы, обладающих одинаковым химическим составом и одинаковыми свойствами. | |
|
Гомогенные системы – системы, состоящие из одной фазы. Реакции, протекающие в ней, называются гомогенными. Химическая реакция в гомогенных системах протекает по всему объёму системы. |
Гетерогенные системы –системы, содержащие две и более число фаз. Реакции, протекающие в них, называются гетерогенными. Реакции в гетерогенных системах протекают на поверхности раздела фаз. |
|
Например: 2NH3 + 3Cl2 = 6HCl + N2 (все вещества находятся в газообразном состоянии) 2KOH + H2SO4 = K2SO4 + 2H2O (все вещества находятся в жидком растворе) |
Например: CO2(газ) + С(тв) = 2СО(газ) (реакция протекает на поверхности углерода) Mg(тв) + 2HCl(ж) = MgCl2(ж) + Н2(газ) (реакция протекает на поверхности магния) |
|
Обратимость химических реакций | |
|
Все химические реакции можно разбить на две группы: необратимые и обратимые реакции. | |
|
Необратимые реакции протекают до конца – до полного израсходования одного из реагирующих веществ.
|
Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Обратимая реакция может протекать как в прямом, так и в обратном направлениях. |
|
Например: Zn(тв) + 2HCl(ж) = ZnCl2(ж) + H2(газ)
|
Например: N2(газ) + 3Н2(газ) ↔ 2NH3(газ) |

|
Основные законы химической кинетики | ||
|
Зависимость скорости от концентрации определяется законом действия масс: Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степень их коэффициентов в уравнении реакций. | ||
|
Для обратимой реакции: аА + bВ ↔ сС + dD
υпр = kпр•C(A)a•C(B)b, υобр = kобр•С(C)c•C(D)d, где υпр., υобр. – скорости прямой и обратной реакций, моль/л∙с; | ||
|
C(А), C(B), С(C), C(D)– концентрации веществ А, В, С, D, моль/л; | ||
|
kпр, kобр – константы скорости прямой и обратной химической реак ции, которые зависят от химической природы реагирующих веществ, температуры и наличия катализатора; | ||
|
a, b, c, d – стехиометрические коэффициенты в уравнении реакций. | ||
|
Например, для гомогенной обратимой системы: 2SO2 + O2 = 2SO3: выражения скоростей реакции будет:υпр. = kпр•C2(SO2)•C(O2); υобр. = kобр•С2(SO3). |
Например, для гетерогенной реакции: 3Fe(к)+4Н2О(газ)=Fe3O4(тв)+4Н2(газ) выражения скоростей реакции будет: υпр. = kпр•C4(Н2О); υобр. = kобр•С4(Н2). | |
|
Химическое равновесие – термодинамическое равновесие в системе, в которой возможны прямые и обратные химические реакции. При химическом равновесии скорости всех реакций в двух противоположных направлениях равны между собой, поэтому в системе не наблюдается изменений макроскопических параметров, в том числе концентраций реагирующих веществ. Количественной характеристикой химического равновесия является константа равновесия (Кравн.). | ||
|
Для обратимой реакции в состоянии равновесия: аА + bВ ↔ сС + dD , Vпр = Vобр, kпр•[А]a•[В]b = kобр•[С]c•[D]d,
| ||
|
Например, для гомогенной реакции N2 +3H2 = 2NH3 константа равновесия будет равна:
|
Например, для гетерогенной реакции 3
Fe(тв)
+4Н2О(г)
= Fe3O4(тв)
+ 4Н2(г)
| |
|
где [NH3], [N2], [Н2], [Н2О] – концентрации веществ в состоянии равновесия (равновесные концентрации), моль/л. | ||
|
Правило Вант-Гоффа | ||
|
При изменении температуры на каждые 10˚ скорость большинства реакций изменяется в 2-4 раза. | ||
|
|
V1, V2 – скорость реакции соответственно, при t1 – начальная температура, t2 – конечная температура,
| |
|
γ – температурный коэффициент скорости реакции. | ||
|
Принцип Ле Шателье-Брауна |
|
Если на систему находящуюся в истинном равновесии, оказывают воздействие извне путем изменения какого либо из условий, определяющих состояние равновесия, то оно смещается в направлении того процесса, протекание которого ослабляет эффект произведенного воздействия. |
|
Изменение условий |
Направление смещения | |
|
Температура |
↑ повышение |
Смещается в сторону эндотермической реакции (∆Н˚>0). |
|
↓ понижение |
Смещается в сторону экзотермической реакции (∆Н˚<0). | |
|
Давление |
↑ повышение |
Равновесие реакции между газами смещается в сторону реакции, идущей с уменьшением объема. |
|
↓ понижение |
Равновесие реакции между газами смещается в сторону реакции, идущей с увеличением объема. | |
|
Концентрация исходных веществ |
↑ повышение |
Равновесие смещается в сторону продукта реакции. |
|
↓ понижение |
Равновесие смещается в сторону исходных веществ. | |
|
Например, как следует изменить температуру, давление и концентрацию исходных веществ в системе ZnS(тв)+3О2 (г) → 2ZnO(тв)+2SO2 (г), ∆Н˚<0, чтобы повысить выход оксида цинка?
Ответ: согласно принципу Ле-Шателье температуру необходимо понизить, т.к. реакция экзотермическая; давление повысить, т.к. реакция идет с уменьшением числа газовых фаз; концентрацию исходных веществ увеличить.
| ||
|
Энергия активации |
|
Активация – процесс превращения неактивных частиц в активные путем сообщения им дополнительной энергии. |
|
Энергия, которую надо сообщит молекулам (частицам) реагирующих веществ, чтобы превратить их в активные – энергия активации. Обозначается в Еа, выражается кДж/моль. |
|
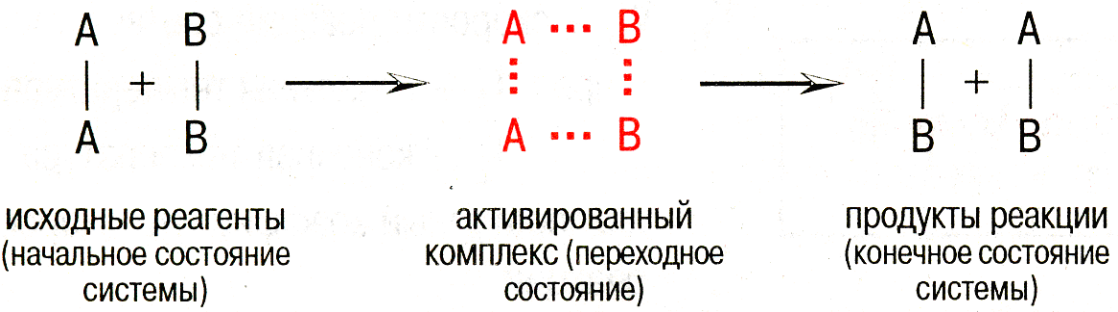
Изменение энергии реагирующей системы | |
|
А2 + В2 = 2АВ Н
|
Ннач – энергия исходного состояния (исходные вещества) |
|
Нкон – энергия конечного состояния (продукты реакции) | |
|
Еа – энергия активации прямой реакции | |
|
| |
|
– активированный
комплекс
| |
|
ΔН – тепловой эффект реакции | |
|
| |

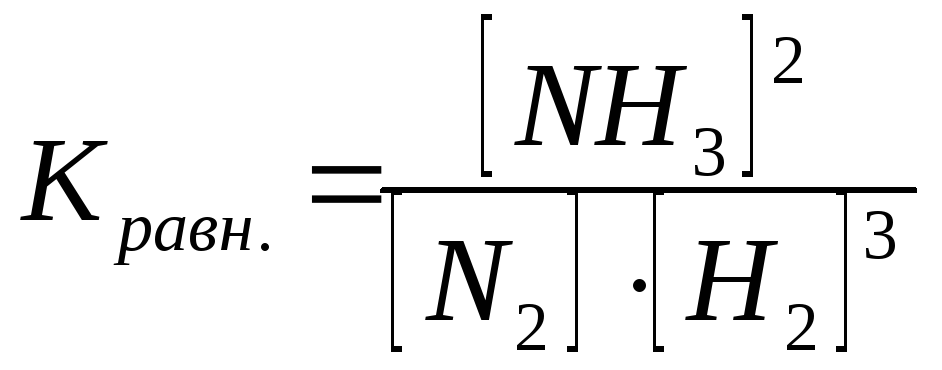 ,
,
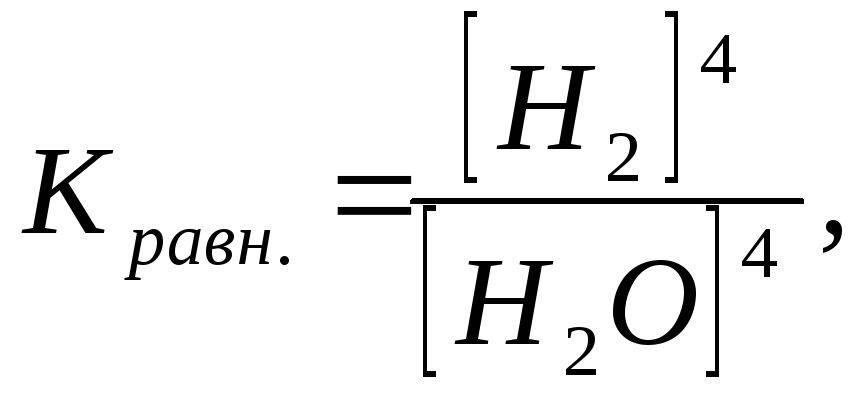
 еобходимо
преодолеть энергетический барьерС.
еобходимо
преодолеть энергетический барьерС.