
- •Химия Учебное наглядное пособие
- •Содержание
- •Раздел 1. Основные понятия и законы химии
- •1.1. Атомно-молекулярное учение
- •1.2. Законы химии
- •Закон сохранения массы вещества
- •Способы выражения количества вещества эквивалентов
- •Раздел 2. Классификация неорганических веществ
- •2.1.Оксиды
- •Химические свойства оксидов
- •2.2. Гидроксиды металлов
- •Химические свойства гидроксидов
- •Доказательство амфотерности
- •2.3. Кислоты
- •2.4. Соли
- •Средние кислые основные
- •Получение солей
- •2.5. Комплексные соединения
- •Раздел 3. Растворы
- •3.1. Способы выражения концентрации растворов
- •3.2. Растворы неэлектролитов
- •3.3. Растворы электролитов. Электролитическая диссоциация
- •3.4. Ионно-молекулярные уравнения реакций
- •3.5. Гидролиз
- •Раздел 4. Элекрохимические системы
- •Законы Фарадея
- •4.1. Степень окисления
- •4.2. Окислительно-восстановительные реакции (овр)
- •Направление овр
- •4.3. Гальванический элемент Даниэля-Якоби
- •4.4. Электродвижущая сила (эдс)
- •Стандартный водородный электрод
- •4.5. Электролиз
- •Электролиз с инертным анодом
- •Электролиз с растворимым анодом
- •4.6. Коррозия и защита металлов от коррозии
- •Защита металлов от коррозии
- •Раздел 5. Периодический закон д.И.Менделеева
- •5.1. Строение атома
- •Состав ядра
- •5.2. Модель состояния электрона в атоме Квантовые числа
- •Возможные значения квантовых чисел
- •5.3.Основные положения строения электронных оболочек атома
- •Ряд последовательного заполнения электронами орбиталей
- •Раздел 6. Химическая связь
- •Раздел 7. Химическая кинетика и равновесие
- •Раздел 8. Химическая термодинамика
- •8.1. Параметры состояния системы
- •8.2. Закон Гесса
- •Раздел 9. Химия элементов
- •Углерод c
- •Физические свойства аллотропных модификаций c
- •Химические свойства с
- •Соединения с
- •Кремний Si
- •Соединения Si
- •Соединения n
- •Соли аммония
- •Особые химические свойства
- •Разложение нитратов: фосфор p
- •Соединения р
- •Халькогены
- •Кислород
- •Соединения s
- •Галогены f, Cl, Br, I хлор Cl2
- •Соединения Cl
- •Подгруппа хрома
- •Хром Cr
- •Подгруппа железа
- •Железо Fe
- •Раздел 10. Органическая химия
- •10.1.Углеводороды Предельные углеводороды. Алканы
- •Непредельные углеводороды. Алкены
- •Диеновые углеводороды
- •Ароматические углеводороды. Ряд бензола. Арены
- •Нефть и ее переработка
- •10.2. Кислородсодержащие органические соединения Спирты
- •Альдегиды
- •Формальдегид
- •Ацетальдегид
- •Поликонденсация
- •Кетоны r – c – r
- •Карбоновые кислоты
- •Определение строения веществ
- •11.1. Методы качественного анализа (реакции обнаружения) Окрашивание пламени (предварительная проба)
- •Реакции осаждения
- •Реакции с выделением газа
- •Качественный элементный анализ
- •Цветные реакции
- •Обнаружения газов
- •Реакции обнаружения органических соединений
- •Индентификация синтетических материалов
- •11.2. Методы количественного анализа Титриметрический анализ (объемный анализ)
- •Кондуктометрическое титрование
- •Потенциометрия
- •Окислительно-восстановительное титрование
- •Комплексонометрия
- •Осадительное титрование
- •Аргентометрия
- •Гравиметрия
- •11.3. Спектроскопические методы анализа
- •Ультрафиолетовая спектроскопия и абсорбционная спектроскопия в видимой области
- •Характерные инфракрасные полосы поглощения
- •Спектроскопия ядерного магнитного резонанса
- •11.4. Дифрактометрический метод анализа
- •Дифракция рентгеновых лучей для определения типа кристаллической решетки
- •Дифракция рентгеновых лучей для определения электронной плотности
- •Раздел 12. Химия окружающей среды Глобальные аспекты
- •Загрязнение окружающей среды
- •Охрана окружающей среды
- •Атмосфера как область окружающей среды
- •Загрязнение воздуха
- •Влияние вредных веществ на окружающую среду
- •Методы очистки воздуха
- •Гидросфера как область окружающей среды
- •Вредные примеси питьевой воды
- •Жёсткость воды
- •Сточные воды
- •Вредные вещества в сточных водах
- •Поступления сточных вод
- •Литосфера как область окружающей среды
- •Удобрения
- •Загрязнение стойкими биоцидами
- •Заражение ядовитыми тяжелыми металлами
- •Методы санации зараженных почв
- •Отходы в окружающей среде
- •Вторичное использование
- •Продовольствие и питание
- •Углеводы в качестве пищевого продукта
- •Жиры в качестве пищевого продукта
- •Протеины как продукт питания
- •Витамины
- •Минеральные вещества
- •Микроэлементы
- •Пищевые добавки
- •Консерванты
- •Раздел 13. Коллоидная химия
- •Адсорбция, ее виды
- •Дисперсные системы
- •Коллоидные растворы
- •Строение коллоидных частиц
- •Приложение а Физико-химические постоянные
- •Групповые названия химических элементов
- •Растворимость веществ в воде при температуре 25 °с
- •Эбуллиоскопические (Кэ) и криоскопические (Ккр) константы некоторых растворителей
- •Произведения растворимости некоторых малорастворимых электролитов при 25 °с
- •Возможные степени окисления элементов
- •Электронное строение атомов в основном состоянии
- •Стандартные термодинамические функции образования
- •Нормальные (стандартные) окислительно-восстановительные потенциалы е0 в водных растворах при 25 0с по отношению к нормальному водородному электроду
- •Рыбалкин Евгений Михайлович Ковалик Ольга Юрьевна химия
- •654007, Г. Новокузнецк, ул. Кирова, 42
Кремний Si
|
В природе: в виде оксида SiO2 и солей кремниевой кислоты – силикатов, NaAlSi3O8 – полевой шпат, Al2O3·SiO2·nH2O – глины. |
|
Аллотропные модификации Si | |
|
Алмазоподобная структура sp3-гибридизация. Металлический блеск, электропроводен, инертен. |
Аморфный кремний Бурый порошок, более реакционноспособный. |
|
Получение Si | |
|
В лаборатории: 2Mg + SiO2 = 2MgO + Si SiCl4 + 2Zn = 2ZnCl2 + Si В промышленности: SiO2 + С = СО2 + Si | |
|
Химические свойства |
|
Si – сравнительно инертен, реагирует с сильными окислителями или восстановителями. Как правило, требуется высокая температура. Si – восстановитель
Si – окислитель
|
Соединения Si
|
Оксид кремния SiO2 – инертен, твердое вещество, тугоплавкое. 4 SiO2 – кислотный оксид SiO2 + 2NaOH = Na2SiO3 + H2О SiO2 + СaO = CaSiO3 SiO2
+ Na2CO3
|
|
Кремниевая кислота: H4SiO4 – ортокремниевая H2SiO3 – метакремниевая H2SiO3 – очень слабая кислота, в воде мало растворима. H2SiO3 = H2O + SiO2 (при нагревании)
Д
Получение: Na2SiO3
+ 2HCl = H2SiO3
+ NaCl H2SiO3 ↔ H+ + HSiO-3
|
|
Соли кремниевой кислоты – силикаты Соли Na и К растворимы в воде – жидкие стекла Сильный гидролиз 2Na2SiO3 + 2H2О = Na2Si2O5 + 2NaOH метосиликат Na диметосиликат Na |
|
Получение солей: SiO2 + Na2CO3 = Na2SiO3 + CO2; SiO2 + 2NaOH = Na2SiO3 + H2O.
|
|
Важнейшие искусственные силикаты | ||
|
Стекло |
Цемент |
Керамика |
|
Na2O·CaO·6SiO2 – обычное стекло. Получают плавлением из смеси Na2CO3 (сода), CaCO3 (известняк), SiO2 (белый песок)
= Na2O·CaO·6SiO2 K2CO3 (поташ)+CaSiO3+SiO2 – тугоплавкое стекло K2CO3+PbO+SiO2 – хрусталь
|
Серый порошок, при смешивании с водой затвердевает. Получают обжигом (1600˚С) до спекания смеси известняка, глины (клинкер) и добавок, размалывают в порошок. Цемент + вода + наполнитель (песок) = бетон |
Получают из природных глин путем формовки, сушки и обжига. |
Элементы VА группы
N, P, As, Sb, Bi
|
Общая характеристика N P As Sb
увеличение
атомной массы, усиливается
металлический характер
s p Степень окисления ns2np3 – последний уровень
|
АЗОТ N
|
В природе: в воздухе в свободном состоянии; в почве в виде соединений; в белковых веществах и органических соединениях. |
|
Получение:
NH4NO2 = N2↑ + 2H2O. |
|
Физические свойства: N2 – газ без цвета, запаха и вкуса, чуть легче воздуха, мало растворим в воде. Ткипения = 196˚С |
|
Химические свойства Степени окисления: +1, +2, +3, +4, +5, –1, –2, –3 N N2 + 6Li = 2Li3N (при комн. t) N2 + 3Ca = Ca3N2 (при высок. t) N – окислитель N2 +3H2 = 2NH3 (t высок., Р, Кат.) N2 + O2 = 2NO (t = 3000–4000˚C) N – восстановитель |
|
Применение: для получения аммиака; для создания инертной среды; для азотирования поверхности стальных изделий с целью увеличения прочности стали; для производства минеральных удобрений. Азот имеет важное значение в жизни растений и животных.
|

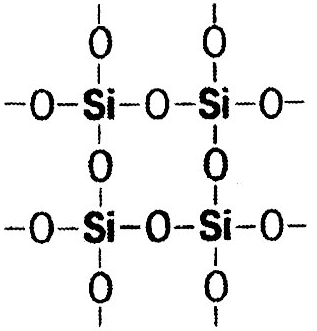 HF
+ SiO2
= SiF4↑
+ 2H2O
(травление стекла)
HF
+ SiO2
= SiF4↑
+ 2H2O
(травление стекла)




 -3ē
-3ē
 -5ē
-5ē
 d
+3ē
d
+3ē ≡N
– молекула азота, прочная связь, низкая
реакционная способность.
≡N
– молекула азота, прочная связь, низкая
реакционная способность.