- •Химия Учебное наглядное пособие
- •Содержание
- •Раздел 1. Основные понятия и законы химии
- •1.1. Атомно-молекулярное учение
- •1.2. Законы химии
- •Закон сохранения массы вещества
- •Способы выражения количества вещества эквивалентов
- •Раздел 2. Классификация неорганических веществ
- •2.1.Оксиды
- •Химические свойства оксидов
- •2.2. Гидроксиды металлов
- •Химические свойства гидроксидов
- •Доказательство амфотерности
- •2.3. Кислоты
- •2.4. Соли
- •Средние кислые основные
- •Получение солей
- •2.5. Комплексные соединения
- •Раздел 3. Растворы
- •3.1. Способы выражения концентрации растворов
- •3.2. Растворы неэлектролитов
- •3.3. Растворы электролитов. Электролитическая диссоциация
- •3.4. Ионно-молекулярные уравнения реакций
- •3.5. Гидролиз
- •Раздел 4. Элекрохимические системы
- •Законы Фарадея
- •4.1. Степень окисления
- •4.2. Окислительно-восстановительные реакции (овр)
- •Направление овр
- •4.3. Гальванический элемент Даниэля-Якоби
- •4.4. Электродвижущая сила (эдс)
- •Стандартный водородный электрод
- •4.5. Электролиз
- •Электролиз с инертным анодом
- •Электролиз с растворимым анодом
- •4.6. Коррозия и защита металлов от коррозии
- •Защита металлов от коррозии
- •Раздел 5. Периодический закон д.И.Менделеева
- •5.1. Строение атома
- •Состав ядра
- •5.2. Модель состояния электрона в атоме Квантовые числа
- •Возможные значения квантовых чисел
- •5.3.Основные положения строения электронных оболочек атома
- •Ряд последовательного заполнения электронами орбиталей
- •Раздел 6. Химическая связь
- •Раздел 7. Химическая кинетика и равновесие
- •Раздел 8. Химическая термодинамика
- •8.1. Параметры состояния системы
- •8.2. Закон Гесса
- •Раздел 9. Химия элементов
- •Углерод c
- •Физические свойства аллотропных модификаций c
- •Химические свойства с
- •Соединения с
- •Кремний Si
- •Соединения Si
- •Соединения n
- •Соли аммония
- •Особые химические свойства
- •Разложение нитратов: фосфор p
- •Соединения р
- •Халькогены
- •Кислород
- •Соединения s
- •Галогены f, Cl, Br, I хлор Cl2
- •Соединения Cl
- •Подгруппа хрома
- •Хром Cr
- •Подгруппа железа
- •Железо Fe
- •Раздел 10. Органическая химия
- •10.1.Углеводороды Предельные углеводороды. Алканы
- •Непредельные углеводороды. Алкены
- •Диеновые углеводороды
- •Ароматические углеводороды. Ряд бензола. Арены
- •Нефть и ее переработка
- •10.2. Кислородсодержащие органические соединения Спирты
- •Альдегиды
- •Формальдегид
- •Ацетальдегид
- •Поликонденсация
- •Кетоны r – c – r
- •Карбоновые кислоты
- •Определение строения веществ
- •11.1. Методы качественного анализа (реакции обнаружения) Окрашивание пламени (предварительная проба)
- •Реакции осаждения
- •Реакции с выделением газа
- •Качественный элементный анализ
- •Цветные реакции
- •Обнаружения газов
- •Реакции обнаружения органических соединений
- •Индентификация синтетических материалов
- •11.2. Методы количественного анализа Титриметрический анализ (объемный анализ)
- •Кондуктометрическое титрование
- •Потенциометрия
- •Окислительно-восстановительное титрование
- •Комплексонометрия
- •Осадительное титрование
- •Аргентометрия
- •Гравиметрия
- •11.3. Спектроскопические методы анализа
- •Ультрафиолетовая спектроскопия и абсорбционная спектроскопия в видимой области
- •Характерные инфракрасные полосы поглощения
- •Спектроскопия ядерного магнитного резонанса
- •11.4. Дифрактометрический метод анализа
- •Дифракция рентгеновых лучей для определения типа кристаллической решетки
- •Дифракция рентгеновых лучей для определения электронной плотности
- •Раздел 12. Химия окружающей среды Глобальные аспекты
- •Загрязнение окружающей среды
- •Охрана окружающей среды
- •Атмосфера как область окружающей среды
- •Загрязнение воздуха
- •Влияние вредных веществ на окружающую среду
- •Методы очистки воздуха
- •Гидросфера как область окружающей среды
- •Вредные примеси питьевой воды
- •Жёсткость воды
- •Сточные воды
- •Вредные вещества в сточных водах
- •Поступления сточных вод
- •Литосфера как область окружающей среды
- •Удобрения
- •Загрязнение стойкими биоцидами
- •Заражение ядовитыми тяжелыми металлами
- •Методы санации зараженных почв
- •Отходы в окружающей среде
- •Вторичное использование
- •Продовольствие и питание
- •Углеводы в качестве пищевого продукта
- •Жиры в качестве пищевого продукта
- •Протеины как продукт питания
- •Витамины
- •Минеральные вещества
- •Микроэлементы
- •Пищевые добавки
- •Консерванты
- •Раздел 13. Коллоидная химия
- •Адсорбция, ее виды
- •Дисперсные системы
- •Коллоидные растворы
- •Строение коллоидных частиц
- •Приложение а Физико-химические постоянные
- •Групповые названия химических элементов
- •Растворимость веществ в воде при температуре 25 °с
- •Эбуллиоскопические (Кэ) и криоскопические (Ккр) константы некоторых растворителей
- •Произведения растворимости некоторых малорастворимых электролитов при 25 °с
- •Возможные степени окисления элементов
- •Электронное строение атомов в основном состоянии
- •Стандартные термодинамические функции образования
- •Нормальные (стандартные) окислительно-восстановительные потенциалы е0 в водных растворах при 25 0с по отношению к нормальному водородному электроду
- •Рыбалкин Евгений Михайлович Ковалик Ольга Юрьевна химия
- •654007, Г. Новокузнецк, ул. Кирова, 42
Диеновые углеводороды
СnH2n-2
|
Химические свойства характерные для непредельных углеводородов.
Например: Н2С=СНСН=СН2+Br2→ →CHBrCH=CHCHBr |
Номенклатура Название углеводородов, содержащих две двойные связи, оканчивается на -диен и указывает место расположения двойных связей. Н2С=СНСН=СН2 бутадиен-1,3 Н СН3 2-метил бутадиен-1,3 |
|
Получение: 1) способ Лебедева 2СН3СНОН→Н2С=СНСН=СН2+2Н2О; (пропускание паров этилового спирта над катализатором) 2) каталитическое дегидрирование СН3СН2СН2СН3→СН2=СНСН=СН2+2Н2. |
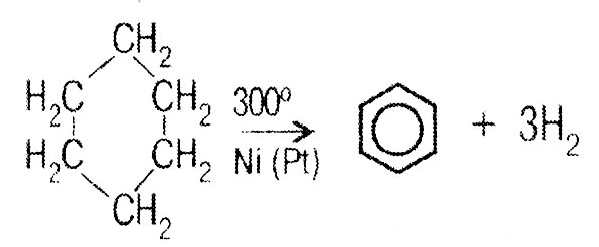
Ароматические углеводороды. Ряд бензола. Арены
СnH2n-6
|
Строение бензола
|
|
Физические свойства бензола Бензол – бесцветная, летучая, огнеопасная жидкость со своеобразным запахом, не растворима в воде. Горит коптящим пламенем. Смесь паров бензола с воздухом взрывоопасна. Бензол ядовит.
|
|
Химические свойства |
|
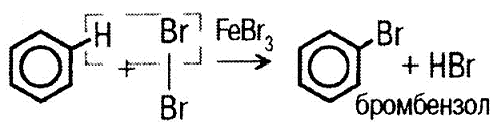
I. Реакция замещения 1) с галогенами:
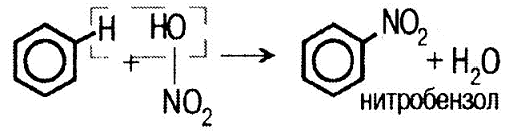
2) нитрование:
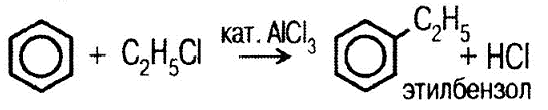
Реакция идет в присут- ствии концентрированной серной кислоты. 3) с галогенопроизводными углеводородами (алкилирование):
.
II. Реакции присоединения 1
;
2
. .
III. Окисление боковых цепей алкилбензолов
.
|
|
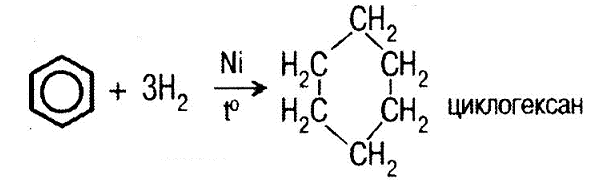
Получение: 1 2) дегидрогенизация а) из циклогексана: ;;
б) из гексана:
СН3СН2СН2СН2СН2СН3
3) способ Зелинского из ацетилена(тримеризация):
3НС≡СН
|
Нефть и ее переработка

10.2. Кислородсодержащие органические соединения Спирты
СnH2n+1OH или ROH
|
Номенклатура. Название углеводорода + окончание ол →спирт. Определить с каким по счету атомом углерода связана ОН-группа, или с каким атомом углерода (первичным, вторичным…).
вторичный бутиловый спирт или бутанол-2 | ||
|
1) одноатомный спирт содержит одну гидроксильные группы СН3ОН метанол
|
2) двухатомный спирт – две гидроксильные группы СН2 ОН С этиленгликоль |
3) трехатомный спирт – три гидроксильные группы С ОН ОН ОН глицерин |
|
Ф
Н
Н Н
C
C
О Н Н
Н
электронная
формула Жидкости (до 12 атомов С), твердые в в
|
|
Химические свойства |
|
1) с Ме (Na, K) 2C2H5OH+2Na↔2C2H5ONa+H2; алкоголят натрия Алкоголяты – непрочные вещества, разлагаются водой: C2H5ONa+Н2О↔C2H5OH+NaОН; 2) с щелочами C2H5OH+NaОН↔C2H5ONa+Н2О; 3 Н 4) горение 2СН3ОН+3О2→2СО2+4Н2О; 5)
дегидратация C2H5OH |
|
Метиловый спирт СН3ОН Метанол, древесный спирт – бесцветная жидкость, сильный яд. Получение: СО+2Н2 Применение: растворитель для синтеза формальдегида, красителей и т.д. |
|
Этиловый спирт С2Н5ОН Бесцветная жидкость, tкип=78,3˚С, tзамерз= –114˚С. Горит светящимся пламенем. Получение: 1) брожение сахаристых веществ: С6Н12О6→2С2Н5ОН+2СО2; 2) древесина → глюкоза → спирт; 3) гидратация: СН2=СН2+Н2О Применение: для получения синтетического каучука, пластмасс; растворитель; для производства диэтилового эфира, красителей, уксусной кислоты, пороха; в медицине. |
|
Гликоли СnH2n(OH)2 Этиленгликоль СН2ОН–СН2ОН – сиропообразная жидкость, без запаха, ядовит, смешивается с водой, гигроскопичен. Химические свойства как у одноатомных спиртов. Н
и
;
с
.
Получение: 1) СН2=СН2 + Н2О + [O] → CH2OH–СН2ОН; 2) СН2Cl–СН2Cl + 2NaOH → CH2OH–СН2ОН + 2NaCl.
|
|
Глицерин СН2ОН–СНОН–СН2ОН Бесцветная, вязкая, гигроскопичная жидкость, сладкая на вкус. Химические свойства близкие к этиленгликолю: 1
2) нитрование:
3) с карбоновыми кислотами → сложные эфиры, жиры, масла.
Получение:
|
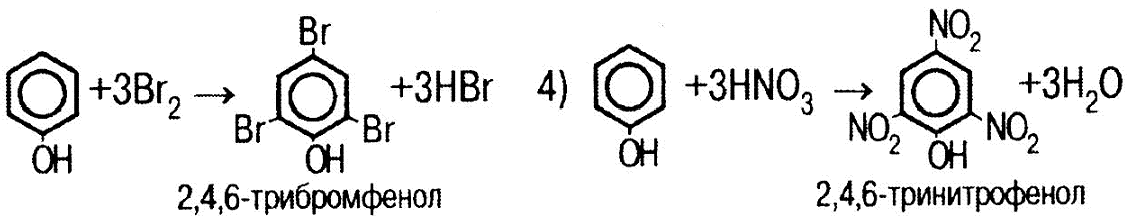
Фенолы
|
Ф
|
|
Физические свойства С6Н5ОН (карболовая кислота): бесцветное кристаллическое вещество с резким запахом; tплавл=42,3˚С, tкип=182˚С, ядовит, антисептик. |
|
Химические свойства:
.
|
|
Получение: 1) из каменноугольной смолы при сухой перегонке угля; 2) синтетическим путем из бензола и пропилена. |
![]()

 2С=ССН=СН2
2С=ССН=СН2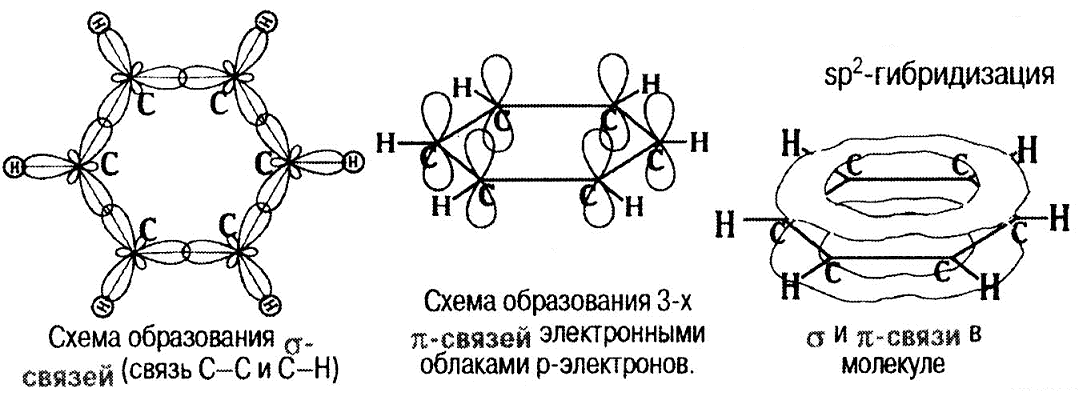
 )гидрогенизация:
)гидрогенизация: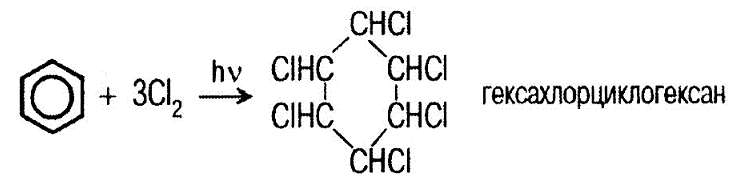 )
с хлором:
)
с хлором: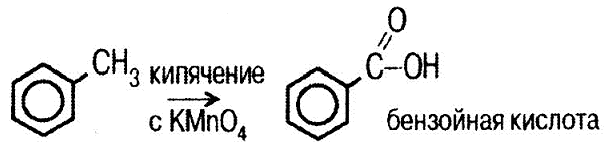
 )
в большом количестве из нефти, из
каменноугольной смолы путем сухой
перегонки каменного угля.
)
в большом количестве из нефти, из
каменноугольной смолы путем сухой
перегонки каменного угля.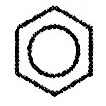
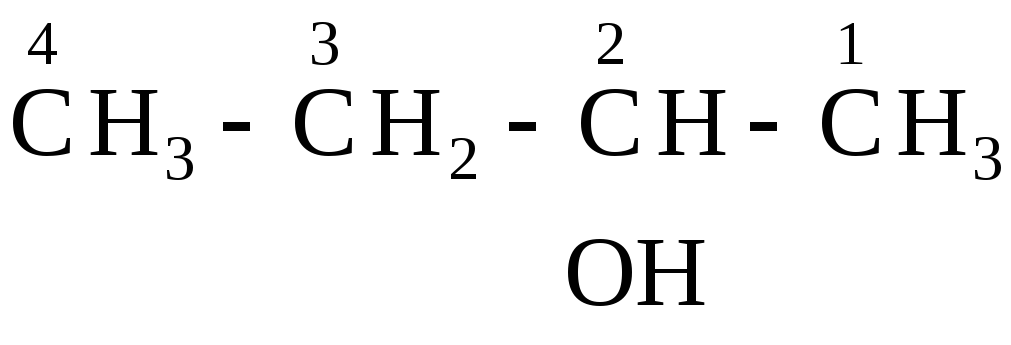

 Н2
ОН
Н2
ОН

 Н2
– СН – СН2
Н2
– СН – СН2





 ещества
(более 12 атомов С); легче
ещества
(более 12 атомов С); легче

 оды
растворяются в воде.
оды
растворяются в воде. )
окисление C2H5OH+[O]
)
окисление C2H5OH+[O]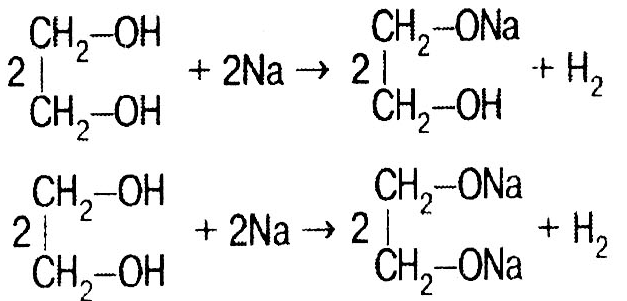 апример,
реакция с натрием:
апример,
реакция с натрием: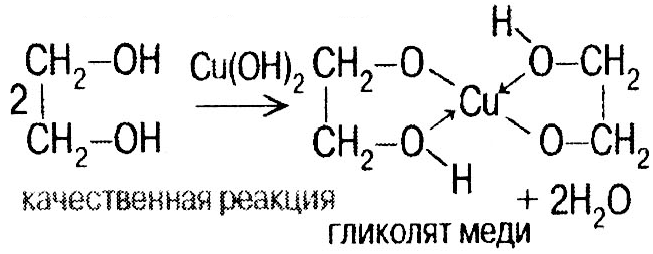 ли
с гидроксидом меди:
ли
с гидроксидом меди: щелочами:
щелочами: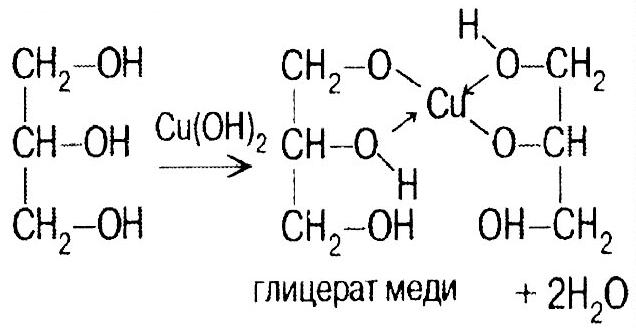 )
с гидроксидом меди:
)
с гидроксидом меди: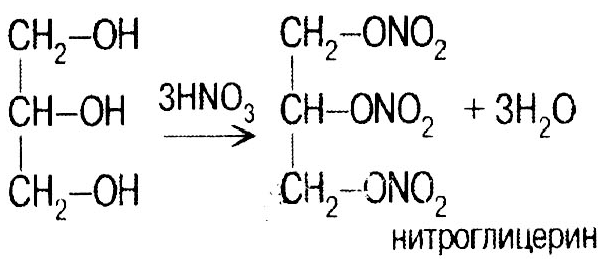
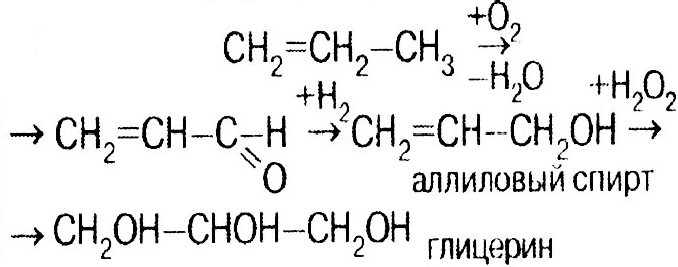
 енолы
– в молекуле гидроксильная группа
связана с бензольным кольцом.
енолы
– в молекуле гидроксильная группа
связана с бензольным кольцом.