
- •Химия Учебное наглядное пособие
- •Содержание
- •Раздел 1. Основные понятия и законы химии
- •1.1. Атомно-молекулярное учение
- •1.2. Законы химии
- •Закон сохранения массы вещества
- •Способы выражения количества вещества эквивалентов
- •Раздел 2. Классификация неорганических веществ
- •2.1.Оксиды
- •Химические свойства оксидов
- •2.2. Гидроксиды металлов
- •Химические свойства гидроксидов
- •Доказательство амфотерности
- •2.3. Кислоты
- •2.4. Соли
- •Средние кислые основные
- •Получение солей
- •2.5. Комплексные соединения
- •Раздел 3. Растворы
- •3.1. Способы выражения концентрации растворов
- •3.2. Растворы неэлектролитов
- •3.3. Растворы электролитов. Электролитическая диссоциация
- •3.4. Ионно-молекулярные уравнения реакций
- •3.5. Гидролиз
- •Раздел 4. Элекрохимические системы
- •Законы Фарадея
- •4.1. Степень окисления
- •4.2. Окислительно-восстановительные реакции (овр)
- •Направление овр
- •4.3. Гальванический элемент Даниэля-Якоби
- •4.4. Электродвижущая сила (эдс)
- •Стандартный водородный электрод
- •4.5. Электролиз
- •Электролиз с инертным анодом
- •Электролиз с растворимым анодом
- •4.6. Коррозия и защита металлов от коррозии
- •Защита металлов от коррозии
- •Раздел 5. Периодический закон д.И.Менделеева
- •5.1. Строение атома
- •Состав ядра
- •5.2. Модель состояния электрона в атоме Квантовые числа
- •Возможные значения квантовых чисел
- •5.3.Основные положения строения электронных оболочек атома
- •Ряд последовательного заполнения электронами орбиталей
- •Раздел 6. Химическая связь
- •Раздел 7. Химическая кинетика и равновесие
- •Раздел 8. Химическая термодинамика
- •8.1. Параметры состояния системы
- •8.2. Закон Гесса
- •Раздел 9. Химия элементов
- •Углерод c
- •Физические свойства аллотропных модификаций c
- •Химические свойства с
- •Соединения с
- •Кремний Si
- •Соединения Si
- •Соединения n
- •Соли аммония
- •Особые химические свойства
- •Разложение нитратов: фосфор p
- •Соединения р
- •Халькогены
- •Кислород
- •Соединения s
- •Галогены f, Cl, Br, I хлор Cl2
- •Соединения Cl
- •Подгруппа хрома
- •Хром Cr
- •Подгруппа железа
- •Железо Fe
- •Раздел 10. Органическая химия
- •10.1.Углеводороды Предельные углеводороды. Алканы
- •Непредельные углеводороды. Алкены
- •Диеновые углеводороды
- •Ароматические углеводороды. Ряд бензола. Арены
- •Нефть и ее переработка
- •10.2. Кислородсодержащие органические соединения Спирты
- •Альдегиды
- •Формальдегид
- •Ацетальдегид
- •Поликонденсация
- •Кетоны r – c – r
- •Карбоновые кислоты
- •Определение строения веществ
- •11.1. Методы качественного анализа (реакции обнаружения) Окрашивание пламени (предварительная проба)
- •Реакции осаждения
- •Реакции с выделением газа
- •Качественный элементный анализ
- •Цветные реакции
- •Обнаружения газов
- •Реакции обнаружения органических соединений
- •Индентификация синтетических материалов
- •11.2. Методы количественного анализа Титриметрический анализ (объемный анализ)
- •Кондуктометрическое титрование
- •Потенциометрия
- •Окислительно-восстановительное титрование
- •Комплексонометрия
- •Осадительное титрование
- •Аргентометрия
- •Гравиметрия
- •11.3. Спектроскопические методы анализа
- •Ультрафиолетовая спектроскопия и абсорбционная спектроскопия в видимой области
- •Характерные инфракрасные полосы поглощения
- •Спектроскопия ядерного магнитного резонанса
- •11.4. Дифрактометрический метод анализа
- •Дифракция рентгеновых лучей для определения типа кристаллической решетки
- •Дифракция рентгеновых лучей для определения электронной плотности
- •Раздел 12. Химия окружающей среды Глобальные аспекты
- •Загрязнение окружающей среды
- •Охрана окружающей среды
- •Атмосфера как область окружающей среды
- •Загрязнение воздуха
- •Влияние вредных веществ на окружающую среду
- •Методы очистки воздуха
- •Гидросфера как область окружающей среды
- •Вредные примеси питьевой воды
- •Жёсткость воды
- •Сточные воды
- •Вредные вещества в сточных водах
- •Поступления сточных вод
- •Литосфера как область окружающей среды
- •Удобрения
- •Загрязнение стойкими биоцидами
- •Заражение ядовитыми тяжелыми металлами
- •Методы санации зараженных почв
- •Отходы в окружающей среде
- •Вторичное использование
- •Продовольствие и питание
- •Углеводы в качестве пищевого продукта
- •Жиры в качестве пищевого продукта
- •Протеины как продукт питания
- •Витамины
- •Минеральные вещества
- •Микроэлементы
- •Пищевые добавки
- •Консерванты
- •Раздел 13. Коллоидная химия
- •Адсорбция, ее виды
- •Дисперсные системы
- •Коллоидные растворы
- •Строение коллоидных частиц
- •Приложение а Физико-химические постоянные
- •Групповые названия химических элементов
- •Растворимость веществ в воде при температуре 25 °с
- •Эбуллиоскопические (Кэ) и криоскопические (Ккр) константы некоторых растворителей
- •Произведения растворимости некоторых малорастворимых электролитов при 25 °с
- •Возможные степени окисления элементов
- •Электронное строение атомов в основном состоянии
- •Стандартные термодинамические функции образования
- •Нормальные (стандартные) окислительно-восстановительные потенциалы е0 в водных растворах при 25 0с по отношению к нормальному водородному электроду
- •Рыбалкин Евгений Михайлович Ковалик Ольга Юрьевна химия
- •654007, Г. Новокузнецк, ул. Кирова, 42
Раздел 9. Химия элементов
Элементы IIIА группы
B, Al, Ga, In, Ti
|
Общая характеристика элементов
в м с Ti
ns2np1 – электронная формула последнего уровня p
Максимальная
степень окисления
|
В
природе: Алюмосиликаты
– соли, образованные оксидами Al,
Si,
щелочных и щелочноземельных металлов; бокситы
– Al2O3·nH2O; глины
– Al2O3·nSiO2; нефелины
– KNa3[AlSiO4]4; корунд
– минерал Al2O3; криолит
– минерал AlF3·3NaF
или Na3[AlF6]![]()
АЛЮМИНИЙ
AL
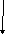
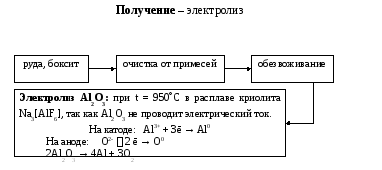
Физические
свойства: серебристый
металл, легкий и прочный; электрическая
проводимость и теплопроводность
высокие; легко поддается обработке;
легко
образует сплавы.
|
Химические свойства Al |
гидроксоалюминат
|
|
Алюмотермия – получение металлов (Fe, Cr, Mn, Ti, W) из их оксидов: 8Al + 3Fe3O4 = 4Al2O3 + 9Fe (термит)
|
|
Применение: Al – конструкционный материал, входит в состав сплавов, например: дюралюминий (с 5% Cu и 2% Mg) и др.; устойчив к коррозии; алюминиевые бронзы (Cu + 5% Al) – для чеканки монет; пигмент краски «серебрянки»; в металлургии – для получения металлов; для сварки стали.
|
СОЕДИНЕНИЯ Al3+
|
Оксид Al2O3 (корунд) |
Гидроксид Al(OH)3 | ||
|
Белые, твердые вещества, не растворяются в воде. | |||
|
Получение | |||
4Al + 3O2 = 2Al2O3 (сжигание в O2) 2Al(OH)3 = Al2O3 + H2O (прокаливание) |
AlCl3 + 2NaOH = Al(OH)3↓+NaCl Al2S3 + 6H2O =2Al(OH)3↓+3H2S↑ Na[Al(OH)4]+HCl=Al(OH)3+NaCl+H2O | ||
|
Амфотерные свойства | |||
2Na[Al(OH)∙(H2O)2]
|
| ||
Элементы IVА группы
С, Si, Ge, Sn, Pb
|
Общая характеристика элементов
электроположительность Si
металлические свойства Pb
ns2np2 – последний уровень
s p степень окисления Валентность 2, 4 |


 B
B  озрастаютAl
озрастаютAl еталлическиеGa
еталлическиеGa
 войстваIn
войстваIn 

 s
s

 Al
+ 6H2SO4(конц.)
= Al2(SO4)3
+ 3SO2↑
+6H2O
Al
+ 6H2SO4(конц.)
= Al2(SO4)3
+ 3SO2↑
+6H2O




 растет
размер атома и C
растет
размер атома и C  усиливаются Ge
усиливаются Ge восстановительные Sn
восстановительные Sn

 -4ē
-4ē

 -2ē
-2ē
 d
+4ē
d
+4ē