
- •Оглавление
- •ВВЕДЕНИЕ
- •1. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
- •2. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
- •2.1. Модели строения атома
- •2.2. Двойственная природа электрона
- •2.3. Атомное ядро. Изотопы, изобары
- •2.4. Квантовые числа. Принцип Паули
- •2.5. Правило Гунда
- •2.7. Периодический закон Д. И. Менделеева
- •3.1. Параметры химической связи
- •3.2. Ковалентная связь
- •3.3. Ионная связь
- •3.4. Водородная связь
- •3.5. Металлическая связь
- •4. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •4.1. Строение комплексных соединений
- •4.3. Изомерия комплексных соединений
- •4.4. Диссоциация комплексных соединений. Константа нестойкости комплексного иона
- •5. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
- •5.1. Внутренняя энергия и энтальпия
- •5.2. Энтропия
- •5.3. Энергия Гиббса
- •6. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- •6.2. Понятие о катализе и катализаторах
- •6.3. Колебательные реакции
- •6.4. Химическое равновесие и его смещение
- •6.5. Фазовые равновесия
- •7. РАСТВОРЫ
- •7.1. Способы выражения концентрации растворов
- •7.2. Растворы неэлектролитов
- •7.3. Растворы электролитов
- •7.3.5. Закон разбавления Оствальда
- •7.4. Гидролиз солей
- •7.5. Жесткость воды и методы ее устранения
- •8. ДИСПЕРСНЫЕ СИСТЕМЫ
- •8.1. Классификация дисперсных систем
- •8.2. Получение дисперсных систем
- •8.3. Строение мицелл
- •8.4. Устойчивость дисперсных систем
- •9. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •9.1. Окислительно-восстановительные реакции
- •9.2. Измерение электродных потенциалов металлов
- •9.3. Гальванические элементы
- •9.4. Электролиз
- •10. КОРРОЗИЯ МЕТАЛЛОВ
- •10.1. Виды коррозии
- •10.1.1. Химическая коррозия
- •10.1.2. Электрохимическая коррозия
- •10.2. Защита металлов от коррозии
- •11. ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ
- •11.1. Классификация металлов
- •11.2. Физические свойства металлов
- •11.3. Химические свойства металлов
- •11.4. Способы получения металлов из руд
- •12. ПОЛИМЕРЫ И ОЛИГОМЕРЫ
- •12.1. Основные понятия
- •12.2. Классификация и номенклатура полимеров
- •12.3. Применение полимеров и олигомеров
- •13. ХИМИЧЕСКАЯ ИДЕНТИФИКАЦИЯ
- •13.1. Порядок выполнения анализа вещества
- •13.2. Качественный анализ
- •13.3. Физико-химические методы анализа
- •БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- •СЛОВАРЬ ОСНОВНЫХ ТЕРМИНОВ
- •ПРИЛОЖЕНИЕ

ПРИЛОЖЕНИЕ
Таблица 1
Орбитальный атомный радиус, первый потенциал ионизации, сродство к электрону, относительная электроотрицательность элементов
Элемент |
Rорб, н ·м |
J, кДж/моль |
Е, кДж/моль |
ОЭО, отн. ед. |
Н |
0,053 |
1 310 |
73 |
2,1 |
He |
0,029 |
2 370 |
–21 |
0 |
Li |
0,159 |
520 |
57 |
1,0 |
Be |
0,104 |
900 |
–18 |
1,5 |
B |
0,078 |
800 |
29 |
2,0 |
C |
0,062 |
1 090 |
123 |
2,5 |
N |
0,052 |
1 400 |
–20 |
3,0 |
O |
0,045 |
1 310 |
142 |
3,5 |
F |
0,040 |
1 680 |
333 |
4,0 |
Ne |
0,035 |
2 080 |
123 |
0 |
Na |
0,171 |
496 |
33 |
0,9 |
Mg |
0,128 |
738 |
–21 |
1,2 |
Al |
0,131 |
578 |
48 |
1,5 |
Si |
0,107 |
768 |
178 |
1,8 |
P |
0,092 |
1 010 |
71 |
2,1 |
S |
0,081 |
1 000 |
200 |
2,5 |
Cl |
0,073 |
1 250 |
350 |
3,0 |
Ar |
0,066 |
1 520 |
–36 |
0 |
K |
0,216 |
419 |
48 |
0,8 |
Ca |
0,169 |
590 |
–186 |
1,0 |
Sc |
0,157 |
630 |
–70 |
1,3 |
Ti |
0,148 |
658 |
38 |
1,5 |
V |
0,140 |
650 |
63 |
1,6 |
Cr |
0,145 |
653 |
95 |
1,6 |
Mn |
0,128 |
717 |
–94 |
1,5 |
Fe |
0,123 |
762 |
56 |
1,8 |
Co |
0,118 |
759 |
91 |
1,8 |
Ni |
0,114 |
737 |
– |
1,8 |
Cu |
0,119 |
745 |
118 |
1,9 |
Химия. Учеб. пособие |
-215- |

ПРИЛОЖЕНИЕ
Таблица 2
Стандартные потенциалы металлических и газовых электродов
Электрод |
Электродная реакция |
||
Li+/Li |
Li+ + ē ←→ Li |
||
Rb+/Rb |
Rb+ + ē ←→ Rb |
||
K+/K |
K+ + ē ←→ K |
||
Cs+/Cs |
Cs+ + ē ←→ Cs |
||
Ra2+/Ra |
Ra2+ |
+ 2ē ←→ Ra |
|
Ba2+/Ba |
Ba2+ + 2 ē ←→ Ba |
||
Ca2+/Ca |
Ca2+ |
+ 2ē ←→ Ca |
|
Na+/Na |
Na+ + ē ←→ Na |
||
Mg2+/Mg |
Mg2+ + ē ←→ Mg |
||
Be2+/Be |
Be2+ |
+ 2ē ←→ Be |
|
Al3+/Al |
Al3+ |
+ 3ē ←→ Al |
|
Ti2+/Ti |
Ti2+ |
+ 2ē ←→ Ti |
|
V2+/V |
V2+ + 2ē ←→ V |
||
Mn2+/Mn |
Mn2+ |
+ 2ē ←→ Mn |
|
Cr2+/Cr |
Cr2+ |
+ 2ē ←→ Cr |
|
Zn2+/Zn |
Zn2+ |
+ 2ē ←→ Zn |
|
Cr3+/Cr |
Cr3+ + 3 ē ←→ Cr |
||
Fe2+/Fe |
Fe2+ |
+ 2ē ←→ Fe |
|
Cd2+/Cd |
Cd2+ |
+ 2ē ←→ Cd |
|
Co2+/Co |
Co2+ + 2 ē ←→ Cо |
||
Ni2+/Ni |
Ni2+ + ē ←→ Ni |
||
Sn2+/Sn |
Sn2+ + 2ē ←→ Sn |
||
Pb2+/Pb |
Pb2+ + 2 ē ←→ Pb |
||
Fe3+/Fe |
Fe3+ + ē ←→ Fe |
||
H+/H |
H+ + ē ←→ H |
||
Ge2+/Ge |
Ge2+ |
+ 2ē ←→ Ge |
|
Cu2+/Cu |
Cu2+ |
+ 2ē ←→ Cu |
|
O2/OH– |
½O2 + H2O + 2ē ←→ 2OH– |
||
Cu+/Cu |
Cu+ + ē ←→ Cu |
||
Ag+/Ag |
Ag+ + ē ←→ Ag |
||
Hg2+/Hg |
Hg2+ + ē ←→ Hg |
||
Pd2+/Pd |
Pd2+ + ē ←→ Pd |
||
Pt2+/Pt |
Pt2+ + ē ←→ Pt |
||
O2/H2O |
O + 4H+ + ē → |
2H O |
|
2 |
← |
2 |
|
Cl2/Cl– |
½Cl2 + ē ←→ Cl– |
||
Au3+/Au |
Au3+ |
+ 3ē ←→ Au |
|
Е0, В –3,045 –2,925 –2,925 –2,923 –2,916 –2,906 –2,866 –2,714 –2,363 –1,847 –1,662 –1,628 –1,186 –1,180 –0,913 –0,763 –0,744 –0,440 –0,403 –0,277 –0,250 –0,136 –0,126 –0,036 +0,000 +0,010 +0,337 +0,401 +0,521 +0,799 +0,854 +0,987 +1,200 +1,229 +1,359 +1,498
Химия. Учеб. пособие |
-216- |
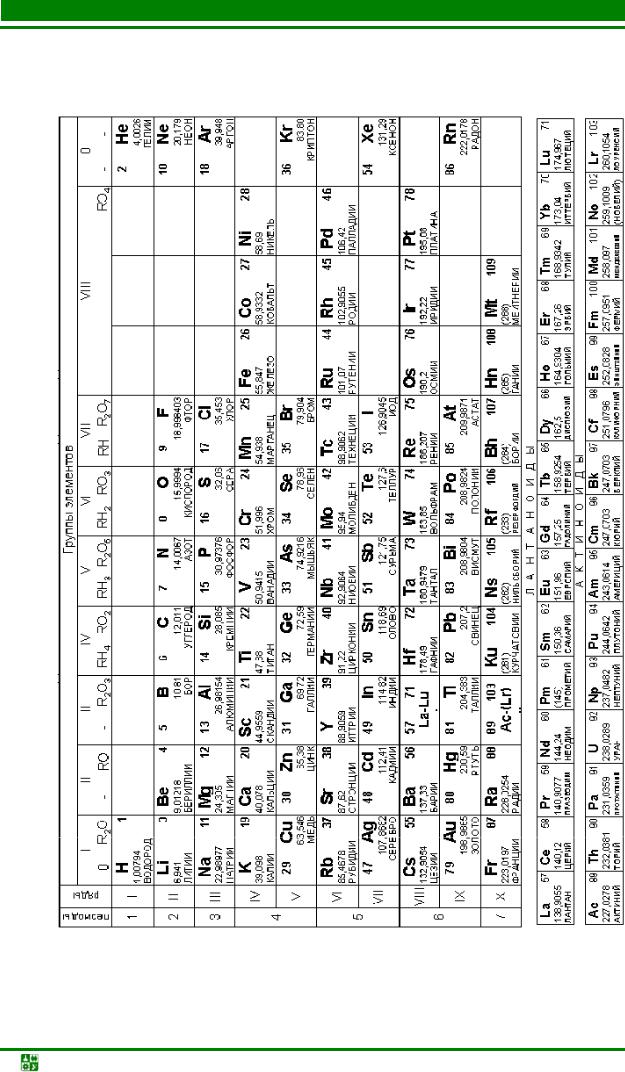
ПРИЛОЖЕНИЕ
Таблица 3
Периодическая система элементов Д. И. Менделеева
Химия. Учеб. пособие |
-217- |

ПРИЛОЖЕНИЕ
Таблица 4
Стандартные энтальпии, энтропии и энергии Гиббса образования некоторых веществ
Вещество |
Состояние |
Н°, |
S°, |
G°, |
|
кДж/моль |
Дж/(моль K) |
кДж/моль |
|||
|
|
||||
Al |
к |
0 |
29,42 |
0 |
|
Al2O3 |
к |
−1 676 |
50,92 |
−1 582 |
|
С |
Графит |
0 |
5,7 |
0 |
|
CO |
г |
–110,5 |
197,5 |
–137,1 |
|
CO2 |
г |
−385,2 |
214,62 |
−394,38 |
|
CaCO3 |
к |
−1 207,0 |
88,7 |
−1 127,7 |
|
CaCl2 |
к |
–785,8 |
113,8 |
–750,2 |
|
CaF2 |
к |
–2 114,6 |
68,9 |
–1 161,9 |
|
Ca3N2 |
к |
–431,8 |
105 |
–368,6 |
|
CaO |
к |
−635,5 |
39,7 |
−604,2 |
|
Сa(OH)2 |
к |
–986,6 |
76,1 |
–896,8 |
|
Cl2 |
г |
0 |
222,9 |
0 |
|
Cl2O |
г |
76,6 |
266,2 |
94,2 |
|
ClO2 |
г |
105,0 |
257,0 |
122,3 |
|
HCl |
р |
−91,8 |
186,8 |
−94,8 |
|
Cr2O3 |
к |
−1 440,6 |
81,2 |
−1 050,0 |
|
Cu |
к |
0 |
33,15 |
0 |
|
Cu2+ |
р |
+64,3 |
−996,5 |
+64,9 |
|
CuSO4 |
к |
−770,9 |
109,0 |
−661,8 |
|
CuSO4·5H2O |
к |
−2 275,4 |
300 |
−1 879,9 |
|
CuO |
к |
–162,0 |
42,6 |
–129,9 |
|
Cr2O3 |
к |
−1 140 |
81,2 |
−1 059,0 |
|
Fe |
к |
0 |
27,13 |
0 |
|
Fe2+ |
р |
−76,15 |
−50,2 |
−75,05 |
|
FeO |
к |
–264,8 |
60,8 |
–244,3 |
|
Fe2O3 |
к |
−822,2 |
87,4 |
−740,28 |
|
Fe3O4 |
к |
–1 117,1 |
146,2 |
–1 014,2 |
|
FeSO4 |
к |
−970,2 |
110,2 |
− 65,2 |
|
H2 |
г |
0 |
130,52 |
0 |
|
H+ |
р |
0 |
– |
0 |
|
OH– |
р |
−229,8 |
−2,52 |
−37,6 |
|
HBr |
г |
–36,3 |
198,6 |
–53,3 |
|
HCN |
г |
135,0 |
113,1 |
125,5 |
|
HF |
г |
–270,7 |
18,7 |
–272,8 |
|
HI |
г |
26,6 |
206,5 |
1,8 |
Химия. Учеб. пособие |
-218- |

ПРИЛОЖЕНИЕ
|
|
|
|
Продолжение табл. 4 |
|
|
|
|
|
|
|
Вещество |
Состояние |
Н°, |
S°, |
|
G°, |
кДж/моль |
Дж/(моль K) |
|
кДж/моль |
||
|
|
|
|||
H2O |
ж |
−285,8 |
70,8 |
|
−237,24 |
H2O |
г |
−241,8 |
188,72 |
|
−228,6 |
H2S |
г |
−21,0 |
205,7 |
|
−33,8 |
KClO3 |
к |
–391,2 |
143,0 |
|
–289,9 |
MgCl2 |
к |
–641,1 |
89,9 |
|
–591,6 |
Mg3N2 |
к |
–461,1 |
87,9 |
|
–400,9 |
MgO |
к |
–601,8 |
26,9 |
|
–569,6 |
N2 |
г |
0 |
199,9 |
|
0 |
NO2 |
г |
+33,92 |
240,22 |
|
+51,5 |
N2O4 |
г |
+9,46 |
305,5 |
|
+97,39 |
NO |
г |
90,3 |
210,6 |
|
86,6 |
N2O |
г |
82,0 |
219,9 |
|
104,1 |
N2O3 |
г |
83,3 |
307,0 |
|
140,5 |
N2O5 |
к |
–42,7 |
1,8 |
|
114,1 |
NH3 |
г |
–46,2 |
192,6 |
|
–16,7 |
NH4NO3 |
к |
–365,4 |
151 |
|
–183,8 |
NH4Cl |
к |
–315,39 |
94,56 |
|
–343,64 |
NaOH |
к |
–426,6 |
64,18 |
|
–377,0 |
NaCl |
к |
–410,9 |
72,36 |
|
–384,0 |
NiO2 |
к |
–239,7 |
38,0 |
|
–211,6 |
O2 |
г |
0 |
204,82 |
|
0 |
F2 |
г |
0 |
202,7 |
|
0 |
OF2 |
г |
5,1 |
247,0 |
|
42,5 |
P2O3 |
к |
–820,0 |
173,5 |
|
– |
P2O5 |
к |
–1 492,0 |
114,5 |
|
–1 348,8 |
PbO |
к |
–219,3 |
66,1 |
|
–189,1 |
PbO2 |
к |
–276,6 |
74,9 |
|
–218,3 |
S |
ромб. |
0 |
31,88 |
|
0 |
SO2 |
г |
–296,9 |
248,1 |
|
–300,2 |
SO3 |
г |
–395,8 |
256,7 |
|
–371,2 |
H2SO4 |
р |
−81,42 |
156,9 |
|
−690,3 |
SiO2 |
к |
–859,3 |
42,9 |
|
–803,75 |
SnO |
к |
–286,0 |
56,5 |
|
–256,9 |
SnO2 |
к |
–580,8 |
52,3 |
|
–5 19,3 |
Cr2O3 |
к |
−1140 |
81,2 |
|
−1 059,0 |
C2H6 |
г |
− 85,94 |
229,5 |
|
− 32,9 |
C2H5OH |
ж |
− 277,6 |
160,7 |
|
− 174,8 |
Химия. Учеб. пособие |
-219- |

ПРИЛОЖЕНИЕ
Таблица 5
Растворимость кислот, солей и оснований в воде
Катионы |
|
|
|
|
|
Анионы |
|
|
|
|
|
||
Cl– |
Br– |
J– |
NO3– |
CH3COO– |
S2– |
SO32– |
SO42– |
CO32– |
SiO32– |
PO43– |
OH– |
||
|
|||||||||||||
Li+ |
Р |
Р |
|
Р |
Р |
Р |
Р |
Р |
Р |
Н |
Н |
Р |
|
Na+ |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
K+ |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
NH4+ |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
– |
Р |
Р |
|
Cu2+ |
Р |
Р |
– |
Р |
Р |
Н |
Н |
Р |
– |
– |
Н |
Н |
|
Ag+ |
Н |
Н |
Н |
Р |
Р |
Н |
Н |
М |
Н |
– |
Н |
– |
|
Mg2+ |
Р |
Р |
Р |
Р |
Р |
– |
Н |
Р |
Н |
Н |
Н |
Н |
|
Са2+ |
Р |
Р |
Р |
Р |
Р |
Р |
Н |
М |
Н |
Н |
Н |
М |
|
Sr+ |
Р |
Р |
Р |
Р |
Р |
Р |
Н |
Н |
Н |
Н |
Н |
М |
|
Ba2+ |
Р |
Р |
Р |
Р |
Р |
Р |
Н |
Н |
Н |
Н |
Н |
Р |
|
Zn2+ |
Р |
Р |
Р |
Р |
Р |
Н |
Н |
Р |
Н |
Н |
Н |
Н |
|
Hg2+ |
Р |
М |
Н |
Р |
Р |
Н |
– |
Р |
– |
– |
Н |
– |
|
Al3+ |
Р |
Р |
Р |
Р |
Р |
– |
– |
Р |
– |
Н |
Н |
Н |
|
Sn2+ |
Р |
Р |
Р |
– |
– |
Н |
– |
Р |
– |
– |
Н |
Н |
|
Pb2+ |
М |
М |
Н |
Р |
Р |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
|
Bi3+ |
– |
– |
– |
Р |
– |
Н |
Н |
– |
Н |
– |
Н |
Н |
|
Cr3+ |
Р |
Р |
Р |
Р |
– |
– |
– |
Р |
– |
– |
Н |
Н |
|
Mn2+ |
Р |
Р |
Н |
– |
Р |
Н |
Н |
Р |
Н |
Н |
Н |
Н |
|
Fe3+ |
Р |
Р |
– |
Р |
– |
Н |
– |
Р |
– |
Н |
Н |
Н |
|
Fe2+ |
Р |
Р |
Р |
Р |
Р |
Н |
Н |
Р |
Н |
Н |
Н |
Н |
|
Примечание. Р – растворимое вещество; М – малорастворимое вещество; Н – практически нерастворимое вещество; прочерк означает, что вещество не существует или разлагается водой.
Химия. Учеб. пособие |
-220- |

ПРИЛОЖЕНИЕ
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 6 |
||
|
|
Константы нестойкости некоторых комплексных ионов |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Комплексо- |
|
Уравнение диссоциации комплексных ионов |
|
|
Кн |
|
||||||||
|
образователь |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[Ag(NH ) |
|
|
]+ |
→ Ag+ + 2NH |
|
|
–8 |
|
||||
|
|
3 2 |
|
← |
|
3 |
|
|
6,8 · 10 |
|
|||||
|
Ag+ |
|
[Ag(CN)2]– ←→ Ag+ + 2CN– |
|
1,0 |
· 10–21 |
|
||||||||
|
|
|
[Ag(S O ) |
]3– |
→Ag+ + 2S O |
2− |
|
1,0 |
–13 |
|
|||||
|
|
2 3 2 |
|
|
|
← |
2 |
3 |
|
|
· 10 |
|
|||
|
|
|
[Cd(NH ) |
|
]2+ →Cd2+ + 4NH |
|
|
–7 |
|
||||||
|
Cd2+ |
3 4 |
|
|
← |
|
3 |
|
|
1,0 · 10 |
|
||||
|
|
[Cd(CN)4]2– ←→ Cd2+ + 4CN– |
|
1,4 |
· 10–17 |
|
|||||||||
|
|
|
[Co(NH ) |
]2+ |
→ Co2+ |
+ 6NH |
|
|
–5 |
|
|||||
|
Co2+ |
3 6 |
|
|
|
|
← |
|
3 |
|
|
1,3 · 10 |
|
||
|
|
[Co(SCN)4]2– ←→ Co2+ + 4SCN– |
|
1,0 · 10–3 |
|
||||||||||
|
|
|
[Cu(NH ) |
]2+ |
→ Cu2+ |
+ 4NH |
|
2,0 |
–13 |
|
|||||
|
Cu2+ |
3 4 |
|
|
|
|
← |
|
3 |
|
|
· 10 |
|
||
|
|
[Cu(CN)4]2– ←→ Cu2+ + 4CN– |
|
5,0 |
· 10–28 |
|
|||||||||
|
Fe3+ |
|
[Fe(CN)6]3– ←→ Fe3+ + 6CN– |
|
1,0 |
· 10–44 |
|
||||||||
|
Fe2+ |
|
[Fe(CN)6]4– ←→ Fe2+ + 6CN– |
|
1,0 |
· 10–37 |
|
||||||||
|
|
|
[Hg(NH ) |
]2+ |
→ Hg2+ |
+ 4NH |
|
5,3 |
–20 |
|
|||||
|
|
3 4 |
|
|
|
|
← |
|
3 |
|
|
· 10 |
|
||
|
Hg2+ |
|
[Hg(Cl)4]2– ←→ Hg2+ + 4Cl– |
|
8,5 |
· 10–16 |
|
||||||||
|
|
|
[Hg(CN)4]2– ←→ Hg2+ + 4CN– |
|
4,0 |
· 10–42 |
|
||||||||
|
|
|
[Ni(NH ) ]2+ |
→ Ni2+ |
+ 4NH |
|
|
–8 |
|
||||||
|
Ni2+ |
3 4 |
|
|
|
|
← |
|
3 |
|
|
1,1 · 10 |
|
||
|
|
[Ni(CN)4]2– ←→ Ni2+ + 4CN– |
|
1,8 |
· 10–14 |
|
|||||||||
|
|
|
[Zn(NH ) ]2+ |
→ Zn2+ |
+ 4NH |
|
3,5 |
–10 |
|
||||||
|
|
3 4 |
|
|
|
|
← |
|
3 |
|
|
· 10 |
|
||
|
Zn2+ |
|
[Zn(OH)4]2– ←→ Zn2+ + 4OH– |
|
3,6 |
· 10–16 |
|
||||||||
|
|
|
[Zn(CN)4]2– ←→ Zn2+ + 4CN– |
|
1,3 |
· 10–17 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 7 |
||
|
Произведение растворимости труднорастворимых в воде соединений (при 298 К) |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Соединение |
|
ПР |
|
|
|
|
Соединение |
|
|
ПР |
|
|
||
|
AgCl |
|
1,6 · 10–10 |
|
|
|
|
|
SrSO4 |
|
|
3,2 · 10–7 |
|
||
|
AgBr |
|
4,4 · 10–13 |
|
|
|
|
|
PbCl2 |
|
|
2,1 · 10–5 |
|
||
|
AgI |
|
9,7 · 10–17 |
|
|
|
|
|
PbI2 |
|
|
|
9,8 · 10–9 |
|
|
|
Ag2SO4 |
|
7,7 · 10–5 |
|
|
|
|
|
PbSO4 |
|
|
1,6 · 10–8 |
|
||
|
Ag2S |
|
1,6 · 10–49 |
|
|
|
|
|
PbS |
|
|
3,6 · 10–29 |
|
||
|
BaCO3 |
|
8,1 · 10–9 |
|
|
|
|
|
ZnS |
|
|
7,4 · 10–27 |
|
||
|
BaSO4 |
|
1,1 · 10–10 |
|
|
|
|
|
HgS |
|
|
|
10–58 |
|
|
|
MgCO3 |
|
1,0 · 10–5 |
|
|
|
|
|
AgOH |
|
1,9 · 10–28 |
|
|||
|
CaCO3 |
|
4,8 · 10–9 |
|
|
|
|
Al(OH)3 |
|
5,1 · 10–33 |
|
||||
|
CaSO4 |
|
6,1 · 10–5 |
|
|
|
|
Cr(OH)3 |
|
6,7 · 10–31 |
|
||||
|
CaF2 |
|
4,0 · 10–11 |
|
|
|
|
Fe(OH)3 |
|
3,8 · 10–38 |
|
||||
|
CdS |
|
1,2 · 10–28 |
|
|
|
|
Mg(OH)2 |
|
5,5 · 10–12 |
|
||||
|
CuS |
|
4,0 · 10–38 |
|
|
|
|
Ni(OH)2 |
|
1,6 · 10–14 |
|
||||
|
Cu2S |
|
2,0 · 10–48 |
|
|
|
|
Cu(OH)2 |
|
5,0 · 10–19 |
|
||||
|
FeS |
|
3,7 · 10–19 |
|
|
|
|
Pb(OH)2 |
|
1,0 · 10–15 |
|
||||
|
MnS |
|
2,0 · 10–15 |
|
|
|
|
Zn(OH)2 |
|
1,3 · 10–17 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Химия. Учеб. пособие |
|
|
|
|
|
|
|
|
|
|
-221- |
|
||

ПРИЛОЖЕНИЕ
|
|
|
|
|
|
|
|
|
|
|
Таблица 8 |
||
|
|
Способы выражения концентраций растворов |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Количество, масса или объем в-ва |
|
|
Способ |
|
|||||
|
|
Обо- |
|
|
|
|
|
|
|
|
выражения |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Концентрация |
значе- |
|
раствори- |
|
раствора |
раствори- |
|
концентрации |
|
|||
|
|
ние |
|
мого |
|
теля |
|
|
или размер- |
|
|||
|
|
|
|
|
|
|
|
До 1 м3, 1 л |
|
|
ность |
|
|
|
Молярная |
СВ |
|
х, моль |
|
м3, л |
моль/м3, моль/л |
|
|||||
|
Молярная концен- |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
трация эквивален- |
Сэкв (В) |
х, моль-экв |
|
м3, л |
До 1 м3, 1 л |
|
|
моль экв/м , |
|
|||
|
тов (нормальная) |
|
|
|
|
|
|
|
|
|
моль экв/л |
|
|
|
|
|
|
|
|
|
1 кг |
|
|
|
|
|
|
|
Моляльность |
Сm (В) |
|
х, моль |
|
– |
|
|
моль/кг |
|
|||
|
Массовая |
ρ В |
|
х, кг |
|
м3, л |
До 1 м3; |
|
|
кг/м3, кг/л |
|
||
|
|
|
|
|
|
|
|
до 1 л |
|
|
|
|
|
|
Титр |
ТВ |
|
х, г |
|
мл, см3 |
До 1 мл |
|
|
г/мл, г/см3 |
|
||
|
Молярная доля |
хВ |
|
х, моль |
|
(х+у), моль |
у, моль |
|
|
х/(х+у) |
|
||
|
Массовая доля |
ω |
|
х, кг |
|
(х+у), кг |
у, кг |
|
|
х/(х+у) |
|
||
|
Объемная доля |
ϕ |
|
х, м3 |
|
(х+у), м3 |
у, м3 |
|
|
у/(х+у) |
|
||
|
|
|
|
|
|
|
|
|
|
|
Таблица 9 |
||
|
Константы диссоциации некоторых слабых электролитов |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||
|
Электролит |
|
Кд |
|
Электролит |
|
|
Кд |
|||||
|
Азотистая кислота HNO2 |
|
4·10–4 |
Сернистая кислота H2SO3, K1 |
|
1,6·10–2 |
|||||||
|
Бромноватистая кислота HOBr |
|
2,1·10–9 |
Сероводород H2S |
|
|
6·10–8 |
||||||
|
Гидроксид аммония NH4OH |
|
1,8·10–5 |
K1 |
|
|
|
|
|||||
|
Кремниевая кислота H2SiO3: |
|
2,2·10–10 |
K2 |
|
|
|
|
1·10–14 |
||||
|
K1 |
|
|
|
Угольная кислота H2CO3: |
|
|
|
|
||||
|
K2 |
|
|
|
1,6·10–12 |
K1 |
|
|
|
|
4,5·10–7 |
||
|
Муравьиная кислота НСООН |
|
1,8·10–4 |
K2 |
|
|
|
|
4,7·10–11 |
||||
|
Ортофосфорная кислота Н3РО4: |
|
7,5·10–3 |
Уксусная кислота СН3СООН |
|
1,8·10–5 |
|||||||
|
К1 |
|
|
|
Хлорноватистая кислота HOCl |
5,0·10–8 |
|||||||
|
К2 |
|
|
|
6,3·10–8 |
Фтороводород HF |
|
|
6,6·10–4 |
||||
|
К3 |
|
|
|
1,3·10–12 |
Циановодород HCN |
|
|
7,9·10–9 |
||||
|
Пероксид водорода Н2О2 |
|
2,6·10–12 |
Щавелевая кислота Н2С2О4: |
|
|
5,4·10–2 |
||||||
|
Серная кислота H2SO4, K2 |
|
–2 |
K1 |
|
|
|
|
|||||
|
|
1,2·10 |
|
K2 |
|
|
|
|
–5 |
||||
|
|
|
|
|
|
|
|
|
|
|
5,4·10 |
|
|
|
Вода Н2О |
|
|
|
1,8·10–16 |
Алюминия гидроксид К3 |
|
|
1,4·10–9 |
||||
|
Железа (II) гидроксид Fe(OH)2, K2 |
1,3·10–4 |
Меди (II) гидроксид Cu(OH)2 К2 |
3,4·10–7 |
|||||||||
|
Железа (III) гидроксид Fe(OH)3: |
1,8·10–11 |
Никеля гидроксид Ni(OH)2 K2 |
2,5·10–5 |
|||||||||
|
K2 |
|
|
|
Серебра гидроксид AgOH |
|
|
1,1·10–4 |
|||||
|
K3 |
|
|
|
1,4·10–12 |
Хрома (III) гидроксид Cr(OH)3, K3 |
1,0·10–10 |
||||||
|
Цинка гидроксид Zn(OH)2: |
|
4,4·10–5 |
Свинца гидроксид Pb(OH)2: |
|
|
9,6·10–4 |
||||||
|
K1 |
|
|
|
K1 |
|
|
|
|
||||
|
K2 |
|
|
|
1,5·10–9 |
K2 |
|
|
|
|
3,0·10–8 |
||
|
Кадмия гидроксид Cd(OH)2, K2 |
|
5,0·10–3 |
Марганца(II) гидроксидMn(OH)2, K2 |
5,0·10–4 |
||||||||
Химия. Учеб. пособие |
-222- |

ПРИЛОЖЕНИЕ
|
|
Деление катионов на аналитические группы при сероводородной классификации |
|
|
|
|
Таблица 10 |
|||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
Сульфиды, растворимые в воде |
Сульфиды, нерастворимые в воде |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сульфиды |
|
|
|
|
|
|
|
|
Характеристика |
|
Карбонаты, |
|
Карбонаты, |
(или гидроксиды), |
Сульфиды, |
|
|
Сульфиды, |
|
||||||||
группы |
|
|
образующиеся |
нерастворимые |
|
растворимые |
|
|||||||||||
растворимые |
|
нерастворимые |
|
|
||||||||||||||
|
|
действием (NH4)2S, |
в многосернистом |
в многосернистом |
|
|||||||||||||
|
|
в воде |
|
|
|
в воде |
|
|
||||||||||
|
|
|
|
|
|
растворимых |
аммонии |
|
|
аммонии |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
в кислотах |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Группа и наимено- |
|
1-я группа |
|
2-я группа |
3-я группа |
4-я группа |
|
|
5-я группа |
|
||||||||
|
|
Al3+, Cr3+, Fe3+, Fe2+, |
Ag+, Pb2+, Hg22+, |
|
|
|
||||||||||||
вание катионов |
+ |
+ |
+ |
, Mg |
2+ |
Ba |
2+ |
, Ca |
2+ |
As |
3+ |
, As |
5+ |
2+ |
4+ |
|
||
|
Na |
, K , NH4 |
|
|
|
|
Mn2+, Zn2+, Co2+, Ni2+ |
Cu2+, Bi3+ |
|
|
, Sn |
, Sn |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
HCl для осаждения |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
первой подгруппы |
|
|
|
|
|
|
|
Групповой реактив |
|
Не имеется |
|
(NH4)2CO3 |
(NH4)2S |
и H2S в солянокис- |
|
|
(NH4) 2S2 |
|
|
|||||||
|
|
в аммиачной среде |
лой среде для вто- |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
рой подгруппы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
и пятой группы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Осадок |
Осадок |
Раствор (фильтрат) |
|
|||||
Характер получае- |
|
|
|
|
|
Осадок |
Al(OH)3, Cr(OH)3, |
|
||||||||||
|
|
|
|
|
AgCl, PbCl2, Hg2Cl2, |
|
|
(NH4)2SnS3, |
|
|||||||||
мых соединений |
|
|
|
|
|
BaCO3, CaCO3 |
Fe2S3, FeS, MnS, ZnS |
|
|
|
||||||||
|
|
|
|
|
CuS, Bi2S3 |
|
|
(NH4)3AsS4 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
CoS, NiS |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Химия. Учеб. пособие |
-223- |

ПРИЛОЖЕНИЕ
Характеристика
группы
Группа и наименование катионов
Групповой
реактив
Характер
получаемых
соединений
Таблица 11
Деление катионов на аналитические группы при кислотно-щелочной классификации
Хлориды, |
|
|
|
|
Сульфаты, |
Амфотерные |
Гидроксиды, |
Гидроксиды, |
|||||||||
сульфаты, |
|
Хлориды, |
|
гидроксиды, |
|||||||||||||
|
|
нерастворимые |
нерастворимые |
растворимые |
|||||||||||||
гидроксиды, |
нерастворимые |
растворимые |
|||||||||||||||
в воде и кисло- |
в избытке |
в избытке |
|
|
|||||||||||||
растворимые |
|
в воде |
|
|
|
тах |
|
в избытке |
едкой щелочи |
аммиака |
|
|
|||||
|
в воде |
|
|
|
|
|
|
|
едкой щелочи |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
1-я группа |
|
2-я группа |
|
3-я группа |
4-я группа |
5-я группа |
6-я группа |
|
|||||||||
|
|
Al3+, Cr3+, Zn2+, |
Mg2+, Mn2+, Bi3+, |
|
|||||||||||||
+ |
+ |
+ |
+ |
2+ |
2+ |
Ba |
2+ |
, Cа |
2+ |
2+ |
2+ |
2+ |
|
2+ |
|||
K |
, Na , NH4 |
|
Ag |
, Pb , Hg2 |
|
|
|
, Pb |
Sn4+, Sn2+, As3+, As5+ |
Fe2+, Fe3+ |
Cu |
, Co , Ni |
|
||||
Не имеется |
|
Разбавленная |
Разбавленная |
Избыток едкой |
Избыток раствора аммиака |
|
|
||||||||||
|
|
HCl |
|
|
|
H2 SO4 |
щелочи |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
Фильтрат |
Осадок |
|
|
|
|
|
|
|
|
|
|
|
|
Осадок |
Mg(OH) 2 |
Фильтрат |
|
|
||||||
|
|
|
|
Осадок |
|
|
AlO2–, CrO2–, |
2+ |
|||||||||
|
|
|
AgCl, PbCl2, |
|
BaSO4, |
ZnO2–, SnO22–, |
Mn(OH) 2 |
[Cu(NH3) 4] |
2+ |
||||||||
|
|
|
|
Hg2 Cl2 |
|
|
CaSO4, |
SnO32–, SO33–, |
Bi(OH) 3 |
[Co(NH3) 6]2+ |
|||||||
|
|
|
|
|
|
|
|
PbSO4 |
AsO43– |
Fe(OH) 2 |
[Ni(NH3) 6] |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
Fe(OH) 3 |
|
|
|
|
|
Химия. Учеб. пособие |
-224- |
