
- •Оглавление
- •ВВЕДЕНИЕ
- •1. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
- •2. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
- •2.1. Модели строения атома
- •2.2. Двойственная природа электрона
- •2.3. Атомное ядро. Изотопы, изобары
- •2.4. Квантовые числа. Принцип Паули
- •2.5. Правило Гунда
- •2.7. Периодический закон Д. И. Менделеева
- •3.1. Параметры химической связи
- •3.2. Ковалентная связь
- •3.3. Ионная связь
- •3.4. Водородная связь
- •3.5. Металлическая связь
- •4. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •4.1. Строение комплексных соединений
- •4.3. Изомерия комплексных соединений
- •4.4. Диссоциация комплексных соединений. Константа нестойкости комплексного иона
- •5. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
- •5.1. Внутренняя энергия и энтальпия
- •5.2. Энтропия
- •5.3. Энергия Гиббса
- •6. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- •6.2. Понятие о катализе и катализаторах
- •6.3. Колебательные реакции
- •6.4. Химическое равновесие и его смещение
- •6.5. Фазовые равновесия
- •7. РАСТВОРЫ
- •7.1. Способы выражения концентрации растворов
- •7.2. Растворы неэлектролитов
- •7.3. Растворы электролитов
- •7.3.5. Закон разбавления Оствальда
- •7.4. Гидролиз солей
- •7.5. Жесткость воды и методы ее устранения
- •8. ДИСПЕРСНЫЕ СИСТЕМЫ
- •8.1. Классификация дисперсных систем
- •8.2. Получение дисперсных систем
- •8.3. Строение мицелл
- •8.4. Устойчивость дисперсных систем
- •9. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •9.1. Окислительно-восстановительные реакции
- •9.2. Измерение электродных потенциалов металлов
- •9.3. Гальванические элементы
- •9.4. Электролиз
- •10. КОРРОЗИЯ МЕТАЛЛОВ
- •10.1. Виды коррозии
- •10.1.1. Химическая коррозия
- •10.1.2. Электрохимическая коррозия
- •10.2. Защита металлов от коррозии
- •11. ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ
- •11.1. Классификация металлов
- •11.2. Физические свойства металлов
- •11.3. Химические свойства металлов
- •11.4. Способы получения металлов из руд
- •12. ПОЛИМЕРЫ И ОЛИГОМЕРЫ
- •12.1. Основные понятия
- •12.2. Классификация и номенклатура полимеров
- •12.3. Применение полимеров и олигомеров
- •13. ХИМИЧЕСКАЯ ИДЕНТИФИКАЦИЯ
- •13.1. Порядок выполнения анализа вещества
- •13.2. Качественный анализ
- •13.3. Физико-химические методы анализа
- •БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- •СЛОВАРЬ ОСНОВНЫХ ТЕРМИНОВ
- •ПРИЛОЖЕНИЕ

6. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
6.1. Скорость химической реакции и влияние на нее различных факторов
Р е ш е н и е. По правилу Вант-Гоффа
Vt 2 |
|
t 2 −t1 |
t |
t |
|
|
; 8 = 2 10 ; 2 3 |
= 2 10 ; ∆t = 30 °C. |
|||
= γ |
10 |
||||
V |
|||||
|
|
|
|
||
t1 |
|
|
|
|
|
Значительное изменение скорости реакции с изменением температуры объясняет теория активации. Согласно этой теории в химическое взаимо-
действие вступают только активные молекулы, обладающие повышенным уровнем энергиии, достаточной для осуществления данной реакции. Неактивные молекулы можно сделать активными, если сообщить им необходимую дополнительную энергию. Этот процесс называется активацией. Один из способов активации – увеличение температуры: при повышении температуры число активных молекул возрастает, благодаря чему резко увеличивается скорость реакции.
Энергия, которую надо сообщить молекулам реагирующих веществ, чтобы превратить их в активные, называется энергией активации. Ее определяют опытным путем, обозначают буквой Еа и обычно выражают в кДж/моль. Например, для соединения водорода и йода
H2 + J2 = 2HJ Еа = 167,4 кДж/моль,
а для реакции распада иодоводорода
2HJ = H2 + J2 Еа = 186,2 кДж/моль.
Энергия активации Еа зависит от природы реагирующих веществ и служит характеристикой каждой реакции. Скорость реакции непосредственно зависит от значения энергии активации: если она мала, то за определенное время протекания реакции энергетический барьер преодолеет большее количество частиц и скорость реакции будет высокой, но если энергия активации велика, то реакция идет медленно.
При взаимодействии ионов энергия активации очень мала и ионные реакции протекают с очень большой скоростью, практически мгновенно.
6.2. Понятие о катализе и катализаторах
Увеличить скорость реакции можно с помощью катализаторов. Применять катализаторы выгоднее, чем повышать температуру, тем более, что ее повышение далеко не всегда возможно.
Катализаторами называются вещества, изменяющие скорость химической реакции, но сохраняющие при этом свои свойства и состав. Сам катализатор в реакциях не расходуется и в конечные продукты не входит.
Одни катализаторы ускоряют реакцию – положительный катализ, или просто катализ, другие замедляют – отрицательный катализ. Примером положительного катализа может служить получение серной кислоты из оксида
Химия. Учеб. пособие |
-66- |

6.ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
6.2.Понятие о катализе и катализаторах
серы (IV) или окисление аммиака в азотную кислоту с помощью платинового катализатора.
Примером отрицательного катализа является замедление взаимодействия раствора сульфита натрия с кислородом воздуха в присутствии этилового спирта или уменьшение скорости разложения пероксида водорода в присутствии небольших количеств серной кислоты. Отрицательный катализ часто называют ингибированием, а отрицательные катализаторы, снижающие скорость реакции, – ингибиторами (механизм действия последних отличен от действия катализаторов).
Химические реакции, протекающие при участии катализаторов, называются каталитическими. Различают два вида катализа – гомогенный (однородный) и гетерогенный (неоднородный) катализ.
При гомогенном катализе реагирующие вещества и катализатор образуют однофазную систему – газовую или жидкую, между катализатором и реагирующими веществами отсутствует поверхность раздела. Например, каталитическое разложение пероксида водорода в присутствии раствора солей (жидкая фаза). Для гомогенного катализа установлено, что скорость химической реакции пропорциональна концентрации катализатора.
При гетерогенном катализе реагирующие вещества и катализатор образуют систему из разных фаз. В этом случае между катализатором и реагирующими веществами существует поверхность раздела. Обычно катализатор
– твердое вещество, а реагирующие вещества – газы или жидкость. Примером может служить окисление аммиака (газообразная фаза) в присутствии платины (твердая фаза). Все реакции при гетерогенном катализе протекают на поверхности катализатора. Поэтому активность твердого катализатора зависит и от свойств его поверхности (размера, химического состава, строения и состояния). На поверхности катализатора имеются активные центры, реагирующие вещества адсорбируются на них, происходит деформация молекул, ослабевают связи между атомами и молекулы становятся активными.
Механизм действия катализаторов обычно объясняют образованием промежуточных соединений с одним из реагирующих веществ. Рассмотрим схему действия катализатора на следующем примере:
1.Основной химический процесс:
А+ В = АВ; SO2 + ½O2 = SO3
2.Образование промежуточного соединения одного из исходных веществ с катализатором NO:
К+ В = КВ; NO + ½O2 = NO2
3.Взаимодействие промежуточного соединения со вторым исходным веществом и освобождение катализатора:
КВ + А = АВ + К; NO2 + SO2 = SO3 + NO (катализатор)
Химия. Учеб. пособие |
-67- |
6.ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
6.2.Понятие о катализе и катализаторах
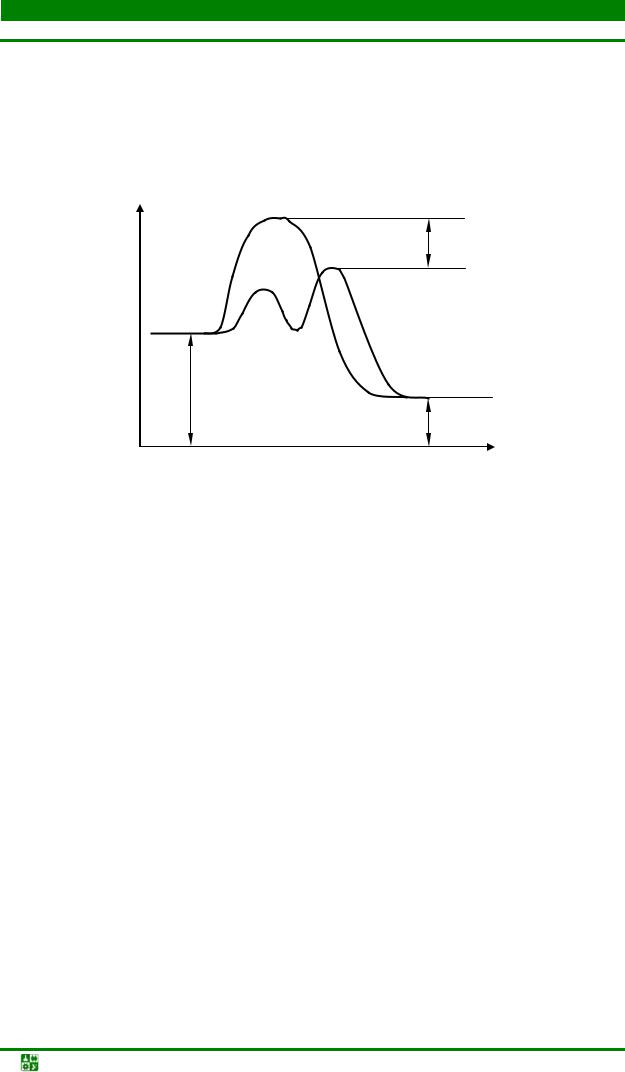
Катализатор разбивает ход химической реакции на несколько стадий. Соответственно, у каждой стадии имеется свой энергетический барьер. В сумме он составляет энергию активации Еа. За счет снижения энергетических барьеров по стадиям реакции протекают с большими скоростями (рис. 6.2).
А +КВ → [А…КВ]# (активированный комплекс) → АВ + К
G |
[A…B]# |
|
|
|
( G)# |
|
[B...AK] # |
|
[A…K]# |
A+B
A+B+K AK
AB
Gисходное
Gконечное
Рис. 6.2. Энергетическая схема хода реакции при отсутствии и в присутствии катализатора
Некоторые вещества снижают или полностью уничтожают активность твердого катализатора. Такие вещества называются каталитическими ядами. В качестве примера можно привести соединения мышьяка, ртути, свинца, цианистые соединения, к которым особенно чувствительны платиновые катализаторы.
Однако имеются и такие вещества, которые усиливают действие катализаторов, хотя сами катализаторами не являются. Эти вещества называются промоторами (промотирование платиновых катализаторов добавками железа, алюминия и др.).
Следует особо отметить, что действие катализаторов избирательно, поэтому из одного и того же вещества можно получить разные продукты.
Особую роль играют биологические катализаторы – ферменты. При их участии протекают сложные химические процессы в растительных и животных организмах.
6.3. Колебательные реакции
Существуют химические реакции, при протекании которых происходит периодическое изменение концентраций реагирующих веществ. Наибо-
лее известной колебательной реакцией является реакция Белоусова – Жаботинского, впервые исследованная в 60-х гг. ХХ в. Эта реакция представляет
Химия. Учеб. пособие |
-68- |

6.ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
6.3.Колебательные реакции
собой каталитическое окисление малоновой кислоты CH2(COOH)2 броматионом BrO 3− в присутствии иона германия Ge4+ в кислом водном растворе.
Колебания концентраций заметны по периодическому исчезновению и появлению желтой окраски, вызванной ионами Ge4+. Также периодически изменяются температура и концентрации других продуктов, являющихся интермедиатами (Br–, Br2). Для объяснения колебательных изменений предложен механизм, включающий следующие стадии:
1.BrO3− + Br– + 2H+ → HBrO2 + HBrO
2.HBrO2 + Br– + H+ → 2HBrO
3.BrO3− + HBrO2 + 2Ge3+ + 3H+ → 2HBrO2 + 2Ge4+ + H2O
4.2HBrO2 → BrO3− + HBrO + H+
5.nGe4+ + BrCH(COOH)2 → nGe3+ + продукты окисления.
Броммалоновая кислота образуется в результате реакции
CH2(COOH)2 + HBrO → BrCH(COOH)2 + H2O
Общее уравнение имеет вид
2 BrO3− + 3CH2(COOH)2 + 2H+ → 2BrCH(COOH)2 + 3CO2 + 4H2O
Это наиболее упрощенный вариант механизма. Более поздние модели включают 22-стадийные химические процессы в растительных и животных организмах.
6.4. Химическое равновесие и его смещение
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
В уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака:
3H2 (г) + N2 (г) →← 2NH3 (г) ∆H = −46,2 кДж/моль.
В технике обратимые реакции, как правило, невыгодны. Поэтому различными методами (изменением температуры, давления и др.) их делают практически необратимыми.
Реакции, которые протекают только в одном направлении и завершаются полным превращением реагирующих веществ в конечные вещества, на-
зываются необратимыми.
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
Химия. Учеб. пособие |
-69- |

6.ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
6.4.Химическое равновесие и его смещение
2KClO3 → 2KCl + 3O2 ↑
Необратимых реакций не так много. Большинство реакций являются обратимыми.
Необратимыми называют такие реакции, при протекании которых:
1. Образующиеся продукты уходят из сферы реакции – выпадают в виде осадков или выделяются в виде газа, например:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Na2CO3 + 2HCl→ 2 NaCl + CO2↑ + H2O
2. Образуется малодиссоциирующее соединение, например, вода:
HCl + NaOH → H2O + NaCl
3. Реакция сопровождается большим выделением энергии, например, горение магния:
2Mg + O2↑ → 2MgO, ∆H = − 602,5 кДж.
4.Образуется комплексное соединение.
Вуравнениях необратимых реакций между правой и левой частями ставится знак равенства или одна стрелка.
Под химическим равновесием понимается такое состояние обратимой реакции, когда скорости прямой и обратной реакции равны.
Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия, например:
H2 (г) + J2 (г) →← 2HJ (г)
В состояния равновесия прямая и обратная реакции не прекращаются. Поэтому такое равновесие называется подвижным или динамическим.
Используя закон действия масс, напишем выражение для скоростей прямой и обратной реакций:
|
→ |
→ |
] [J2 |
|
← |
← |
|
|
|
||
|
V = k[H2 |
]; V = k[HJ]2 , |
|
||||||||
|
|
|
→ |
← |
|
|
|
|
|
|
|
если в состоянии равновесия V = V , то |
|
|
|
|
|
||||||
|
|
← |
|
|
|
← |
[HJ]2 , |
|
|||
|
|
k =[Н2 ] [J2 |
]= k |
|
|||||||
или |
|
|
|
|
|
|
|
|
|
||
|
→ |
[HJ]2 |
|
|
|
|
[HJ]2 |
|
|
||
|
k |
= |
, |
Kp = |
. |
||||||
|
← |
[H2 ] [J2 ] |
[H2 ] [J2 ] |
||||||||
|
k |
|
|
|
|
||||||
Химия. Учеб. пособие |
-70- |

6.ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
6.4.Химическое равновесие и его смещение
→ ←
Отношение К/ К называется константой химического равновесия (обозначается Кр), которая постоянна при данной температуре, зависит от температуры и природы реагирующих веществ и не зависит от концентрации.
Химическое равновесие наступает при постоянстве внешних условий (давлении, концентрации, температуре). Изменение этих условий нарушает равновесие и вызывает увеличение скорости прямой или обратной реакции. Через некоторое время снова наступает равновесие. Переход реакционной системы от одного состояния равновесия к другому называется смещением (или сдвигом) химического равновесия.
Направление смещения химического равновесия при изменении концентрации реагирующих веществ, температуры и давления (в случаях газовых реакций) определяется общим положением, известным под названием принципа подвижного равновесия или принципа Ле Шателье: если на сис-
тему, находящуюся в равновесии, оказать какое-либо внешнее воздействие (изменить концентрацию, температуру, давление), то равновесие сместится в том направлении, где оказанное воздействие уменьшится.
Поясним это на примере следующей реакции:
→ |
2NH3 (г) |
∆H = −92,4 кДж. |
3Н2 (г) + N2 (г) ← |
||
3 объема 1 объем |
2 объема |
|
Влияние концентрации на смещение равновесия. Если внешнее воздей-
ствие выражается в увеличении концентрации азота или водорода (исходных веществ), равновесие смещается к аммиаку, т. е. в сторону прямой реакции, протекающей с получением продуктов реакции. Соответственно, увеличение концентрации аммиака смещает равновесие в сторону исходных веществ.
Влияние температуры на смещение равновесия. При повышении тем-
пературы равновесие смещается в сторону эндотермической реакции, протекающей с поглощением тепла, а при понижении температуры – в сторону экзотермической реакции, идущей с выделением тепла. В данном случае повышение температуры смещает равновесие в сторону обратной реакции, т. к. эта реакция идет с выделением тепла ( Н < 0).
Влияние давления на смещение равновесия. Чтобы определить влияние давления на смещение равновесия, необходимо подсчитать число молей газообразных веществ в правой и левой частях уравнения. В приведенном примере в левой части уравнения содержится четыре моля газов, а в правой – один. Если понижать давление, то равновесие сместится в сторону возрастания числа молей газа (4 объема), т. е. в обратном направлении. Если увеличить давление, то равновесие сместится в сторону меньшего объема (2 моль вещества), т. е. в прямом направлении.
Если же в уравнении обратимой реакции число молей газов в левой части равно числу молей в правой части, например,
N2 (г) + O2 (г) →← 2NO (г)
то изменение давления не вызывает смещения химического равновесия.
Химия. Учеб. пособие |
-71- |
