
- •Государственное бюджетное образовательное учреждение высшего профессионального образования
- •Практическое занятие № 1
- •Практическое занятие № 2
- •Учебная карта Вопросы для подготовки к занятию
- •Практическая часть занятия Высаливание белков сыворотки
- •Тепловая денатурация белков
- •Домашнее задание
- •Практическое занятие №3 Лабораторный практикум
- •Учебная карта занятия Вопросы для подготовки к занятию
- •Практическая часть Специфичность действия ферментов
- •Влияние температуры на активность фермента
- •Влияние активаторов и ингибиторов на активность ферментов
- •Практическое занятие №4
- •Учебная карта занятия Вопросы для подготовки к занятию
- •Практическая часть занятия
- •Практическое занятие № 5
- •Практическое занятие №6 Коллоквиум
- •Учебная карта занятия Вопросы для самоподготовки
- •Практическое занятие № 7
- •Учебная карта занятия вопросы для подготовки студентов к занятию
- •Практическая часть
- •Домашнее задание
- •Практическое занятие 8
- •Учебная карта вопросы для подготовки к занятию
- •Задания для контроля исходных и текущих знаний студентов
- •Практическое занятие 9
- •Учебная карта занятия вопросы для подготовки к занятию:
- •Домашнее задание
- •Практическое занятие 10
- •Учебная карта занятия вопросы для подготовки к занятию:
- •Домашнее задание
- •Практическое занятие № 11
- •Учебная карта занятия вопросы для подготовки к занятию:
- •Практическая часть Семинар
- •Практическое занятие № 12 (семинар)
- •Учебная карта занятия вопросы для подготовки к занятию:
- •Практическое занятие № 13
- •Учебная карта занятия вопросы для подготовки к занятию
- •Практическая работа Определение содержания мочевой кислоты в сыворотке крови и моче по методу Мюллера-Зейферта
- •1.1. Первичная гиперурикемия
- •Синдром Леша-Нихена (ювенильная гиперурикемия)
- •Подагра
- •Вторичная гиперурикемии
- •2.Гипоурикемия
- •3. Нарушение обмена пиримидиновых нуклеотидов
- •Нарушение катаболизма пиримидинов Наследственная оротовая ацидурия
- •Практическое занятие № 14
- •Учебная карта занятия Вопросы для подготовки к занятию
- •Практическое занятие № 15
- •Учебная карта занятия вопросы для подготовки к занятию:
- •Практическая часть занятия
- •Практическое занятие № 16
- •Учебная карта занятия вопросы для подготовки к занятию:
- •Практическая часть Определение активности алт и аст
- •Источники и пути обезвреживания аммиака в разных тканях
- •Практическое занятие № 17
- •Учебная карта занятия вопросы для подготовки к занятию:
- •Практическое занятие № 18
- •Учебная карта занятия вопросы для подготовки к занятию: Содержание темы
Практическое занятие № 11
(семинар)
ТЕМА: Свободно-радикальное и микросомальное окисление
ЦЕЛИ ЗАНЯТИЯ: изучить процессы неполного восстановления кислорода и микросомального окисления
Базисные знания
- из курса биоорганической химии студент должен знать, что такое неспаренный электрон, свободно-радикальная частица , понятие об окислительно-восстановительных и свободно-радикальных реакциях, понятие о редокс – потенциалах и редокс – системах, понятие о ПОЛ и механизмах антирадикальной защиты.
Учебная карта занятия вопросы для подготовки к занятию:
1. Полное и неполное восстановление кислорода. Его токсичность и реакционноспособность.
2. Пути образования кислородсодержащих свободных радикалов:
- ферментативные
- неферментативные.
3. Перекисное окисление. Образовани активных форм кислорода. Инициация свободнорадикальных процессов. Переокисление липидов клеточных мембран. Значение ПОЛ: физиологическое (обновление фосфолипидного бислоя мембран), патологическое (мембраноповреждающие эффекты).
4. Механизмы защиты от действия свободных радикалов:
роль ферментов ( каталаза, супероксиддисмутаза, глутатионпероксидаза, глутатионредуктаза) и естественных антиоксидантов (витамины А, Е, С).
5. Микросомальное окисление. Отличие от митохондриального окисления. Схема микросомального окисления.
6 Роль цитохрома Р-450 в микросомальном окислении.
7. Роль микросомального окисления в обезвреживании и метаболизме ксенобиотиков.
Практическая часть Семинар
ПРИЛОЖЕНИЕ
МЕХАНИЗМЫ КЛЕТОЧНОЙ АНТИРАДИКАЛЬНОЙ ЗАЩИТЫ
Свободные активные радикалы в норме в клетке образуются постоянно. Так, в процессе метаболизма веществ в гладком эндоплазматическом ретикулуме флавопротеины, а в митохондриях окислительные энзимы цепи дыхательных ферментов, постоянно продуцируют некоторое количество супероксиданиона (02-*) и перекиси водорода (Н202). Однако содержание в клетке этих и других радикалов жестко контролируются широким спектром биохимических инструментов антирадикальной защиты, включая супероксиддисмутазу, каталазу, G-SH-пероксидазу, GSSG-редуктазу, -каротин, аскорбиновую кислоту, восстановленный глутатион, мочевую кислоту. Отдельные элементы системы защиты действуют комплексно и потенцируют эффект друг друга. Они локализуются либо в гидрофобных, либо гидрофильных компартментах клеток (например, токоферол - липофилен, глутатион - гидрофилен).
Механизмы антирадикальной защиты включают как ферментативные, так и неферментативные процессы. Самым простьм примером некаталитического разрушения радикалов является их гидролиз, лежащий в основе нейтрализации многих водорастворимых продуктов, например, ацилгалидов, эпоксидов, карбокатионов, изоцианатов, эписульфониум-иона и т.д. Наиболее важной неферментативной реакцией "обезвреживания" радикалов является их взаимодействие с биологическими антиоксидантами, такими как витамин Е, глутатион, витамин С. В результате такого взаимодействия образуются нереакционноспособные вещества, прерывание каскад "наработки" свободных радикалов.
Гомеостаз в клетке поддерживается за счет равенства скоростей образования и связывания радикалов. В случае повреждения механизмов защиты клеток, либо активации процессов образования радикалов, превосходящих по интенсивности возможности защиты, или даже разрушающих эти механизмы, развивается поражение клетки. Так, интоксикация преимущественным пульмонотоксикантом паракватом приводит к некоторому снижению содержания глутатиона в печени. Предварительное связывание глутатиона диэтилмалеатом приводит к тому, что паракват приобретает свойства преимущественного гепатотоксиканта. Таким образом, резерв глутатиона в клетке имеет особое значение для обеспечения её антиоксидантной защиты.
Хотя глутатион может взаимодействовать с многочисленньми субстратами и неферментативно, наличие в тканях энзима глутатион-S-трансферазы (GST) значительно ускоряет течение процесса, повышает его эффективность. Множественность форм GST, их широкая субстратная специфичность, высокий уровень активности в различных тканях делают систему глутатионтрансфераз наиболее универсальной и значимой для связывания активных метаболитов.
Глутатион и селен-зависимые глутатионпероксидазы восстанавливают перекись водорода и другие гидроперекиси до менее токсичных алкоголей и воды. Глутатион-дисульфид, образующийся в ходе этой реакции, подвергается обратному восстановлению до глутатиона с помощью НАДФН-зависимой глутатионредуктазы. Активность глутатионредуктазы ингибируют изоцианат-содержащие продукты метаболизма нитрозомочевины.
Два других энзима, имеющих большое значение для детоксикации свободных радикалов, это супероксиддисмутаза (СОД) и каталаза. Первый из энзимов катализирует преобразование двух супероксидных радикалов в молекулу кислорода и перекись водорода. Обнаруживаемая во всех тканях СОД содержит в структуре активного центра ионы Си, Zn, Мп. Образующаяся перекись водорода разрушается с помощью каталазы или глутатионпероксидазного цикла.
Домашнее задание
В чем состоит токсичность кислорода? Ответ : токсичность кислорода состоит в том, что он может не полностью восстанавливаться, образуя активные формы кислорода.
Покажите в виде схем образование активных форм кислорода.
Напишите схемы обезвреживания супероксидиона, пероксида. Укажите ферменты, кофакторы (если имеются), продукты реакций
Какова биологическая роль мультиферментной системы цитохрома Р450? Ответ: Цитохром Р450 представляет собой очень гидрофобный белок, локализованный внутри мембраны. Простетическая группа по типу гема протопорфирина IX содержит ион Fe3+ , играющего роль комплексообразователя. Простетическая группа помещается в гидрофобной полости, активном центре цитохрома Р450. Электронное поле Fe3+ в поле лигандов сильно искажено, что регистрируется необычным для него спектром поглощения в области 450 нм. Чем больше цитохрома Р450 содержится в мембране, тем в лучшем состоянии она находится. «Стареющие» мембраны содержат цитохром Р420 (неактивная форма).
4.
Назовите основные молекулярные механизмы
обезвреживания ксенобиотиков.
Микросомальная
система окисления представляет собой
полиферментный комплекс зависимых
от НАДФН·Н+
и НАДН·Н+
цепей переноса электронов. Общим звеном
этих цепей является цитохром Р450.
В состав этого комплекса входят: цитохром
b5,
НАДФН-цитохром Р450-редуктаза
и НАДН-цитохром b5
-редуктаза.![]()
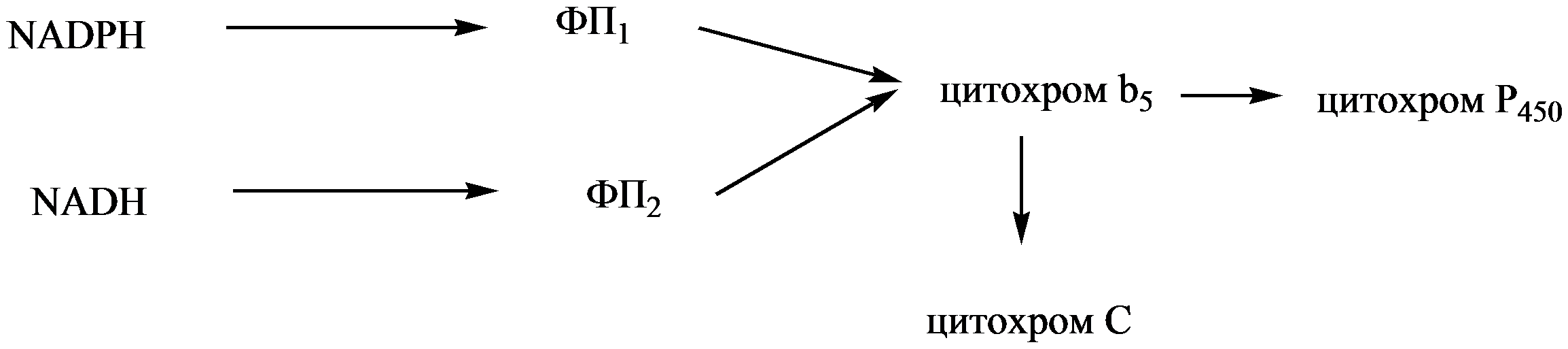
НАДФН·Н+ и НАДН·Н+ являются донорами электронов для процессов гидроксилирования, осуществляемых цитохромами b5 и Р450. ФП1 и ФП2 являются переносчиками электронов, флавопротеинами. ФП1 представляет собой НАДФН-цитохром Р450-редуктазу, а ФП2 является НАДН-цитохром b5-редуктазой. С ФП1 и ФП2 возможен перенос электронов на цитохром С — основной компонент дыхательной цепи митохондрий. В результате осуществляется межмембранный перенос электронов. Несомненно, наиболее важной реакцией микросомального окисления является гидроксилирование, сущность которого заключается во внедрении одного атома активированного кислорода в окисляемое вещество, в то время как другой его атом идет на образование воды, т.е. гидроксилирование протекает по монооксигеназному типу.
Превращение атомов кислорода в молекулу воды и гидроксильную группу окисляемого субстрата осуществляет цитохром Р450. Таким образом, в печени и ряде других органов при функционировании микросомальных монооксигеназ из гидрофобных ксенобиотиков образуются полярные соединения, имеющие реактивные группы. Эти соединения могут быть как менее, так и более токсичными, нежели исходные соединения, но они благодаря приобретенным реактивным группам легко вступают в реакции конъюгации с образованием нетоксичных (не всегда) продуктов, легко выводимых из организма с мочой, желчью и калом.
ВТОРАЯ ФАЗА МЕТАБОЛИЗМА КСЕНОБИОТИКОВ
Основные функции этой фазы те же, что и первой: увеличение гидрофильности и снижение токсичности ксенобиотиков. Наиболее важные ферменты второй фазы относятся к классу трансфераз.
Наиболее широка и многообразна активность семейства глутатионтрансфераз, метаболизируюших тысячи ксенобиотиков. Большинство этих ферментов находится в цитоплазме, но некоторые из них локализованы в мембранах ЭПС и митохондрий. Основная реакция - конъюгация
5.Сформулируйте значение монооксигеназных реакций цитохрома Р450 в метаболизме липофильных ксенобиотиков.
Изобразите в виде схемы последовательность реакций одноэлектронного восстановления кислорода и гидроксилирования субстрата в монооксигеназной реакции.
Ответ Существует несколько схем действия микросомальных монооксигеназ. Наиболее распространенной является схема обезвреживания, представленная на рисунке. Она хорошо раскрывает механизм биотрансформации химических веществ при участии цитохромов и флавопротеидов, иcпользуя в качестве доноров электронов НАДФН·Н+ и НАДН·Н+.
Основные ферменты, участвующие в метаболизме ксенобиотиков и локализованные в эндоплазматическом ретикулуме, представлены ниже на рисунке 1
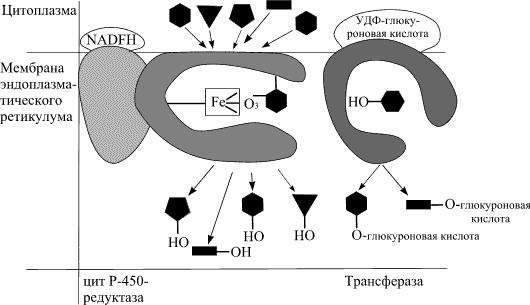
Ферменты, участвующие в метаболизме ксенобиотиков.
(Различные соединения конкурируют за места связывания с цитохромом Р450)
Установленные закономерности функционирования микросомальных монооксигеназ получены преимущественно при исследовании печеночной ткани.
Катализируемые цитохромом Р450 реакции обычно можно описать уравнением:
RH +О2 + NADPH + Н+ R-OH + H20 + NADP+
Цитохром Р450 называют также оксигеназой смешанного действия, поскольку он не только гидроксилирует субстрат, но и восстанавливает O2 до Н20. Последовательность реакций биотрансформации липофильного ксенобиотика цитохромом Р450 представлена на схеме 1.
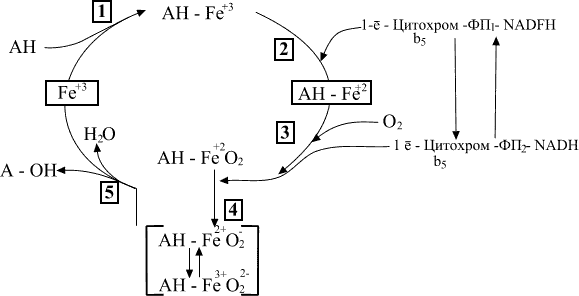
. Общая схема биотрансформации химических веществ микросомальными монооксигеназами печени
Вещество, подвергающееся биотрансформации (АН), на I стадии взаимодействует с окисленной формой цитохрома Р450 (Fe3+) с образованием фермент-субстратного комплекса (AH-Fe3+). На II стадии фермент-субстратный комплекс восстанавливается (AH-Fe2+) электроном, поступающим из НАДФ-Н-зависимой цепи переноса от НАДФ-Н посредством НАДФ-Н-цитохром Р450-редуктазы при возможном участии цитохрома b5. III стадия характеризуется взаимодействием восстановленного фермент-субстратного комплекса с кислородом (АН-Fе2+-О2) Присоединение кислорода осуществляется с большой скоростью. На IV стадии тройной комплекс фермент-субстрат-кислород (AH-Fe2+O2-) восстанавливается вторым электроном, который, по-видимому, поступает из НАД-Н-специфической цепи переноса, включающей НАДН-цитохром b5 редуктазу, НАДН и, возможно, цитохром b5. V стадия характеризуется внутримолекулярными превращениями восстановленного тройного комплекса — фермент-субстрат-кислород (AH-Fe2+022- AH-Fe3+-022-) и его распадом с освобождением воды и гидроксилированного субстрата. При этом цитохром Р450 переходит в исходную форму, готовую к взаимодействию со следующей молекулой субстрата. Лимитирующей стадией этого процесса является превращение тройного комплекса после его восстановления вторым электроном.
Первый электрон, поступающий из НАДФН-зависимой цепи, участвует в восстановлении Fe3+ (вторая стадия). Второй электрон поступает из НАДН·Н+-зависимой цепи и расходуется на образование активированного комплекса в четвертой стадии процесса гидроксилирования.
5. Сформулируйте, в чем заключается роль глутатиона в метаболизме ксенобиотиков. Ответ Наиболее широка и многообразна активность семейства глутатионтрансфераз, метаболизируюших тысячи ксенобиотиков. Большинство этих ферментов находится в цитоплазме, но некоторые из них локализованы в мембранах ЭПС и митохондрий. Основная реакция - конъюгация с восстановленным глутатионом – γ-глутамилцистеинил-глицином (G-SH) - протекает в двух вариантах: 1) присоединение к субстрату (алкены и эпоксиды) полной молекулы G-SH, 2) нуклеофильное замещение по электрофильным атомам углерода (галоген- и нитроалканы), азота (тринитроглицерин), серы (тиоцианаты и дисульфиды) или фосфора (метилпаратион).
При дальнейшем метаболизме глутатионовые конъюгаты переходят в меркаптуровые кислоты или меркаптаны. Кроме того, глутатионтрансферазы восстанавливают органические гидроперекиси в спирты и изомеризуют некоторые стероиды и простагландины.
6. В чем проявляется взаимосвязь биотрансформации ксенобиотиков и активации свободно-радикальных процессов? Ответ: В зависимости от условий реакции цитохром Р450 может функционировать в микросомах как одно- , двух- и четырёхэлектронная оксидаза, прямо генерируя О2ׁˉ, Н2О2 и Н2О в активном центре фермента. Активные формы кислорода могут образовываться в результате разобщения микросомальных моноокисгеназных реакций. При этом часть активных молекул кислорода не вступают в реакцию с субстратом, а высвобождаются из восстановленных комплексов цитохрома Р450.
Существование в клетке оксидазных и оксигеназных систем, генерирующих активные формы кислорода позволило предположить, что кислородные радикалы играют регулирующую роль в распаде белка. В связи с этим, цитохром Р450-зависимая монооксигеназная система также может быть вовлечена в окислительную инактивацию внутриклеточных ферментов. В тоже время цитохром Р450, генерируя активные формы кислорода в каталитическом цикле, может действовать и как «фермент-самоубийца». Важно отметить, что ранее существующее мнение о неспецифичности окислительной модификации ферментных белков в процессе катализа в настоящее время подвергнуто сомнению. Так в работах А.И. Арчакова с соавт. (1995) показано, что инактивация цитохрома Р450 носит селективный характер. Модифицируется лишь тот фермент, на котором образуются активные формы кислорода. Механизм разрушения цитохрома Р450 перекисью водорода, по-видимому, включает образование гидроксильных радикалов в реакции Фентона, которые могут окислять гем и модифицировать некоторые аминокислоты вблизи каталитического центра, что позволяет эндогенным протеазам узнать модифицированный фермент и подвергнуть его гидролитическому расщеплению. В этом случае распад белка носит не случайный характер, а направлен на удаление каталитически модифицированных молекул. В отличие от неспецифической модификации белка, наблюдаемой в системах, генерирующих активные формы кислорода, окислительная самоинактивация цитохрома Р450 в гидроксилазных реакциях может специфически регулировать распад только работающего фермента. Возможно, что модифицированные ферменты разрушаются как посредством прямой фрагментации под действием кислородных радикалов, так и вследствие протеолиза. В то же время, генерируя активные формы кислорода, цитохром Р450 – монооксигеназная система может участвовать в окислительной инактивации других внутриклеточных ферментов, регулируя тем самым их распад в клетке. Необходимо отметить, что эта реакция очень сходна с реакцией модификации макромолекул в NADРH – оксидазной системе фагоцитов в процессе их микробицидного действия. Причём во всех типах реакций каталитически образующаяся перекись водорода играет ведущую роль.
Таким образом, возможность самоинактивации определённых форм цитохрома Р450 со всеми вытекающими последствиями необходимо учитывать при рассмотрении таких ситуаций, когда в организм человека поступают извне чужеродные соединения, в том числе лекарственные вещества, в повышенных количествах.
Практические навыки, которыми должен овладеть студент : уметь сформулировать принципиальное различие между митохондриальным и микросомальным окислением, знать механизмы антирадикальной защиты организма
