
С.А. Мазунин, Г.С. Посягин ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА Часть 2. 1999г
..pdf81
того, еще одну соль, имеющую один общий ион с одной из солей данной пары, которые в общем виде записываются следующим образом: A+, B+, C+// X-,Y- - H2O.
Пусть, например, дана взаимная пара солей АХ и ВY, между которыми
может происходить реакция |
|
AX + BY = AY + BX, |
(8. 1) |
и пусть в системе имеется еще |
вода и соль СХ. Благодаря присутствию этой соли |
в нашей системе возможны еще реакции обмена, выражающиеся уравнениями:
BY + CX = BX + CY, |
(8. |
2) |
AY + CX = AX + CY. |
(8. |
3) |
Но одно из уравнений является следствием двух других: например, уравнение (8.3) можно получить из (8.1) и (8.2), если у уравнения (8.1) перенести левую часть направо, а правую налево и сложить его с уравнением (8.2).
Таким образом, в этой системе мы имеем 7 веществ (соли AX, BY, AY, BX, CX, CY и вода), между которыми возможны две независимые реакции, т. е. здесь мы имеем пять компонентов, и система является пятерной взаимной системой с растворителем. В отсутствии воды эта система будет четверной; мы будем назы-
вать такие системы четверными взаимными системами плавкости и обозначать ее так: А+, В+, С+ //X-, Y-.
В пятерной взаимной системе (при участии растворителя) таким же символом будем обозначать состав солевой массы. Конечно, совершенно аналогичной будет и система А+, В+ // X-, Y-, Z- - H2O, в построении которой участвуют два катиона и три аниона.
Опишем прежде всего способ изображения, дающий возможность построить диаграмму состава четверной взаимной системы без растворителя или состав солевой массы пятерной взаимной системы с растворителем. Пусть дана система А+, В+, С+ //X-, Y-. Концентрации ионов выразим таким образом, чтобы сумма всех ионэквивалентов была равна некоторой постоянной величине, например 200; при этом, конечно, сумма эквивалентов катионов равна сумме эквивалентов анионов. Таким образом, если мы обозначим малыми буквами выраженные вышеуказанным способом концентрации ионов, то будем иметь:
a + b + c + x + y = 200, a + b + c = x + y = 100.
Возьмем теперь треугольную призму с равносторонним треугольником в основании и с квадратами в качестве боковых граней (рис. 8. 2); у такой призмы все ребра равны. Принимаем ребро, равным 100, и в обоих основаниях отложим концентрации катионов так же, как и при построении диаграммы тройной системы по способу Розебома откладывают в треугольнике концентрации компонентов; при этом получим две точки М1 и М2, которые соединяем прямой М1М2. Полученный отрезок М1М2, параллельный боковому ребру призмы и равный 100, делим точкой М так, чтобы получить отрезки М1М = y и М2М = x. Тогда точка М и будет искомой фигуративной точкой данного состава.
Наоборот, если в указанной диаграмме дана фигуративная точка М и следует определить соответствующий состав, то через нее проводят прямую М1М2,

82
параллельную боковым ребрам призмы , и отмечают М1 и М2 - точки пересечения ее с основаниями призмы. После этих построений можно непосредственно определить состав так: отрезок М1М дает концентрацию аниона Y-, а отрезок ММ2 - аниона Х-; концентрации же катионов определяются точкой М1 в основании призмы так, как определяются концентрации компонентов в тройной системе, изображенной по способу Розебома. Только что описанный метод изображения принадлежит Енеке.
AY |
CY |
 M2
M2
BY
 M
M
AX 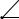











 CX
CX
 M1
M1
BX |
Рис. 8. 2. Построение фигуративной точки состава в системе А+, В+, С+ //X-, Y-
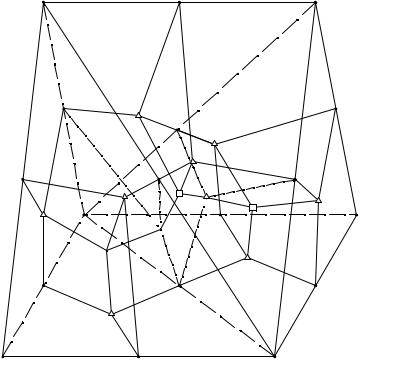
Легко видеть, что вершины призмы отвечают чистым солям. Если мы имеем случай, когда двойные соли и гидраты солей не образуются, т. е. когда твердые фазы состоят только из 6 солей AX, BX, CX, AY, BY, CY, то весь объем призмы разобьется на 6 объемов кристаллизации солей, которые хорошо видны на диаграмме, изображенной на рис. 8. 3. Эти объемы разделяются при помощи поверхностей вторичных кристаллизаций, отвечающих одновременной кристаллизации соответствующей пары солей; поверхности вторичных кристаллизаций пересекаются по пограничным линиям, отвечающим совместной кристаллизации той или иной тройки солей.
Наконец, точки Е1, Е2 и Е3 отвечают одновременной кристаллизации четырех солей, а именно: Е1 - одновременной кристаллизации AX, BX, CX, CY; Е2 - кристаллизации BX, AY, CY, AX и Е3 - кристаллизации BX, AY, BY, CY. Эти точки являются точками четверных эвтектик в системах без растворителя и солевыми проекциями эвтоник в системах с растворителем. Призматическую диаграмму
83
можно разбить соответствующими плоскими сечениями на три неправильных тетраэдра. Эти сечения можно провести, например, так: проводим диагональную плоскость AX - BX - CY и отделяем тетраэдр CY - AX - BX - CX; в оставшейся части призмы проводим диагональную плоскость AY - BX - CY и получаем еще два неправильных тетраэдра AX - AY - CY - BX и BY - AY - BX - CY.
I(AX) |
IV(AY) |
e6
e7
e4 |
e1 II(BX) |
e3 |
|
E1


e5 |
E2  e10
e10
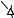 e9
e9
E3 |
e2 |
V(BY) |
|
|
e8 |
III(CX) |
VI(CY) |
Рис. 8. 3. Принципиальная схема изотермы растворимости пятерной взаимной системы А+, В+, С+ //X-, Y- - H2O
Таким образом, состав системы или ее солевой массы всегда может быть выражен при помощи четырех солей; каких именно - зависит от того, в какой из указанных трех тетраэдров попадает заданная фигуративная точка. На рис. 8. 4 представлено такое деление призматической диаграммы, изображенной на рис. 8. 3, при помощи двух диагональных сечений: I, II, VI и II, IV, VI. На рис. 8. 4 пересечения этих плоскостей с соответствующими боковыми гранями призмы обра-
зуют линии II - VI, I - VI, II - IV.
Одинаковые точки на рис. 8.3 и 8.4 обозначены одинаковыми буквами. Для изображения полученной диаграммы на плоскости можно пользоваться ортогональными проекциями на основание и одну из боковых граней призмы. При построении таких проекций не встречается никаких затруднений, и мы на них останавливаться не будем.
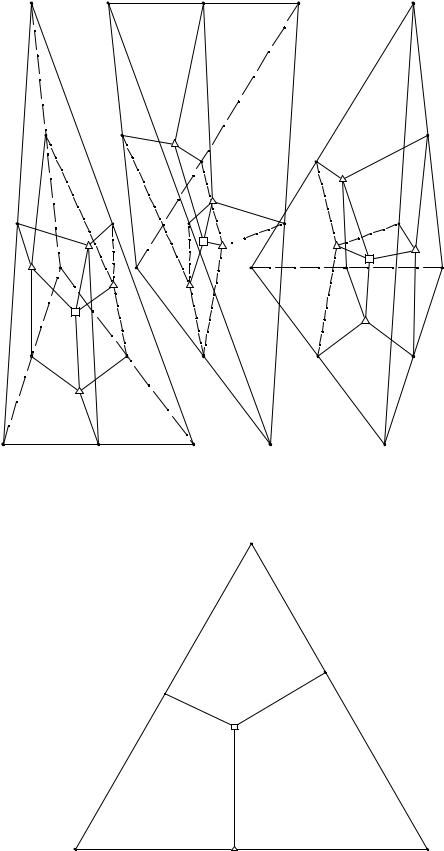
Иногда изображают отдельные части призматической диаграммы при помощи перспективных проекций с центром в той или иной вершине призмы. Например, поверхности, ограничивающие объем кристаллизации соли BY и лежащие в правом тетраэдре рис. 8. 4, удобно спроецировать на плоскость II - IV - VI из
84
вершины V как из центра. При этом получается плоская диаграмма, лежащая в равнобедренном треугольнике VI - II - IV.
I(AX) |
I(AX) |
IV(AY) |
IV(AY) |
e6
e7
|
|
|
|
|
e4 |
||
|
e3 |
|
|
|
E2 |
e10 |
|
e1 |
II |
e9 |
II |
e9 |
II |
||
|
|||||||
|
|
|
|||||
|
E1 |
|
|
|
|
|
|
e10 |
E3 |
e2 |
|
|
V(BY) |
e8 |
e5 |
III(CX) |
VI(CY) |
VI(CY) |
VI(CY) |
Рис. 8. 4. Триангуляция солевой проекции изотермы растворимости пятерной взаимной системы А+,В+,С+//X-,Y--H2O по двум стабильным диагональным разрезам
II(BX )
 e7
e7
e8 
E3
VI(CY) |
e2 |
IV(AY) |
85
Рис. 8. 5. Перспективная проекция поверхностей, ограничивающих объем кристаллизации соли BY
На рис. 8. 5 изображена такая плоская диаграмма, причем видны проекции поверхности вторичных кристаллизаций солей BY и CY (VI(CY)е8Е3е2), солей BY и AY (IV(AY)е2Е3е7), солей BY и BX (II(BX)е8Е3е7); легко видеть, что каждая из указанных поверхностей отвечает кристаллизации соли BY с той солью, формула которой стоит в соответствующей вершине. Кроме того, на указанной проекции видны проекции линий третичных кристаллизаций е8Е3, е7Е3, е2Е3 и проекция нонвариантной точки Е3 (четверной эвтоники или эвтектики).
9. ПЛАНИРОВАНИЕ ИССЛЕДОВАНИЙ МНОГОКОМПОНЕНТНЫХ ВОДНО-СОЛЕВЫХ СИСТЕМ
9.1. Методы исследований водно-солевых систем
Для установления оптимальных условий синтеза солей необходимо провести исследования растворимости в соответствующих системах. Выбор метода исследований играет первостепенную роль для получения требуемых экспериментальных данных.
Классическими методами определения составов равновесных жидких и твердых фаз в водно-солевых системах в изотермических условиях являются метод остатков Схрейнемакерса, аналитический, изопиестический методы и др. Метод остатков отличается от аналитического метода тем, что сочетает аналитические и графические способы получения экспериментальных данных и базируется на теории гетерогенных равновесий. Практическим недостатком этих методов является зависимость надежности получаемых результатов от точности выбранных методик определения ионов.
Сущность изопиестического метода заключается в том, что при изотермическом испарении воды из исходной реакционной смеси определенного состава до постоянного значения активности воды, отвечающей эвтоническому раствору, получают фигуративные точки, лежащие на предельных нодах. Пересечение предельных нод со сторонами треугольника состава дает составы твердых фаз, пересечение предельных нод друг с другом - состав эвтонического раствора. Количества испарившейся воды определяют взвешиванием, точность взвешивания определяет точность метода. К достоинствам метода можно отнести его простоту и возможность проверки экспериментальных данных, полученных другими методами. Недостатком этого метода является отсутствие данных, позволяющих построить изотерму растворимости.
Для определения растворимости солей и составов твердых фаз в двойных, тройных и четверных системах широко применяется изотермический метод сечений, разработанный Р. В. Мерцлиным. Сущность и основное отличие метода сечений от вышеописанных состоит в том, что при заданной температуре после установления равновесия в исходных комплексах определяется какое-либо легко измеряемое свойство жидкой фазы и строится функциональная зависимость этого
86
свойства от состава исходных комплексов, располагающихся в определенном порядке по изменению концентрации компонентов - в определенных сечениях. Точки изломов функциональной зависимости указывают на границы фазовых полей в сечениях. Точность метода сечений зависит от точности определения точек изломов функциональной зависимости.
К преимуществам метода сечений можно отнести корреляцию изотермы физического свойства с изотермой растворимости; возможность идентификации твердой фазы сопоставлением физических свойств этой фазы и чистых компонентов; возможность определения координат точек, лежащих не только на изотерме растворимости, но и на предельных нодах.
Визуально-политермический метод определения растворимости в водносолевых системах является менее точным по сравнению с методами, описанными выше. Этот метод основан на фиксировании изменения какого-либо физического свойства системы при непрерывном изменении температуры. Такими свойствами могут быть появление кристаллов, изменение вязкости, объема и др. Состав системы всегда задан, это исключает необходимость применения аналитических методов. В случаях, когда нельзя достигнуть четкого фиксирования изменения физических свойств системы, метод не применим.
Сочетание методов позволяет при минимальной затрате времени исследовать моновариантные и нонвариантные равновесия жидких и твердых фаз в многокомпонентной системе и выбрать оптимальные условия получения солей.
9.2. Планирование исследований
Основным методом изучения растворимости в многокомпонентных водносолевых системах, приведенных в данном пособии, являлся видоизмененный метод сечений, который также можно назвать видоизмененным аналитическим методом или видоизмененным методом остатков. Сущность видоизменения заключается в использовании вместо физического свойства состава насыщенного раствора, а вместо остатка - состава исходной реакционной смеси, которая, как и остаток, лежит на одной прямой, соединяющей равновесные фазы.
Нанося на график составы насыщенного раствора и исходной реакционной смеси, соединяя их прямой линией и продолжая прямую до пересечения с координатными осями, можно определить состав равновесной твердой фазы, не анализируя остаток. Эту же операцию можно выполнить путем математических вычислений по разработанной для этой цели программе.
Ключевым моментом видоизмененного метода сечений является выбор состава исходной реакционной смеси (СИРС), который должен соответствовать следующим условиям:
1)находиться в исследуемой фазовой области системы;
2)в процессе термостатирования распадаться на жидкие и твердые фазы в количествах, позволяющих легко производить перемешивание (15-30 % твердых веществ) и достаточно надежно вычислять состав твердой фазы;
3)количества твердых веществ в донной фазе должны быть приблизительно одинаковыми.
87
Определение таких оптимальных составов исходных реакционных смесей поддается математическому вычислению.
Например, оптимальный план изучения четверной системы простого эвтонического типа будет следующим. Сначала изучают оконтуривающие системы и определяют составы двойных эвтоник. Из трех двойных эвтоник выбирают две с максимальным содержанием высаливающего компонента или с минимальным содержанием воды.
Для вычисления предполагаемого состава тройного эвтонического раствора в разведочном опыте можно решить следующую систему уравнений:
|
= y / y1 = w / w1 |
|
x / x1 |
|
|
x / x2 |
= z / z2 = w / w2 |
(9. 1) |
|
+ z =100 , |
|
x + y |
|
где x1, y1, w1 – содержание солевых компонентов и воды в первом двойном эвтоническом растворе; x2, z2, w2 – содержание солевых компонентов и воды во втором двойном эвтоническом растворе; x, y, z, w – содержание солевых компонентов и воды в предполагаемом составе тройного эвтонического раствора.
Кроме того, предполагаемый состав тройного эвтонического раствора можно определить, и не решая систему (9. 1). В качестве предполагаемого состава тройного эвтонического раствора можно выбрать такой состав, содержание солевых компонентов в котором равно максимальному количеству соответствующего компонента в одном из двух двойных эвтонических растворов с максимальным содержанием высаливателя или минимальным содержанием воды. В математических терминах этот состав (x, y, z, w) может быть записан следующим образом:
x = x1 (если x1 > x2); y = y2 (y2 > y1); z = z1 (z1 > z2); w = 100-x-y-z.
Оптимальный состав исходной реакционной смеси находится на прямой, проходящей через фигуративные точки предполагаемого состава тройного эвтонического раствора и оптимального соотношения твердых фаз (по 33.33% каждой). Кроме того, соотношение жидкой и твердой фаз должно быть не более 4:1. Все это позволяет вычислить состав исходной смеси по уравнению прямой в многомерном пространстве:
x − x1 |
= |
y − y1 |
= |
z − z1 |
=...= k . |
(9. 2) |
|||||||||
x |
2 |
− x |
1 |
y |
2 |
− y |
1 |
z |
2 |
− z |
|||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
1 |
|
|
||||||
Таким образом, содержание любого компонента в оптимальном составе исходной реакционной смеси (xСИРС) вычисляется по следующей формуле:
xСИРС=x·(1–k)+k·XТФ, |
(9. 3) |
где x – содержание компонента в предполагаемом составе эвтонического раствора, массовые доли; xТФ – содержание компонента в твердой фазе, массовые доли; k
– коэффициент, показывающий соотношение твердой и жидкой фаз в исходной реакционной смеси. В наших опытах его значение принимали в интервале 0.1÷0.3.
88
С целью подтверждения нонвариантного характера тройного эвтонического раствора проводят повторный опыт. Состав исходной реакционной смеси рассчитывают по уравнению (9. 3), где в качестве предполагаемого состава используют состав насыщенного раствора, полученный в разведочном опыте, или сразу проводят несколько опытов с различными оптимальными составами исходных реакционных смесей, отличающимися соотношениями твердых и жидких фаз. Если после проведения опытов полученные таким образом составы насыщенных растворов отличаются друг от друга не более чем в пределах ошибок определения компонентов, то это означает, что состав эвтонического раствора определен.
Далее изучают линии моновариантного равновесия. Составы предполагаемых растворов (x) рассчитывают по уравнению прямой, соединяющей соответствующие двойные и тройную эвтоники системы:
x = x1·(1–k) + k·x2, |
(9. 4) |
где x1 – содержание компонента в первом насыщенном растворе; x2 – содержание компонента во втором насыщенном растворе.
Коэффициент (k) в уравнении (9. 4) задается в соответствии с количеством фигуративных точек, которые необходимо получить между двумя известными составами нонвариантных насыщенных растворов. Он вычисляется по формуле
k = n/(N + 1), где N – необходимое количество точек, а n – целое число, изменяющееся от 1 до N.
Составы исходных реакционных смесей при исследовании линий моновариантного равновесия также находятся на прямой, соединяющей предполагаемый состав насыщенного раствора и оптимальный состав твердой фазы. Эти составы вычисляются по уравнению (9. 3).
Для изучения поверхности кристаллизации солевого компонента (дивариантное равновесие) в четверной системе используются разрезы через вершины воды, интересующего солевого компонента и точку с фиксированным соотношением двух других солевых компонентов. В разрезе с появлением дополнительного условия вариантность равновесий уменьшается на единицу и поверхность кристаллизации вырождается в линию. Такое построение разрезов пересекает линию двойного насыщения и проецируется на разрез в виде нонвариантной точки.
Предполагаемые составы насыщенных растворов в разрезах рассчитываются по той же формуле (9. 4), что и для линий моновариантного равновесия в системах, образованных чистыми компонентами, а составы исходных реакционных смесей вычисляются по уравнению (9.3). При этом составами насыщенных растворов, между которыми проводится прямая линия предполагаемых составов насыщенных растворов, являются растворимость компонента и точка пересечения разреза с линией двойного насыщения в четверной системе, а оптимальным составом твердой фазы является чистый компонент.
Вычисление оптимальных составов исходных реакционных смесей для исследования монотектических равновесий осуществляется по формулам 9.2-4. Однако в этом случае вместо предполагаемого состава насыщенного раствора используется суммарный состав жидкой фазы, находящийся приблизительно на се-
89
редине ноды (оптимальное положение этой точки определяется равенством объемов равновесных жидких фаз). Состав исходной реакционной смеси (СИРС) также должен находиться на ноде, соединяющей эту точку жидкой фазы и точку оптимального соотношения твердых фаз, таким образом, чтобы количество донных осадков было не более 30 % от массы всей смеси, но не менее 10 % от этой массы.
Приблизительные составы равновесных жидких фаз, участвующих в монотектическом равновесии, определяли в опытах по исследованию соответствующих линий моновариантного равновесия, в которых было отмечено появление расслаивания и в которых удалось отобрать жидкие фазы на анализ.
9.3. Математическая обработка экспериментальных данных
Математическая обработка экспериментальных данных используется в следующих основных случаях:
Вычисление содержания солей и воды в насыщенных растворах по результатам анализов.
Контроль правильности проведенного эксперимента. Вычисление равновесного состава твердой фазы.
Использование полученных экспериментальных данных для вычисления различных технологических параметров, построения математической модели, расчета промежуточных значений составов и свойств насыщенных растворов и др.
Содержание иона, который не анализировался или определялся наименее точно, рассчитывается по уравнению ионного баланса:
n |
m |
|
∑[Kati+ ] = ∑[ An−j ], |
(9. 5) |
|
i=1 |
j=1 |
|
где [Kati+ ] – содержание i-го катиона в насыщенном растворе (моль/кг раствора); n – количество типов катионов в системе; [ An−j ] – содержание j-го аниона в на-
сыщенном растворе (моль/кг раствора); m – количество типов анионов в системе. Определение солевого состава насыщенного раствора по его ионному составу зависит от порядка и типа системы. Например, пятерная взаимная система триангулируется на три простые пятерные системы по стабильным парам солей оконтуривающих четверных взаимных систем. Для каждой простой пятерной системы выводятся свои формулы для расчета солевого состава. Принадлежность данного состава конкретной пятерной системе определяется соотношением меж-
ду содержанием ионов.
Так, для разрезов пятерной взаимной системы, построенных по стабильным парам солей, соблюдается равенство содержания двух определенных ионов. При изменении содержания одного из ионов, равенство нарушается и точка, соответствующая составу насыщенного раствора, смещается из плоскости разреза в одну из пятерных систем.
Содержание воды (% мас.) в насыщенном растворе находится по формуле
WH2O = 100 - S1 - ...- Sn , |
(9. 6) |
90
где S1...Sn (% мас.) – содержание солевых компонентов в насыщенном растворе; n - количество солевых компонентов.
Определение равновесного состава твердой фазы проводится после аналитического определения содержания компонентов в насыщенном растворе. Для систем простого эвтонического типа вычисляется соотношение равновесных твердых фаз по составам насыщенного раствора, исходной реакционной смеси или остатка. Эта задача сводится в общем случае к нахождению точки пересечения прямой, образованной составами насыщенного раствора, исходной реакционной смеси или остатка, с плоскостью, образованной кристаллизующимися твердыми фазами.
Для системы, кристаллизующиеся фазы в которой представлены чистыми солевыми компонентами, состав равновесной твердой фазы определяется по уравнению прямой с учетом нулевого содержания воды в твердой фазе. Расчет в этом случае производится по формуле
ХТФ = |
WНР |
( X ИРС − X НР ) + X НР , |
(9. 7) |
|
WНР −WИРС |
||||
|
|
|
где XТФ – содержание солевого компонента в твердой фазе; WНР - содержание воды в насыщенном растворе; WИРС - содержание воды в исходной реакционной смеси или остатке; XИРС – содержание соответствующего солевого компонента в исходной реакционной смеси или остатке; XНР – содержание соответствующего солевого компонента в насыщенном растворе.
В четверных водно-солевых системах, в которых образуются кристаллогидраты или смешенные химические соединения, вычисление составов равновесных твердых фаз производится определением координат точки пересечения прямой с плоскостью. Прямая задается составами насыщенного раствора (x1l , y1l, z1l) и исходной реакционной смеси или остатка (x2l , y2l, z2l), а плоскость - тремя составами твердых фаз:
|
|
x − x1 |
|
y − y1 |
z − z1 |
|
|
|
|||||
|
|
|
|
|
|||||||||
|
|
a |
1 |
|
|
b |
|
|
c |
= 0 |
|
||
|
|
|
|
1 |
|
|
1 |
|
|
|
|||
|
|
a2 |
|
|
b2 |
|
|
c2 |
|
|
(9. 8) |
||
|
|
|
|
|
|
|
, |
||||||
|
|
x − xl |
= |
|
y − yl |
= |
z − zl |
= k |
|
||||
|
|
|
1 |
|
|
1 |
|
1 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
a |
|
|
b |
|
|
c |
|
|
|
||
где a = x2l – x1l; b = y2l – y1l; c = z2l – z1l; a1 = x2 – x1; b1 = y2 – y1; c1 = z2 – z1; |
|
||||||||||||
a2 = x3 – x1; b2 = y3 – y1; c2 = z3 – z1. |
|
||||||||||||
(x1l |
, y1l, z1l) - координаты первой точки на линии; |
|
|||||||||||
(x2l , y2l, z2l) - координаты второй точки на линии; |
|
||||||||||||
(x1, y1, z1) |
- координаты первого состава твердой фазы; |
|
|||||||||||
(x2, y2, z2) |
- координаты второго состава твердой фазы; |
|
|||||||||||
(x3, y3, z3) |
- координаты третьего состава твердой фазы. |
|
|||||||||||
Решением системы (9. 8) являются следующие выражения для координат точки пересечения:
