
С.А. Мазунин, Г.С. Посягин ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА Часть 2. 1999г
..pdf
61
гидрофосфата аммония и хлорида триэтиламмония (e1E); дигидрофосфата аммония и хлорида триэтиламмония (e2E); линия двойного насыщения относительно фосфатов аммония разорвана предельной монотектической нодой на две части (e3M и NE); точка (Е), отображающая солевой состав тройного эвтонического раствора, насыщенного относительно всех трех солевых компонентов системы.
6.5. Порядок кристаллизации солевых компонентов в процессе изотермического испарения исходных реакционных смесей водно-солевых систем монотектического типа
Для исследования процесса изотермического испарения воспользуемся изотермой растворимости системы NH4H2PO4 - (NH4)2HPO4 - (C2H5)3NHCl - H2O при 20°С, которая в упрощенном виде представлена на рис. 6. 5.
NH4H2PO4
G3
G2  e3 M GH
e3 M GH

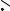



K2 |
G |
|
F1H |
G1 |
GB |
F4 |
K1 |
F2 |
N |
F3 |
|
F1B |
|
F |
|
Ee2 |
|
|
|
||
|
|
|
e1 |
0 |
20 |
40 % мас. 60 |
80 |
100 |
(NH4)2HPO4 |
|
(C2H5)3NHCl |
||
Рис. 6. 5. Процесс изотермического испарения различных исходных смесей системы NH4H2PO4 - (NH4)2HPO4 - (C2H5)3NHCl - H2O при 20°С
Рассматривая рис. 6. 5, отмечаем, что порядок кристаллизации исходных смесей, лежащих в треугольниках (NH4)2HPO4-N-(C2H5)3NHCl и NH4H2PO4-N- (C2H5)3NHCl, ничем не отличается от таковых в четверных водно-солевых системах простого эвтонического типа.
Солевой состав исходной реакционной смеси F находится в треугольнике (NH4)2HPO4-N-M в поле кристаллизации гидрофосфата аммония, а не в монотек-
62
тической области этого треугольника. Поэтому при изотермическом испарении сначала кристаллизуется гидрофосфат аммония, солевой состав жидкой фазы меняется по лучу (NH4)2HPO4-F от точки F до точки F1В на границе монотектической области, точка твердой фазы остается в вершине солевого треугольника состава, отвечающей гидрофосфату аммония.
В точке F1В возникает первая капля второй жидкой фазы, вариантность системы уменьшается на единицу: составы жидких фаз начинают изменяться по линии моновариантного равновесия кристаллов гидрофосфата аммония и двух жидких фаз (верхняя - по линии F1BN, нижняя - по F1HM).
По аналогии с понятием точки твердой фазы, которое означает средний солевой состав твердой фазы, введем понятие точки жидкой фазы, подразумевающее средний солевой состав жидкой фазы, состоящей из двух или более различных жидких фаз.
При дальнейшем изотермическом испарении продолжает кристаллизоваться гидрофосфат аммония, точка жидкой фазы перемещается по лучу (NH4)2HPO4- F1В от точки F1В до точки F2 на предельной монотектической ноде. Состав нижней жидкой фазы при этом меняется по границе монотектической области от точки F1Н до точки М, состав верхней - от точки F1В до точки Ν.
Когда точка жидкой фазы оказывается в точке F2, появляется первый кристалл дигидрофосфата аммония и при изотермическом испарении протекает инконгруэнтная условно нонвариантная монотектическая фазовая реакция:
M(L) → N(L) + (NH4)2HPO4(S) + NH4H2PO4(S).
Реакция заканчивается после исчезновения последней капли нижней жидкой фазы. Во время протекания предельной монотектической фазовой реакции составы жидких фаз остаются постоянными, точка жидкой фазы перемещается по предельной ноде от точки F2 до точки Ν, суммарный состав твердой фазы изменяется по стороне солевого треугольника состава от вершины, отвечающей гидрофосфату аммония, до точки F3.
Далее протекает процесс совместной кристаллизации гидрофосфата и дигидрофосфата аммония. Состав жидкой фазы меняется по линии двойного насыщения относительно фосфатов аммония от точки N до точки E, точка твердой фазы - от точки F3 до точки F4.
В точке E начинается кристаллизация трех твердых фаз, при постоянной температуре и давлении четырехфазное равновесие является нонвариантным, составы равновесных фаз постоянны. Суммарный состав твердой фазы изменяется по лучу F4-E от точки F4 до точки F, когда точка твердой фазы приходит в точку F, тогда исчезает последняя капля эвтонического раствора Е.
Составы исходных реакционных смесей, находящиеся в треугольнике NH4H2PO4-N-M в поле кристаллизации дигидрофосфата аммония, но не в монотектической области этого треугольника, кристаллизуются так же, как смесь F, но начинает кристаллизоваться дигидрофосфат аммония.
Солевой состав исходной реакционной смеси G находится в монотектической области треугольника NH4H2PO4-N-M. Поэтому при изотермическом испаре-
63
нии сначала произойдет расслаивание, солевой состав жидкой фазы остается в точке G, солевые составы равновесных жидких фаз изменяются от точки G до точек GН и GВ на границе монотектической области, твердая фаза в это время отсутствует.
Когда составы нижней и верхней жидких фаз оказываются в точках GН и GВ соответственно, начинается кристаллизация дигидрофосфата аммония. Далее точка жидкой фазы меняется по лучу NH4H2PO4-G от точки G до точки G1, солевой состав нижней жидкой фазы перемещается по границе монотектической области от точки GН до точки М, верхней - от точки GВ до точки N, суммарный солевой состав твердой фазы находится в вершине дигидрофосфата аммония.
По достижении составами жидких фаз точек М и N начинается предельная
монотектическая фазовая реакция: M(L) → N(L) + (NH4)2HPO4(S) + NH4H2PO4(S), составы жидких фаз остаются постоянными, точка жидкой фазы перемещается по
предельной монотектической ноде MN от точки G1 до точки N, точка твердой фазы перемещается из вершины дигидрофосфата аммония в точку G2.
Далее протекает процесс совместной кристаллизации гидрофосфата и дигидрофосфата аммония. Состав жидкой фазы меняется по линии двойного насыщения относительно фосфатов аммония от точки N до точки E, точка твердой фазы - от точки G2 до точки G3.
Вточке E начинается кристаллизация трех твердых фаз, составы равновес-
ных фаз постоянны. Суммарный состав твердой фазы изменяется по лучу G3-E от точки G3 до точки G, когда точка твердой фазы приходит в точку G, тогда исчезает последняя капля эвтонического раствора Е, процесс изотермического испарения завершается.
Составы исходных реакционных смесей, находящиеся в монотектической
области треугольника (NH4)2HPO4-N-M, при изотермическом испарении кристаллизуются аналогично смеси G, но первым выделяется в осадок гидрофосфат аммония.
Особенностью кристаллизации составов исходных реакционных смесей,
находящиеся в кривосторонних треугольниках (NH4)2HPO4-e3-M и NH4H2PO4-e3- M, при изотермическом испарении является тот факт, что после первичной кристаллизации гидрофосфата или дигидрофосфата аммония соответственно, вторичной кристаллизации смеси этих фаз сразу начинается нонвариантная монотектическая фазовая реакция, в дальнейшем они ведут себя аналогично смесям F и G.
7.ОСНОВНЫЕ ТИПЫ ИЗОТЕРМ РАСТВОРИМОСТИ ЧЕТВЕРНЫХ ВЗАИМНЫХ ВОДНЫХ СИСТЕМ
Внастоящей главе обсуждаются системы, называемые четверными взаим-
ными водно-солевыми или взаимными водными четверными, в которых могут идти только реакции обмена. Символически они обозначаются так: А+, В+ // X-, Y- -
H2O или AX + BY ↔ AY + BX - H2O.
64
7. 1. Применение правила фаз к четверным взаимным водно-солевым системам
Рассмотрим взаимную систему, образованную двумя солями без общих ионов с водой, в которой протекает следующая реакция обмена:
AX + BY ↔ AY + BX. |
(7. 1) |
Врезультате реакции (7. 1) соли AX и BY дают соли AY и BX и в системе имеется пять составных частей (четыре соли и вода). Так как в нашей системе протекает химическая реакция, то она относится ко второму классу, или к классу физико-химических систем.
Число компонентов в таких системах равно числу составных частей, уменьшенному на количество независимых реакций, которые могут между ними идти. Таким образом, данная система будет четырехкомпонентной. Состав такой четверной взаимной системы может быть задан содержанием трех солей и воды. Состав солевой массы соответственно однозначно задается содержанием трех солей. Кроме того, в водном растворе взаимной пары солей сумма концентраций катионов равна сумме концентраций анионов, и, следовательно, состав раствора или солевой массы может быть выражен через любые три концентрации ионов.
Концентрации солей часто выражают в моль-эквивалентах. Например, в системе Mg2+, Na+ // SO42-, Cl- - H2O содержание хлорида натрия пересчитывают на Na2Cl2. Состав солевой массы пересчитывают на три соли, получается две тройки солей, в которых две соли общие. Как правило, состав раствора выражают теми тройками солей, которые насыщают эвтонические растворы. Общая пара солей в этом случае носит название стабильной пары.
Всистеме Na+, (C2H5)2NH2+ // HCO3-, Cl- - H2O при средних температурах не образуются кристаллогидраты и двойные соли (см. раздел 11). Твердыми фаза-
ми системы являются NaCl, (C2H5)2NH2Cl, (C2H5)2NH2HCO3 и NaHCO3.
Максимально возможное число одновременно существующих фаз можно определить исходя из правила фаз: В = 4 + 2 - Ф; если В = 0, то Ф = 6. Это значит, что существование пара, насыщенного раствора и четырех твердых солей возможно только при строго определенных температуре и давлении пара.
Для заданной постоянной температуры число степеней свободы уменьшается на единицу. Когда В = 0, число фаз Ф = 5, т.е. число равновесных фаз не может быть больше пяти.
Теоретически возможны следующие комбинации фаз (пар, раствор, три соли) указанной системы, находящейся в условно нонвариантном равновесии:
1)V(пар), L(раствор), NaCl, (C2H5)2NH2Cl, (C2H5)2NH2HCO3;
2)V, L, NaCl, (C2H5)2NH2Cl, NaHCO3;
3)V, L, (C2H5)2NH2Cl, (C2H5)2NH2HCO3, NaHCO3;
4)V, L, NaCl, (C2H5)2NH2HCO3, NaHCO3.
Из этих четырех комбинаций только две реально существуют. Это подтверждается следующим правилом, определяющим устойчивые растворы. Из двух
65
взаимных пар солей является неустойчивой та из них, которая обладает большим произведением растворимости отдельных солей.
Определим произведение растворимости пар солей при 25°С: NaCl + +(C2H5)2NH2HCO3 и NaHCO3 + (C2H5)2NH2Cl. Растворимость отдельных солей при этой температуре в молях на 1000 г раствора равна: 4.51 - NaCl; 4.05 - (C2H5)2NH2HCO3; 1.09 - NaHCO3; 4.78 - (C2H5)2NH2Cl. Произведение растворимости: NaCl·(C2H5)2NH2HCO3 = 464.7 > NaHCO3·(C2H5)2NH2Cl = 48.2, т.е. пара солей хлорид натрия - гидрокарбонат диэтиламмония является неустойчивой; поэтому эти соли не могут совместно существовать в твердой фазе при данной температуре.
Таким образом, из четырех указанных выше комбинаций фазовых равновесий 1-я и 4-я невозможны, реально существуют только 2-я и 3-я.
Указанное определение произведения растворимости соответствует случаю, когда соли взаимной пары при диссоциации дают по одной паре ионов одинакового заряда. Несколько иной способ подсчета применяется для растворов солей, образованных разнозарядными ионами.
Рассмотрим, например, взаимную пару солей системы (NH4)2B4O7 + +Na2Cl2 ↔ Na2B4O7 + (NH4)2Cl2 - H2O. В этой системе соли Na2Cl2 и (NH4)2Cl2 рас-
падаются на четыре иона, а соли (NH4)2B4O7 и Na2B4O7 - на три иона.
При вычислении произведения растворимости величины растворимости, выраженные в молях, возводятся в степень, равную числу образовавшихся ионов, т.е. для солей Na2Cl2 и (NH4)2Cl2 в четвертую степень, а для боратов - в третью. Тогда при 0°С произведение растворимости для каждой пары солей можно напи-
сать следующим образом: [Na2Cl2]4·[(NH4)2B4O7]3 = 3.044·0.2033 = 0.71 > >[(NH4)2Cl2]4·[Na2B4O7]3 = 2.764·0.0553 = 0.0096, т.е. стабильной парой солей явля-
ются хлорид аммония и тетраборат натрия.
Возвращаясь к системе Na+, (C2H5)2NH2+ // HCO3-, Cl- - H2O, отметим, что для одновариантных насыщенных растворов В = 1; Ф = 4, т.е. максимальное число равновесных фаз равно четырем. Число комбинаций из четырех солей по две равно: 4·3/1·2 = 6. В принципе возможны следующие комбинации с четырьмя фазами:
1)V(пар), L(раствор), NaCl, NaHCO3;
2)V, L, NaCl, (C2H5)2NH2HCO3;
3)V, L, (C2H5)2NH2Cl, NaCl;
4)V, L, (C2H5)2NH2HCO3, NaHCO3;
5)V, L, (C2H5)2NH2Cl, NaHCO3;
6)V, L, (C2H5)2NH2HCO3, (C2H5)2NH2Cl.
Количество моновариантных равновесий определяет число линий на изо-
терме.
Пара солей NaCl и (C2H5)2NH2HCO3 является неустойчивой, следовательно, число реально существующих при постоянной температуре моновариантных растворов равно пяти. Соответственно этому на изотерме должно быть пять линий двойного насыщения, пересекающихся в двух нонвариантных точках.
66
Для дивариантных насыщенных растворов В = 2, Ф = 3, т.е. максимальное число совместно существующих фаз равно трем. Возможны следующие сочетания
стремя фазами:
1)V(пар), L(раствор), NaCl;
2)V, L, (C2H5)2NH2HCO3;
3)V, L, (C2H5)2NH2Cl;
4)V, L, NaHCO3.
Таким образом, на изотерме растворимости четверной взаимной водносолевой системы, не образующей кристаллогидратов и двойных солей, должно быть, согласно правилу фаз, четыре поля кристаллизации солей, пять линий двойного насыщения и две тройные точки.
В политермической диаграмме системы есть лишь одна нонвариантная точка, в которой совместно существуют пар, раствор и четыре твердые соли. Если построить изотермическую диаграмму растворимости для соответствующей температуры, то на ней четыре кривые, изображающие составы растворов, насыщенных двумя солями, пересекаются в одной точке, изображающей раствор, находящийся в равновесии с четырьмя твердыми солями.
Фигуративная точка, изображающая состояние равновесия шести фаз - раствора, пара и четырех твердых солей, называется точкой инверсии или точкой превращения. Этой точке отвечают строго определенные температура и давление.
Выше точки инверсии будет устойчивой одна из взаимных пар солей, ниже этой точки - другая пара, т. е. каждая пара солей является общей в каждой комбинации из трех солей, находящихся в равновесии с раствором. Такую пару солей называют устойчивой (стабильной) парой.
Реакция обменного разложения, в общем случае, сдвинута в сторону образования устойчивой пары солей.
Вточке инверсии обе пары солей устойчивы, произведение растворимости,
вобщем случае, одинаково для обеих взаимных пар солей. При изменении температуры в этой точке происходит превращение (инверсия) одной устойчивой пары солей в другую. Начиная от температуры точки инверсии, в пределах определенного температурного интервала, носящего название интервала превращения, при соприкосновении избытка устойчивой пары солей с водой имеет место взаимодействие между солями; при этом выделяется одна из солей неустойчивой пары. Вне интервала превращения можно приготовить насыщенный раствор устойчивой пары солей. Эта пара солей растворяется конгруэнтно, а внутри интервала превращения - инконгруэнтно.
Таким образом, точка инверсии является как бы температурной границей двух интервалов превращения - по одну сторону от нее находится интервал превращения той взаимной пары солей, которая устойчива при более низкой температуре, а по другую сторону - интервал превращения пары солей, устойчивой при более высокой температуре.
67
7. 2. Принципиальная схема пространственной изотермической диаграммы растворимости
Изобразить на одной диаграмме растворимости изменение состояния системы в зависимости от концентрации всех солей и от температуры весьма трудно. Поэтому ограничиваются построением изотермической диаграммы, дающей зависимость между растворимостью компонентов системы при постоянной температуре.
Для графического изображения четверных водных взаимных систем используются ортогональные и перспективные проекции правильной четырехгранной пирамиды.
На рис. 7. 1 изображена пространственная диаграмма системы А+, В+ // X-, Y- - H2O, не образующая кристаллогидратов или двойных солей и имеющая стабильную диагональ. Боковые грани пирамиды состава имеют форму равностороннего треугольника, а основание - форму квадрата. Два соседних ребра образуют угол в 60°, а два противоположных - угол в 90°.
Вершина пирамиды отвечает чистой воде. Четыре угла квадратного основания отображают составы четырех солей взаимной пары, причем каждой паре солей соответствуют противолежащие по диагонали углы квадрата. На ребрах пирамиды, сходящихся у вершины H2O, откладывают составы двойных систем из соответствующей соли и воды.
На каждой из треугольных граней пирамиды нанесены изотермы растворимости двух одноионных солей. Площадь квадратного основания пирамиды отвечает смесям безводных солей. Точки внутри пирамиды отображают четырехкомпонентные системы (три соли и вода).
Внутри пирамиды имеются две тройные точки Е1 и Е2, соответствующие составам растворов, находящихся в равновесии с тремя твердыми фазами: в точке Е1 - с солями АХ, ВХ и AY, в точке Е2 - с солями ВY, ВХ и AY.
Кроме того, внутри пирамиды состава имеются: поверхности R1e12Е1e14R1,
R2e12Е1e24E2e23R2, R3e23Е2e34R3 и R4e14Е1e24E2e34R4, отвечающие четверным раство-
рам, насыщенным одним веществом; эвтонические линии Е1e12, Е1e14, Е1e24, Е2e24, Е2e23, Е2e34, отвечающие четверным растворам, насыщенным двумя веществами.
Поверхности дивариантных равновесий, линии моновариантных равновесий, эвтонические точки с предельными нодами делят пирамиду состава на некоторые объемы, нахождение в которых исходных реакционных смесей приводит к различным фазовым равновесиям.
Область диаграммы (H2OR1e12Е1e14R2e12Е1e24E2e23R3e23Е2e34R4e14Е1e24E2e34),
отсекаемая четырьмя поверхностями от вершины пирамиды, является областью ненасыщенных растворов, и любая исходная реакционная смесь в этом объеме будет представлять собой после установления равновесия гомогенный раствор.
Четыре пространства (AXR1e12Е1e14R1, BXR2e12Е1e24E2e23R2, BYR3e23Е2e34R3
и AYR4e14Е1e24E2e34R4), занимаемые каждой пирамидой с вершиной, расположенной в углу квадратного основания, и кривым основанием, расположенным на изотермической поверхности однонасыщенных растворов, соответствуют исходным
68
смесям, которые после установления равновесия представляют собой гетерогенные системы твердой фазы и насыщенного раствора.
H2O a
P
 b - y
b - y
 G
G
y
R4
M
R1 e14
e14
AYe12

 E1
E1
R2 |


 e
e
 24
24
e34  R3
R3
E2 |
e23 |
BY |
AX BX
Рис. 7. 1. Принципиальная схема объемной диаграммы растворимости системы А+, В+ // X-, Y- - H2O при постоянной температуре
Пять (Е1e14АX-AY, Е1e12АX-ВX, Е1e24Е2ВX-AY, e23Е2ВX-BY и e34Е2BY-AY)
частей пирамиды состава, ограниченные соответственно гранями пирамиды, указанными выше коническими поверхностями и плоскостями Е1АX-AY, Е1АX-ВX, Е1ВX-AY, Е2ВX-AY, Е2ВX-BY и Е2ВY-AY, проведенными через стороны основания пирамиды, стабильную диагональ и эвтоники системы, отвечают смесям двояконасыщенных растворов и соответствующих двух твердых фаз.
Наконец, только что указанные плоскости Е1АX-AY, Е1АX-ВX, Е1ВX-AY, Е2ВX-AY, Е2ВX-BY и Е2ВY-AY вместе с основанием пирамиды состава образуют две пирамиды AX-BX-AYE1 и BY-BX-AYE2, объемы которых отвечают областям совместного существования эвтонических растворов, одновременно насыщенных соответствующими тремя веществами.
Следует обратить внимание на то, что тройная система BX-AY-H2O простого эвтонического типа, изображенная на рис. 7. 1 пунктирной линией, делит четверную взаимную систему на две самостоятельные простые четверные систе-
69
мы AX-BX-AY-H2O и BY-BX-AY-H2O, каждая из которых может изучаться и изображаться самостоятельно.
Большее распространение имели пространственные диаграммы четверной водной взаимной системы, построенные по способу, предложенному Левенгерцом и Вант-Гоффом. При этом концентрации солей и ионов в системах выражались в молях или грамм-эквивалентах солей, отнесенных к постоянному количеству растворителя - 1000 молей воды.
В этом способе квадратное основание пирамиды и фигуративные точки безводных солей находятся в бесконечности, но ребра пирамиды сохраняют свое направление. Количество каждой соли изображается вектором, который откладывается от вершины пирамиды по направлению соответствующего ребра.
Так как сумма катионов равна сумме анионов, то состав раствора взаимной пары солей может быть выражен относительными концентрациями любых трех солей системы.
Например, дан состав раствора взаимной пары солей BY + AX ↔ BX + AY - H2O. В растворе содержится на 1000 молей воды а г-экв иона A+, b г-экв иона В+, х г-экв иона X- и у г-экв иона Y- (причем а<x). Сумма анионов равна сумме катионов, т. е. а+b=х+у. Условно присоединив а г-экв иона A+ к а г-экв иона X-, получим а молей соли AX. Останется (х-а) г-экв иона X-, которые свяжем с равным количеством (b-у) г-экв иона В+. В результате получится (х-а) или (b-у) молей соли BX и останется b-(b-у)=у г-экв иона В+. Это количество иона В+ свяжем с у г-экв иона Y- и получим у молей соли BY.
В результате солевой состав нашего раствора условно выразится концентрацией трех солей : а молей AX, (b-у) молей BX и у молей ВY.
Если а>х, солевой состав раствора выразится так: х молей AX, b молей BY и (у-b) молей AY.
Возвращаясь к системе Na+, (C2H5)2NH2+ // HCO3-, Cl-, в качестве примера примем, что в растворе содержится на 1000 молей воды: 5 г-экв иона СI-, 9 г-экв иона HCO3-, 8 г-экв иона (C2H5)2NH2+ и 6 г-экв иона Na+. Если ионы хлора присое-
динить, например, к ионам диэтиламмония, то получится 5 молей (C2H5)2NH2CI; оставшиеся ионы диэтиламмония можно соединить с ионами HCO3- - получится 3 моля (C2H5)2NH2HCO3; оставшиеся ионы HCO3- присоединим к ионам натрия - получится 1 моль NaHCO3. Возможен другой вариант: ионы хлора связать с ионами натрия - получится 5 молей NaСI, 8 молей (C2H5)2NH2HCO3 и 1 моль
NaHCO3.
Первое сочетание ионов является основным, но во всех случаях количество солей в растворе сводится к трем и представляется возможным построить геометрическое место фигуративной точки системы.
Рассмотрим другой пример. Если в растворе имеются ионы разной валентности, то формулы следует выразить таким образом, чтобы все соли были равноэквивалентны. Уравнение реакции в этом случае следует написать так:
Na2Cl2 + MgSO4 ↔ Na2SO4 + MgCl2,
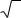
70
т. е. эквиваленты ионов натрия и хлора удваиваются, а молекула хлорида натрия обозначается Na2CI2 (2NaCI), что упрощает расчеты.
Графически положение фигуративной точки раствора в пространственной диаграмме определяется так же, как в случае четверной системы из трех солей с общим ионом. Геометрическое место фигуративной точки состава раствора, содержащего четыре иона, находится внутри пирамиды.
Концентрации трех солей откладываются от вершины воды (см. рис. 7. 1) в любой последовательности отрезками, параллельными соответствующим ребрам пирамиды. Для нанесения на диаграмму раствора указанного состава от вершины H2O откладываем вдоль ребра H2O-AX отрезок длиной а, пропорциональный содержанию в растворе соли AX. Из конца отрезка в плоскости грани H2O-AX-BX (параллельно ребру H2O-BX) проводим отрезок длиной (b-у), пропорциональный содержанию соли BX. Из конца этого отрезка проводим вовнутрь пирамиды отрезок у (параллельны ребру H2O-BY), который соответствует содержанию соли BY.
В результате построения определится положение фигуративной точки M. Точка M однозначно определяет состав системы, в которой содержится на 1000
молей воды: а молей соли AX, (b-у) молей соли BX и у молей соли BY или а г-экв иона A+, b г-экв иона В+, х г-экв иона X- и у г-экв иона Y-.
7. 3. Принципиальная схема плоской изотермической диаграммы растворимости
В практике редко применяют пространственную диаграмму; обычно используют ее плоскую проекцию, полученную ортогональным проецированием при помощи перпендикуляров, опущенных из точек пространственной диаграммы на плоскость, параллельную основанию, причем вершину пирамиды состава, отвечающую воде (А), устанавливают на плоскость проекции. Такую плоскую диаграмму часто называют графиком (крестом) Левенгерца - Вант-Гоффа. На плоской проекции стороны квадрата не изображаются, а ребра пирамиды проецируются в виде диагоналей квадрата, которые вычерчиваются как координатные оси х, у. Насыщенные растворы чистых солей изображаются в виде точек на координатных осях (например, точка R2 - насыщенный раствор соли BX и т.д.).
Горизонтальная проекция четверной взаимной системы А+, В+ //X-, Y- - H2O показана на рис. 7. 2.
Так как ребра пирамиды наклонены к плоскости проекции под углом 45°, то проекции всех составляющих отрезков, выражающих содержание солей, будут одинаково уменьшены по длине в 2 раза и параллельны проекциям соответствующих ребер, т. е. диагоналям квадрата.
В том случае, когда необходимо иметь возможность изобразить содержание воды в системе, строят помимо горизонтальной также и вертикальную проекцию, проецируя геометрические элементы пирамиды и фигуративные точки пространственной диаграммы на плоскость, проходящую через вершину и два взаимопротивоположных ребра пирамиды (см. рис. 7. 3).
