
С.А. Мазунин, Г.С. Посягин ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА Часть 2. 1999г
..pdf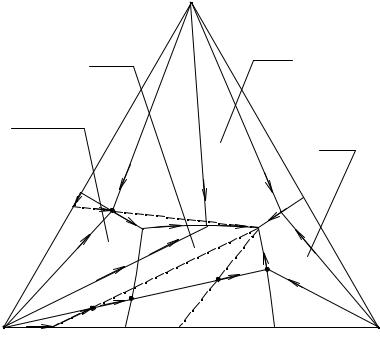
31
поле безводного А, удаляясь от p1 и приближаясь к М1. Суммарный солевой состав твердой фазы в это время находится в точке А.
C
L+A |
L+C |
|
L+A·nH2O
L+B
e3 |
O |
e2 |
O2 |
E |
|
P
M1 |
A |
M2 |
M |
p1 |
N |
|
|
|
||
|
|
|
|
|
p N2 |
e1 |
B |
Рис. 2. 7. Перспективная проекция диаграммы растворимости четверной системы с образованием обезвоживающегося кристаллогидрата
По достижении точки М1 начнется совместное выделение А и B, фигуративная точка раствора пойдет по линии е1Е от М1 к Е, а суммарный состав выделившейся твердой фазы - от А к М2.
Впоследней точке Е происходит окончательное высыхание раствора, причем выделяются совместно А, В и С эвтонического соотношения, точка твердой
фазы при этом перемещается от точки М2 до точки М.
Исходный раствор N находится в поле кристаллизации безводного компонента А на том же луче кристаллизации, что и точка М. При испарении этого раствора кристаллизоваться начнет сразу безводный А, солевой состав насыщенного
раствора будет изменяться по прямой от точки N до М1. В точке М1 совместно с А начинает кристаллизоваться компонент В, система становится моновариантной,
состав насыщенного раствора изменяется по линии двойного насыщения e1E от точки М1 до Е, суммарный состав твердой фазы - от точки А до N2.
Вточке Е происходит кристаллизация эвтонической смеси кристаллов А, В
иС, система в это время является нонвариантной, состав насыщенного раствора
остается постоянным, точка твердой фазы перемещается по прямой от точки N2 до
N.
Если исходный раствор задан точкой О, то при изотермическом испарении
начинается сразу совместная кристаллизация A·nH2O и С, солевой состав насыщенного раствора меняется по линии e3Р от точки О до точки Р, суммарный соле-
32
вой состав твердой фазы остается приблизительно неизменным и отвечает точке e3.
Вточке Р начинает протекать условно нонвариантная перитоническая ре-
акция: P(L)+ A·nH2O(S) → A(S) + C(S) (жидкость состава Р взаимодействует с твердым кристаллогидратом с образованием смеси кристаллов компонентов А и С). Реакция протекает до исчерпания кристаллогидрата, после чего раствор меняется по линии РЕ от одной точки до другой, а суммарный состав твердой фазы - по прямой от точки e3 до О2.
Вточке Е происходит кристаллизация эвтонической смеси кристаллов А, В
иС, система в это время является нонвариантной, состав насыщенного раствора
остается постоянным, точка твердой фазы перемещается по прямой от точки О2 до
О.
Решить вопрос о конгруэнтном характере точки Е и инконгруэнтном Р можно так же, как и при изучении диаграмм плавкости тройных систем. Так, в точке Е мы имеем раствор в равновесии с тремя твердыми фазами А, В и С; точка Е попадает в треугольник АВС - значит, процесс конгруэнтный. В точке Р раствор
находится в равновесии с твердыми фазами A·nH2O, А и С. Треугольник, образованный фигуративными точками этих фаз, на солевой проекции вырожден в отрезок АС, так как А является одновременно фигуративной точкой вещества А и про-
екцией A·nH2O. Точка Р оказывается вне этого отрезка - вырожденного треугольника, и процесс является инконгруэнтным.
C
L+V |
L+C |
|
L+A
L+B
e4 |
e3 |
E1 F E2
A |
e1 |
V |
e2 |
B |
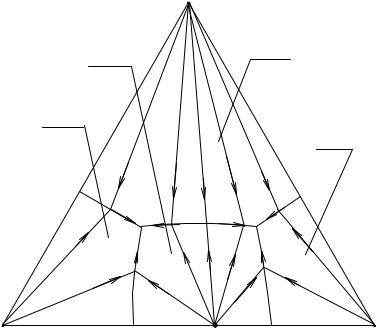
Рис. 2. 8. Перспективная проекция диаграммы растворимости четверной системы с образованием конгруэнтно растворимого химического соединения

33
Рассмотрим теперь случай, когда два вещества А и В дают соединение V (например, две соли образуют двойную соль). Это соединение может растворяться конгруэнтно или инконгруэнтно. На рис.2.8. изображена центральная проекция изотермической диаграммы растворимости в четверной системе, образованной тремя веществами А, В, С и растворителем D, когда вещества А и В образуют соединения V, растворяющееся конгруэнтно. В этом случае точка, отвечающая насыщенному раствору соединения V (а по свойству центральной проекции - и самому этому соединению), лежит в его поле е1Е1Е2е2 (на ребре АВ). Соединительная линия СV делит в этом случае проекцию диаграммы А-В-С на два треугольника АСV и ВСV, отвечающих системам А-С-V-D и B-C-V-D. Каждая из полученных вторичных диаграмм А-V-С и В-V-С вполне аналогична диаграмме для того случая, когда растворимые вещества не образуют соединения (рис. 2. 6).
На рис.2.8. изображены пути кристаллизации во всех полях нашей системы, причем стрелками указано направление движения фигуративных точек растворов при испарении. На диаграмме имеются две эвтоники Е1 и Е2, в которых происходит окончательное испарение раствора: в зависимости от положения фигуративной точки исходного раствора (в треугольнике АVС или треугольнике ВVС) испарение оканчивается в той или другой эвтонике. Кроме этих нонвариантных точек имеется еще третья - эвтоническая точка F тройной системы, образованной веществами V, С и растворителем D.
На рис. 2. 9 представлена принципиальная схема изотермической диаграммы растворимости A - B - C - D с образованием инконгруэнтно растворимого химического соединения V в тройной оконтуривающей системе А - В - D.
C
L+V |
L+C |
|
L+A
L+B
e3 |
e2 |
P N2 E
F


 N1
N1 




N |
M1 |
M N3 |
O |
A M2 V |
p O2 |
O1
e1 B
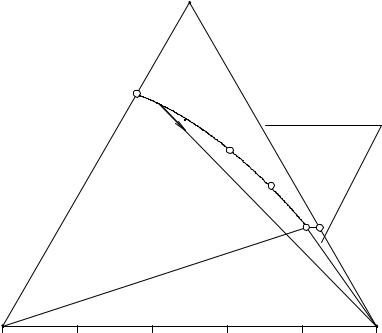
Рис. 2. 9. Перспективная проекция диаграммы растворимости четверной системы с образованием инконгруэнтно растворимого химического соединения
34
Вэтом случае точка, отвечающая составу соединения V, лежит вне его поля pPЕе1 (на ребре АВ). Соединительная линия СV делит проекцию диаграммы А -
В- С - D на два треугольника АСV и ВСV, отвечающих квазичетверным системам А - С - V - D и B - C - V - D. Эти четверные системы не являются изотермами простого эвтонического типа, что и подчеркивается в их названии.
На диаграмме также представлены Ae3Pp - поле кристаллизации компонента А, Be1Ee2 - поле кристаллизации В, Ce3PEe2 - поле кристаллизации компонента С, e3P - линия двойного насыщения относительно компонентов А и С, РЕ - линия двойного насыщения относительно С и V, e2E - линия двойного насыщения относительно В и С, e1E - линия двойного насыщения относительно В и V, pP - линия моновариантного инконгруэнтного превращения кристаллов компонента А в химическое соединение V, Е - конгруэнтная точка тройной кристаллизации компонентов V, В и С, Р - инконгруэнтная точка нонвариантного превращения кристаллов А в смесь V и С через жидкую фазу Р.
Изотермическое испарение растворов, лежащих в квазичетверной системе А - С - V - D, всегда заканчивается в точке Р, а в системе В - С - V - D - в точке Е.
Исходный раствор О находится в поле кристаллизации химического соединения V, а также в треугольнике ВСV, т.е. в системе В - С - V - D. При испарении этого раствора кристаллизация начнется с химического соединения V, соле-
вой состав насыщенного раствора будет изменяться по прямой VО1 от точки О до О1. В точке О1 совместно с V начинает кристаллизоваться компонент В, система становится моновариантной, состав насыщенного раствора изменяется по линии
двойного насыщения e1E от точки О1 до Е, суммарный состав твердой фазы - от точки V до О2.
Вточке Е происходит кристаллизация эвтонической смеси кристаллов V, В и С, система в это время является нонвариантной, состав насыщенного раствора
остается постоянным, точка твердой фазы перемещается по прямой от точки О2 до О и, когда суммарный состав твердой фазы попадает в точку О, исчезает последняя капля эвтонического раствора.
Исходный раствор M находится в поле кристаллизации безводного компонента А, а также в треугольнике AСV, т.е. в системе A - С - V - D. При испарении этого раствора кристаллизоваться начинает компонент А, солевой состав насы-
щенного раствора будет изменяться по прямой от точки М до М1, точка твердой фазы в это время находится в А.
Вточке М1 начинает протекать условно моновариантная перитоническая
реакция: L + A(S) → V(S) (жидкость взаимодействует с кристаллами А с образованием кристаллов химического соединения), состав жидкой фазы при этом меняется по кривой рР от точки М1 до точки Р, а суммарный состав твердой фазы меняется по прямой от А до М2.
В точке P заканчивается изменение жидкой фазы в процессе изотермического испарения нонвариантной инконгруэнтной перитонической фазовой реакцией: P(L)+ A (S) → V(S) + C(S) (жидкость состава Р взаимодействует с кристаллами А с образованием смеси кристаллов компонентов V и C), состав жидкой фазы при
35
этом остается постоянным (Р), а точка твердой фазы перемещается по прямой от точки М2 до М.
Исходный раствор N находится в поле кристаллизации компонента А на том же луче кристаллизации, что и точка М, но в треугольнике ВСV, т.е. в системе В - С - V - D. При испарении этого раствора кристаллизоваться начинает компонент А, солевой состав насыщенного раствора будет изменяться по прямой от точки N до М1, точка твердой фазы в это время находится в А.
Вточке М1 начинает протекать условно моновариантная перитоническая реакция: L + A(S) → V(S) (жидкость взаимодействует с кристаллами А с образованием кристаллов химического соединения), состав жидкой фазы при этом меняет-
ся по кривой рР от точки М1 до точки N1, а суммарный состав твердой фазы меняется по прямой от А до V.
После превращения последнего кристалла А в химическое соединение система вновь становится дивариантной, при дальнейшем испарении солевой состав
жидкой фазы изменяется по лучу VN2 от точки N1 до N2, точка твердой фазы при этом остается в V.
Вточке N2 раствор становится двояконасыщенным и из него выделяется смесь кристаллов компонентов V и С. Состав жидкой фазы меняется по кривой РЕ от точки N2 до Е, суммарный состав твердой фазы - по прямой от V до N3.
Вточке Е заканчивается изменение состава жидкой фазы, происходит совместная кристаллизация компонентов V, C и В. Точка твердой фазы при этом двигается по прямой от точки N3 до N.
3. ИЗОТЕРМА РАСТВОРИМОСТИ СИСТЕМЫ
NaCl - (C2H5)2NH2Cl - NH4Cl - H2O ПРИ 25°С
3.1. Растворимость в оконтуривающей системе NaCl - NH4Cl - H2O
Изотерма растворимости системы NaCl - NH4Cl - H2O хорошо изучена и описана в литературе. Сведения о растворимости изображены на рис. 3.1 и приведены в табл. 3.1.
На диаграмме растворимости имеются следующие поля: H2O-A-E1-B-H2O, отвечающее ненасыщенным растворам; NaCl-A-E1-NaCl и NH4Cl-B-E1-NH4Cl, соответствующие двухфазным равновесиям насыщенных растворов и кристаллов хлорида натрия и аммония соответственно; NaCl-E1-NH4Cl, являющееся полем нонвариантного равновесия эвтонического раствора, состав которого изображен точкой Е1, кристаллов хлорида натрия и аммония. Изотерма растворимости имеет простой эвтонический тип.
Порядок протекания процессов изотермического испарения и титрования для тройных водно-солевых систем простого эвтонического типа подробно рассмотрен ранее.
3.2. Растворимость в оконтуривающей системе
(C2H5)2NH2Cl - NH4Cl - H2O
Данные о растворимости в системе (C2H5)2NH2Cl - NH4Cl - H2O, получен-

36
ные автором экспериментально, изображены на рис. 3.2 и представлены в табл. 3.2.
H2O
L
L+NaCl(S) A
E1 |
L+NH4Cl(S)
B
E1(L)+NaCl(S)+NH4Cl(S)
0 |
20 |
40 |
60 |
80 |
100 |
NaCl |
|
|
% мас. |
|
NH4Cl |
Рис. 3. 1. Изотерма растворимости системы NaCl - NH4Cl - H2O при 25°С
Таблица 3. 1 Растворимость в системе NaCl - NH4Cl - H2O при 25°С
№ |
Состав насыщенного раствора, % мас. |
Твердая |
||
п/п |
NaCl |
NH4Cl |
H2O |
фаза |
1. |
26,4 |
0 |
73.6 |
NaCl |
2. |
23,2 |
5,7 |
71.1 |
- " - |
3. |
21,7 |
8,7 |
69.6 |
- " - |
4. |
19,5 |
12,7 |
67.8 |
- " - |
5. |
17,0 |
16,0 |
67.0 |
NaCl + NH4Cl |
6. |
10.7 |
20.6 |
68.7 |
NH4Cl |
7. |
5.4 |
24.5 |
70.1 |
- " - |
8. |
0 |
28.2 |
71.8 |
- " - |
На диаграмме растворимости имеются следующие поля: H2O-B-E2-C-H2O, отвечающее ненасыщенным растворам; (C2H5)2NH2Cl-C-E2-(C2H5)2NH2Cl и NH4Cl- B-E2-NH4Cl, соответствующие двухфазным равновесиям насыщенных растворов и кристаллов хлорида диэтиламмония и аммония соответственно; (C2H5)2NH2Cl-E2- NH4Cl, являющееся полем нонвариантного равновесия эвтонического раствора, состав которого изображен точкой Е2, кристаллов хлорида диэтиламмония и аммония. Изотерма растворимости имеет простой эвтонический тип.
37
H2O
B L
1
 L+(C2H5)2NH2Cl(S) 2
L+(C2H5)2NH2Cl(S) 2
L+NH4Cl(S) |
C |
E2 |
E2(L)+NH4Cl(S)+(C2H5)2NH2Cl(S)
0 |
20 |
40 |
60 |
80 |
100 |
NH4Cl |
|
|
% мас. |
(C2H5)2NH2Cl |
|
Рис. 3. 2. Изотерма растворимости системы (C2H5)2NH2Cl - NH4Cl - H2O при 25°С
Данная изотерма растворимости имеет одну существенную особенность. Если взять какой-либо раствор, насыщенный относительно хлорида аммония (точка 1, рис. 3.2), прибавить к нему некоторое количество кристаллов хлорида диэтиламмония, то получившаяся смесь окажется в поле кристаллизации хлорида аммония. В таких случаях говорят, что хлорид диэтиламмония "высаливает" хлорид аммония или что изотерма растворимости имеет эвтонический тип с явлением "высаливания".
Если бы ветвь кристаллизации хлорида аммония была вогнутой, то аналогичное действие привело бы полученную смесь в поле ненасыщенных растворов. В этом случае бы сказали, что происходит процесс "всаливания".
Если провести аналогичные построения в поле кристаллизации хлорида диэтиламмония, то легко убедиться в том, что хлорид аммония также высаливает хлорид диэтиламмония. В результате протекания процесса взаимного высаливания в составе двойного эвтонического раствора содержится больше воды, чем в насыщенном растворе хлорида диэтиламмония (см. табл. 3. 2). На диаграмме растворимости эти факты отображаются некоторой приподнятостью двойной эвтонической точки к вершине треугольника состава, отвечающей воде, по сравнению с точкой насыщенного раствора относительно хлорида диэтиламмония в двойной оконтуривающей системе (C2H5)2NH2Cl - Н2О.
Таблица 3. 2 Растворимость в системе NH4Cl - (C2H5)2NH2Cl - Н2О при 25°С
38
|
Плот- |
Состав насыщенного раствора, |
|
|||
№ |
ность, |
|
% мас. |
|
Твердая |
|
п/п |
г/мл |
NH4Cl |
Et2NH2Cl |
|
H2O |
фаза |
1 |
1.064 |
28.2 |
- |
|
71.8 |
NH4Cl |
2 |
1.052 |
19.5 |
16.6 |
|
63.9 |
-"- |
3 |
1.035 |
12.1 |
33.7 |
|
54.2 |
-"- |
4 |
1.023 |
6.5 |
50.2 |
|
43.3 |
-"- |
5 |
1.013 |
3.6 |
65.9 |
|
30.5 |
NH4Cl + (C2H5)2NH2Cl |
6 |
- |
- |
69.7 |
|
30.3 |
(C2H5)2NH2Cl |
3.3. Растворимость в оконтуривающей системе (C2H5)2NH2Cl - NaCl - H2O
Данные о растворимости в системе (C2H5)2NH2Cl - NaCl - H2O, полученные автором экспериментально, представлены в табл. 3. 3 и изображены на рис. 3. 3.
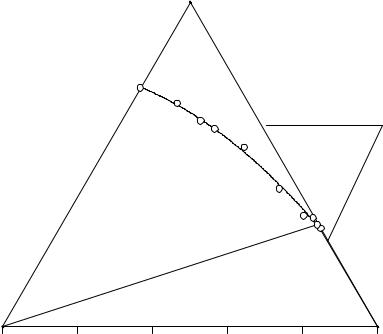
На диаграмме растворимости имеются следующие поля: H2O-A-E3-C-H2O, отвечающее ненасыщенным растворам; (C2H5)2NH2Cl-C-E-(C2H5)2NH2Cl и NaCl-A- E3-NaCl, соответствующие двухфазным равновесиям насыщенных растворов и кристаллов хлорида диэтиламмония и натрия соответственно; (C2H5)2NH2Cl-E3- NaCl, являющееся полем нонвариантного равновесия эвтонического раствора, состав которого изображен точкой Е3, кристаллов хлорида диэтиламмония и натрия. Изотерма растворимости имеет эвтонический тип с явлением взаимного высаливания хлорида натрия и хлорида диэтиламмония.
|
|
|
|
Таблица 3. 3 |
|
Растворимость в системе NaCl - (C2H5)2NH2Cl - Н2О при 25°С |
|||
|
|
|
|
|
№ |
Состав насыщенного раствора, % мас. |
Твердая |
||
п/п |
NaCl |
Et2NH2Cl |
H2O |
фаза |
1 |
0.0 |
69.7 |
30.3 |
(C2H5)2NH2Cl |
2 |
0.4 |
68.2 |
31.4 |
NaCl + (C2H5)2NH2Cl |
3 |
0.5 |
66.0 |
33.5 |
NaCl |
4 |
2.6 |
63.2 |
34.2 |
-"- |
5 |
5.0 |
52.5 |
42.5 |
-"- |
6 |
8.0 |
36.8 |
55.2 |
-"- |
7 |
13.0 |
26.1 |
60.9 |
-"- |
8 |
15.5 |
21.1 |
63.4 |
-"- |
9 |
19.0 |
12.2 |
68.8 |
-"- |
10 |
26.5 |
0 |
73.5 |
-"- |
39
H2O
A L
L+(C2H5)2NH2Cl(S)
L+NaCl(S) |
C |
|
E3 |
E3(L)+NaCl(S)+(C2H5)2NH2Cl(S)
0 |
20 |
40 |
60 |
80 |
100 |
NaCl |
|
|
% мас. |
(C2H5)2NH2Cl |
|
Рис. 3. 3. Изотерма растворимости системы (C2H5)2NH2Cl - NaCl - H2O при 25°С
3.4. Растворимость в системе (C2H5)2NH2Cl - NH4Cl - NaCl - H2O
Сведения о растворимости в четверной системе NaCl - (C2H5)2NH2Cl - NH4Cl - Н2О сведены в табл. 3.4. Изотерма растворимости четверной системы построена по результатам исследования растворимости в оконтуривающих системах, линий моновариантного равновесия и определения положения нонвариантных точек.
Таблица 3. 4 Растворимость в системе NaCl - NH4Cl - (C2H5)2NH2Cl - Н2О при 25°С
|
Плот- |
Состав насыщенного раствора, |
|
|||
№ |
ность, |
|
% мас. |
|
Твердая |
|
п/п |
г/мл |
NaCl |
NH4Cl |
Et2NH2Cl |
H2O |
фаза |
1 |
- |
0.4 |
- |
68.2 |
31.4 |
NaCl+(C2H5)2NH2Cl |
2 |
1.013 |
- |
3.6 |
65.9 |
30.5 |
NH4Cl+(C2H5)2NH2Cl |
3 |
1.017 |
0.3 |
3.2 |
65.9 |
30.6 |
NaCl+NH4Cl+(C2H5)2NH2Cl |
4 |
1.031 |
1.7 |
5.8 |
51.1 |
41.4 |
NaCl+NH4Cl |
5 |
1.053 |
4.0 |
8.1 |
38.9 |
49.0 |
-"- |
6 |
1.065 |
5.1 |
9.6 |
33.2 |
52.1 |
-"- |
7 |
1.082 |
7.1 |
10.7 |
26.6 |
55.6 |
-"- |
8 |
1.097 |
8.3 |
11.9 |
22.2 |
57.6 |
-"- |
9 |
1.121 |
10.7 |
13.6 |
14.8 |
60.9 |
-"- |
10 |
1.141 |
12.6 |
14.7 |
9.7 |
63.0 |
-"- |
11 |
1.170 |
17.0 |
16.0 |
- |
67.0 |
-"- |
40
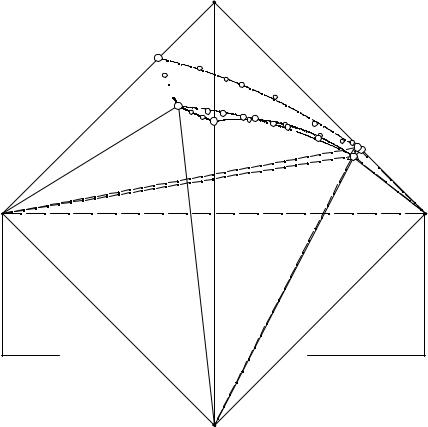
На рис. 3.4 представлена ортогональная проекция изотермы растворимости NaCl - NH4Cl - (C2H5)2NH2Cl - Н2О при 25°С на плоскость, параллельную двум перекрещивающимся сторонам тетраэдра состава.
H2O
A
 E1
E1
B |
E3 |
|
C |
|
E E2 |
NaCl |
(C2H5)2NH2Cl |
NH4Cl
Рис. 3. 4. Ортогональная проекция изотермы растворимости системы NaCl - NH4Cl - (C2H5)2NH2Cl - H2O при 25°С на плоскость, параллельную двум перекрещивающимся сторонам тетраэдра состава
На данной диаграмме имеются следующие фазовые области: H2O-A-E1-B-
E2-C-E3-E-E2-E-E1-H2O - объем ненасыщенных растворов; NaCl-A-E1-E-E3-A-NaCl - область двухфазного равновесия кристаллов хлорида натрия и насыщенных рас-
творов; NH4Cl-B-E1-E-E2-B-NH4Cl - объем двухфазного равновесия кристаллов хлорида аммония и насыщенных растворов; (C2H5)2NH2Cl-C-E2-E-E3-C- (C2H5)2NH2Cl - область двухфазного равновесия кристаллов хлорида диэтиламмония и насыщенных растворов; E1-NaCl-NH4Cl-E-E1 - объем трехфазного равновесия смеси кристаллов хлоридов натрия и аммония с насыщенными растворами; E2-(C2H5)2NH2Cl-NH4Cl-E-E2 - область трехфазного равновесия смеси кристаллов хлоридов диэтиламмония и аммония с насыщенными растворами; E3- (C2H5)2NH2Cl-NaCl-E-E3 - объем трехфазного равновесия смеси кристаллов хлоридов диэтиламмония и натрия с насыщенными растворами; (C2H5)2NH2Cl-NH4Cl- NaCl-E - область четырехфазного равновесия смеси кристаллов хлоридов диэтиламмония, аммония и натрия с эвтоническим раствором; A-E1-E-E3-A - поверх-
