
С.А. Мазунин, Г.С. Посягин ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА Часть 2. 1999г
..pdf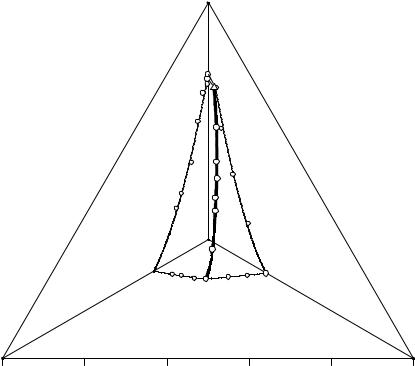
41
ность насыщенных растворов относительно хлорида натрия; B-E1-E-E2-B - поверхность насыщенных растворов относительно хлорида аммония; С-E2-E-E3-С - поверхность насыщенных растворов относительно хлорида диэтиламмония; E1-E, E2-E и E3-E линии двояконасыщенных растворов относительно хлоридов натрия и аммония, хлоридов аммония и диэтиламмония, хлоридов натрия и диэтиламмония соответственно; E - состав трояконасыщенного эвтонического раствора.
На рис. 3. 5 представлена ортогональная проекция изотермы растворимости системы NaCl-NH4Cl-(C2H5)2NH2Cl-H2O при 25°С на солевое основание.
(C2H5)2NH2Cl
C |
E2 |
E3 |
E |
|
 H2O
H2O

A 




 B
B
E1
0 |
20 |
40 |
60 |
80 |
100 |
NaCl |
|
|
% мас. |
|
NH4Cl |
Рис. 3. 5. Ортогональная проекция изотермы растворимости системы
NaCl - NH4Cl - (C2H5)2NH2Cl - H2O при 25°С
Данная диаграмма позволяет различить поля кристаллизации слагающих систему солей и выявить ход линий моновариантного равновесия: A-E1-E-E3-A- поле насыщенных растворов относительно хлорида натрия; B-E1-E-E2-B - поле насыщенных растворов относительно хлорида аммония; С-E2-E-E3-С - поле насыщенных растворов относительно хлорида диэтиламмония; E1-E, E2-E и E3-E - линии двояконасыщенных растворов относительно хлоридов натрия и аммония, хлоридов аммония и диэтиламмония, хлоридов натрия и диэтиламмония соответственно; E - состав тройного эвтонического раствора.
На рис. 3. 6 изображена перспективная проекция изотермы растворимости системы NaCl - NH4Cl - (C2H5)2NH2Cl - H2O при 25°С на солевое основание тетраэдра состава.

42
(C2H5)2NH2Cl |
|
E3 |
E2 |
L+(C2H5)2NH2Cl(S) E |
|
L+NaCl(S) L+NH4Cl(S)
|
|
|
|
|
|
E1 |
|
|
|
|
|
|
0 |
20 |
40 |
60 |
80 |
100 |
|||||||
NaCl |
|
|
|
|
% мас. |
|
|
|
|
NH4Cl |
||
Рис. 3. 6. Перспективная проекция изотермы растворимости системы
NaCl - NH4Cl - (C2H5)2NH2Cl - H2O при 25°С
На этой диаграмме, как и на рис. 3. 5, отображены лишь поля кристаллизации всех трех слагающих систему солей, ход линий моновариантного равновесия и солевые составы нонвариантных эвтонических растворов: NaCl-E1-E-E3-NaCl - поле насыщенных растворов относительно хлорида натрия; NH4Cl-E1-E-E2-NH4Cl - поле насыщенных растворов относительно хлорида аммония; (C2H5)2NH2Cl-E2- E-E3-(C2H5)2NH2Cl - поле насыщенных растворов относительно хлорида диэтиламмония; E1-E, E2-E и E3-E - линии двояконасыщенных растворов относительно хлоридов натрия и аммония, хлоридов аммония и диэтиламмония, хлоридов натрия и диэтиламмония соответственно; E - состав тройного эвтонического раствора.
Однако при сравнении данного рисунка с рис. 3.5 можно отметить, что поля кристаллизации солевых компонентов занимают значительно большую площадь диаграммы состава, а линии моновариантного равновесия гораздо протяженнее, на них лучше виден экспериментальный разброс. Именно этот способ представления экспериментальных данных о растворимости в четверных водносолевых системах наиболее часто применяется исследователями в настоящее время.
Изотерма растворимости системы NaCl - NH4Cl - (C2H5)2NH2Cl - H2O при 25°С имеет простой эвтонический тип. Расположение тройного эвтонического раствора четверной системы (Е) и двойных эвтонических растворов тройных оконтуривающих систем (Е1, Е2, Е3), а также ход линии двойного насыщения относительно хлоридов натрия и аммония на солевой проекции свидетельствует о
43
высоком высаливающем действии хлорида диэтиламмония на остальные солевые компоненты системы. Кроме того, хлорид натрия высаливается сильнее, чем хлорид аммония. Появление хлорида аммония в насыщенных растворах хлорида диэтиламмония оказывает дополнительное высаливающее действие на хлорид натрия.
4. ИЗОТЕРМА РАСТВОРИМОСТИ СИСТЕМЫ
KCl - Na2CO3 - K2CO3 - H2O ПРИ 20°С
Примером реальной изотермы растворимости с образованием конгруэнтно растворимого химического соединения может служить система KCl - Na2CO3 - K2CO3 - H2O при 20°С.
4. 1. Оконтуривающие системы
Справочные данные о растворимости в оконтуривающих системах сведены в табл. 4. 1. На рис. 4.1 представлена изотерма растворимости системы K2CO3 - Na2CO3 - H2O, которая имеет сложное строение.
Таблица 4. 1
Растворимость в системах K2CO3 - Na2CO3 - H2O, KCl - Na2CO3 - H2O, K2CO3 - KCl - H2O при 20°С
Состав насыщенного раствора, % мас. |
Твердая фаза |
|||
KCl |
K2CO3 |
Na2CO3 |
H2O |
|
|
|
Система |
K2CO3 - Na2 |
CO3 - H2O |
- |
0 |
17.8 |
82.2 |
Na2CO3·10H2O |
- |
16.0 |
18.7 |
65.3 |
- " - |
- |
17.2 |
19.2 |
63.6 |
Na2CO3·10H2O+NaKCO3·6H2O |
- |
13.9 |
22.5 |
63.6 |
NaKCO3·6H2O |
- |
15.3 |
21.1 |
63.6 |
- " - |
- |
17.4 |
19.0 |
63.6 |
- " - |
- |
33.6 |
7.6 |
58.8 |
- " - |
- |
48.2 |
3.6 |
48.2 |
- " - |
- |
47.1 |
3.0 |
49.9 |
NaKCO3·6H2O+K2CO3·1.5H2O |
- |
52.6 |
0 |
47.4 |
K2CO3·1.5H2O |
|
|
Система K2CO3 - KCl - H2O |
||
0.8 |
51.9 |
- |
|
KCl+K2CO3·1.5H2O |
25.6 |
0 |
- |
|
KCl |
|
|
Система KClNa2CO3 - H2O |
||
13.7 |
- |
24.0 |
|
KCl+Na2CO3·10H2O |
На изотерме растворимости системы K2CO3 - Na2CO3 - H2O имеется поле ненасыщенных растворов (H2OR1е1е2R2), поле кристаллизации полутораводного кристаллогидрата карбоната калия (K2CO3·1.5H2OR1е1), десятиводного карбоната натрия (Na2CO3·10H2OR2е2), конгруэнтно растворимого химического соединения (NaKCO3·6H2Oе1е2), поле совместной кристаллизации полутораводного кристаллогидрата карбоната калия (K2CO3·1.5H2Oе1NaKCO3·6H2O) и химического соеди-
44
нения, совместной кристаллизации десятиводного кристаллогидрата карбоната натрия и химического соединения (Na2CO3·10H2Oе2NaKCO3·6H2O), ветвь кристаллизации полутораводного кристаллогидрата карбоната калия (R1е1), химического соединения (е1е2), десятиводного карбоната натрия (R2е2), условно нонвариантный двояконасыщенный раствор относительно полутораводного кристаллогидрата карбоната калия и химического соединения (е1), химического соединения и десятиводного карбоната натрия (е2).
H2O Na2CO3·10H2O
KNaCO3·6H2O
K2CO3·1.5H2O
R1 е1
е1
R2
L
е2 |
e2(L)+KNaCO3·6H2O+ +Na2CO3·10H2O
 Na2CO3·10H2O
Na2CO3·10H2O
 KNaCO3·6H2O
KNaCO3·6H2O
K2CO3·1.5H2O |
e1(L)+KNaCO3·6H2O+ +K2CO3·1.5H2O
0 |
20 |
40 |
60 |
80 |
100 |
K2CO3 |
|
|
% мас. |
|
Na2CO3 |
Рис. 4. 1. Растворимость в системе K2CO3 - Na2CO3 - H2O при 20°С
Другие две оконтуривающие системы имеют изотермы растворимости простого эвтонического типа с образованием конгруэнтно растворимых кристаллогидратовNa2CO3·10H2O и K2CO3·1.5H2O не обезвоживающихся в присутствии второго солевого компонента. В справочной литературе приводятся лишь составы двойных эвтонических растворов этих систем при 20°С. Более подробные сведения о растворимости в этих системах обнаружить не удалось.
4. 2. Система KCl - Na2CO3 - K2CO3 - H2O
На рис. 4. 2 представлена центральная проекция изотермы растворимости системы KCl - Na2CO3 - K2CO3 - H2O при 20°С. Изотерма построена по справочным данным, представленным в табл. 4. 2.
Изображенная на рис. 4. 2 изотерма отличается от классической схемы, изложенной в разделе 2. 4, тем, что в системе KCl - Na2CO3 - K2CO3 - H2O при 20°С имеются кристаллогидраты карбонатов калия и натрия, причем десятиводный карбонат натрия обезвоживается, если в растворе присутствует смесь карбоната и хлорида калия, с образованием семиводного кристаллогидрата.
|
|
|
45 |
|
|
|
|
|
|
|
K2Cl2 |
|
|
|
|
|
|
|
|
Na2CO3·7H2O |
|||
K2CO3·1.5H2O |
|
|
|
|
|
||
|
|
|
KCl |
|
|
|
|
|
|
|
|
|
|
|
е3 |
|
|
|
е4 |
E2 |
|
P1 |
|
|
|
|
|
|
|
||
е5 |
E1 |
|
|
|
|
P2 |
|
|
|
|
Na2CO3·10H2O |
||||
|
|
|
|
|
|||
0 |
е1 |
20 |
V |
е2 |
80 |
100 |
|
|
40 % моль60 |
|
|
||||
K2CO3 |
|
K2CO3·Na2CO3·6H2O |
Na2CO3 |
||||
Рис. 4. 2. Перспективная проекция изотермы растворимости системы
KCl - Na2CO3 - K2CO3 - H2O при 20°С
В результате протекания процесса обезвоживания на изотерме растворимости появляется поле кристаллизации семиводного карбоната натрия, две переходные нонвариантные точки (Р1 и Р2) составов трояконасыщенных растворов относительно хлорида калия десятиводного карбоната натрия, семиводного карбоната натрия и шестиводного карбоната калия натрия, десятиводного карбоната натрия, семиводного карбоната натрия соответственно, появляется также моновариантная линия переходных растворов, участвующих в моновариантной фазовой реакции обезвоживания десятиводного карбоната натрия (Р1Р2). Состав раствора Р2 в справочнике не приводится, поэтому линия E2Р2 изображена пунктиром.
|
|
|
|
|
Таблица 4. 2 |
|
Растворимость в системе KCl - Na2CO3 - K2CO3 - H2O при 20°С |
||||
|
|
|
|
|
|
|
Жидкая фаза, индексы |
|
Твердая фаза |
||
2Na+ |
|
2Cl- |
|
H2O |
|
71.13 |
|
28.87 |
|
1084 |
Na2CO3·10H2O+KCl |
64.92 |
17.01 |
|
1044 |
Na2CO3·10H2O+KCl+Na2CO3·7H2O |
|
60.93 |
13.23 |
|
1007 |
KCl+Na2CO3·7H2O+KNaCO3·6H2O |
|
44.06 |
11.87 |
|
1006 |
KCl+KNaCO3·6H2O |
|
12.12 |
1.44 |
|
648 |
KCl+K2CO3·1.5H2O+KNaCO3·6H2O |
|
46
На изотерме также имеются поле кристаллизации (KCle5E1e4E2P1e3) хлорида калия, поле полутораводного карбоната калия (K2CO3e5E1e1), химического соединения (e1E1e4E2P2e2), десятиводного карбоната натрия (Na2CO3e2P2P1e3), линия двойного насыщения относительно полутораводного карбоната калия и хлорида калия (e5E1), двойного насыщения относительно шестиводного карбоната калия натрия и хлорида калия (E1e4E2), относительно семиводного карбоната натрия и хлорида калия (E2P1), относительно десятиводного карбоната натрия и хлорида калия (e3P1), полутораводного карбоната калия и шестиводного карбоната калия натрия (e1E1), десятиводного карбоната натрия и шестиводного карбоната калия натрия (e2Р2), семиводного карбоната натрия и шестиводного карбоната калия натрия (Е2Р2), имеются две конгруэнтные тройные эвтонические точки (Е1 и Е2), которым соответствуют трояконасыщенные растворы относительно полутораводного карбоната калия, химического соединения, хлорида калия и семиводного карбоната натрия, химического соединения, хлорида калия соответственно.
Тройная система KCl-KNaCO3·6H2O-H2O делит четверную систему на две самостоятельные простые четверные системы KCl-KNaCO3·6H2O-K2CO3-H2O и KCl-KNaCO3·6H2O-Na2CO3-H2O, каждая из которых имеет простой эвтонический тип и может изучаться самостоятельно.
5. ИЗОТЕРМА РАСТВОРИМОСТИ СИСТЕМЫ
NaCl - NaHCO3 - Na2CO3 - H2O ПРИ 25°С
Примером реальной изотермы растворимости с образованием инконгруэнтно растворимого химического соединения может служить система NaCl-Na2CO3- NaHCO3-H2O при 25°С.
5. 1. Тройные оконтуривающие системы
Справочные данные о растворимости в системах NaHCO3 - Na2CO3 - H2O, NaCl - Na2CO3 - H2O и экспериментальные о растворимости в системе NaHCO3 - NaCl -H2O при 25°С представлены в табл. 5.1 и изображены на рис. 5. 1-3.
На рис. 5.1 изображена изотерма растворимости тройной системы NaHCO3- Na2CO3 - H2O при 25°С с образованием инконгруэнтно растворимого химического соединения, называющегося "трона", имеющего состав NaHCO3·Na2CO3·2H2O и встречающегося в природе в самородном состоянии. С точки зрения правила фаз данная система является трехкомпонентной (пять составляющих систему веществ минус две реакции, их связывающих), но в отличие от систем с конгруэнтно растворимыми соединениями данная система не может быть разделена на две простые тройные системы.
Характерным признаком инконгруэнтной растворимости химического соединения (см. рис. 5. 1) является тот факт, что тройные точки системы e1 и p1 располагаются по одну сторону от луча, проведенного из вершины воды в состав химического соединения.
Изотерма растворимости имеет поле (Н2ОR2e1p1R1) ненасыщенных растворов, поле кристаллизации десятиводного карбоната натрия (Na2CO3·10H2OR2e1),
47
поле гидрокарбоната натрия (NaHCO3R1p1), поле кристаллизации двойного химического соединения (NaHCO3·Na2CO3·2H2Oe1p1), четыре трехфазные области:
NaHCO3·Na2CO3·2H2O+NaHCO3+p1(L); Na2CO3·10H2O + NaHCO3·Na2CO3·2H2O+ +e1(L); NaHCO3·Na2CO3·2H2O+NaHCO3+Na2CO3; Na2CO3+NaHCO3·Na2CO3·2H2O+ +Na2CO3·10H2O (две последние не имеют жидкой фазы).
Таблица 5. 1
Растворимость в системах NaHCO3 - Na2CO3 - H2O, NaCl - Na2CO3 - H2O, NaHCO3 - NaCl - H2O при 25°С
|
Жидкая фаза, % мас. |
|
Твердая фаза |
|||
NaHCO3 |
|
Na2CO3 |
NaCl |
|
H2O |
|
|
|
|
Система NaHCO3 - Na2CO3 - H2O |
|||
8.7 |
0.3 |
- |
|
91.0 |
NaHCO3 |
|
4.9 |
6.1 |
- |
|
89.0 |
- " - |
|
3.9 |
10.0 |
- |
|
86.1 |
- " - |
|
3.3 |
16.7 |
- |
|
80.0 |
- " - |
|
4.05 |
17.9 |
- |
|
78.05 |
NaHCO3 + NaHCO3·Na2CO3·2H2O |
|
2.5 |
20.8 |
- |
|
76.7 |
NaHCO3·Na2CO3·2H2O |
|
1.5 |
22.6 |
- |
|
75.9 |
NaHCO3·Na2CO3·2H2O+ Na2CO3·10H2O |
|
0 |
22.7 |
- |
|
77.3 |
Na2CO3·10H2O |
|
- |
0 |
Система NaCl - Na2CO3 - H2O |
||||
26.4 |
|
73.6 |
NaCl |
|||
- |
7.9 |
21.3 |
|
70.8 |
- " - |
|
- |
17.25 |
15.45 |
|
67.3 |
NaCl + Na2CO3·7H2O |
|
- |
18.4 |
13.0 |
|
68.6 |
Na2CO3·7H2O |
|
- |
19.0 |
11.8 |
|
69.2 |
Na2CO3·7H2O + Na2CO3·10H2O |
|
- |
18.8 |
10.8 |
|
70.4 |
Na2CO3·10H2O |
|
- |
19.6 |
5.6 |
|
74.8 |
- " - |
|
- |
22.7 |
0 |
|
77.3 |
- " - |
|
|
|
|
Система NaHCO3 - NaCl - H2O |
|||
8.7 |
0.3 |
0 |
|
91.0 |
NaHCO3 |
|
4.2 |
0.0 |
9.2 |
|
86.6 |
-"- |
|
2.6 |
0.0 |
14.4 |
|
83.0 |
-"- |
|
1.2 |
0.0 |
23.4 |
|
75.4 |
-"- |
|
0.9 |
0.1 |
25.8 |
|
73.2 |
NаНСО3+NaCl |
|
Исследование данной изотермы растворимости показало, что десятиводный кристаллогидрат карбоната натрия не обезвоживается в присутствии гидрокарбоната натрия и что в системе образуется инконгруэнтно растворимое химическое соединение.
Изотерма растворимости системы NaCl - Na2CO3 - H2O при 25°С, изображенная на рис. 5. 2, также имеет сложное строение. В системе протекает процесс обезвоживания десятиводного кристаллогидрата карбоната натрия с образованием семиводной соли, что отображается на изотерме растворимости появлением поля
|
|
|
48 |
|
|
кристаллизации семиводного карбоната натрия (Na2CO3·7H2Op2e2), трехфазной |
|||||
перитонической области превращения десятиводного кристаллогидрата в семи- |
|||||
водный карбонат натрия через жидкую фазу постоянного состава (p2), а также вет- |
|||||
ви кристаллизации семиводного карбоната натрия (p2e2) и перитонической точки |
|||||
(p2). |
|
|
|
|
|
|
|
L H2O L+NaHCO3·Na2CO3·2H2O |
|||
|
L+NaHCO3 R1 |
|
L+Na2CO3·10H2O |
||
p1(L)+NaHCO3·Na2CO3·2H2O+NaHCO3 |
R2 e1(L)+NaHCO3·Na2CO3·2H2O+Na2CO3·10H2O |
||||
|
|
|
|||
|
|
p1 |
e1 |
Na2CO3·10H2O |
|
|
|
|
|
||
|
|
NaHCO3·Na2CO3·2H2O |
|
||
0 |
20 |
40 |
60 |
80 |
100 |
NaHCO3 |
|
% мас. |
|
Na2CO3 |
|
Рис. 5. 1. Растворимость в системе NaHCO3 - Na2CO3 - H2O при 25°С |
|||||
H2O
Na2CO3·10H2O
R2
Na2CO3·7H2O


 p2
p2
Na2CO3·10H2O e2
R3NaCl+Na2CO3·7H2O
NaCl
Na2CO3·7H2O
Na2CO3·10H2O+Na2CO3·7H2O
0 |
20 |
40 |
60 |
80 |
100 |
Na2CO3 |
|
|
% мас. |
|
NaCl |
Рис. 5. 2. Растворимость в системе NaCl - Na2CO3 - H2O при 25°С
49
На изотерме растворимости данной системы также имеются поля ненасыщенных растворов (H2OR2p2e2R3), кристаллизации (Na2CO3·10H2OR2p2) десятиводного карбоната натрия, хлорида натрия (NaClR3e2) и трехфазная область совместного существования двойного эвтонического раствора с кристаллами хлорида натрия и семиводного карбоната натрия (NaCle2Na2CO3·7H2O). Часть системы, находящаяся ниже предельной ноды NaCl-Na2CO3·7H2O, не имеет жидкой фазы.
Изотерма растворимости системы NaHCO3 - NaCl - H2O при 25°С (рис. 5. 3) имеет простой эвтонический тип. Как показывают экспериментальные данные, представленные в табл. 5.1, в данной системе протекает процесс декарбонизации, приводящий к появлению в составах насыщенных растворов карбоната натрия. В связи с этим фактом возникает ряд вопросов о том, как изображать указанную изотерму, о вариантности фазовых равновесий в системе, и др. Ответы на эти вопросы будут даны ниже.
|
|
H2O |
|
|
|
|
|
R1 |
|
|
|
|
|
|
|
NaCl |
|
|
|
|
R3 |
|
|
|
|
|
e • |
|
|
|
|
|
3 |
|
|
|
|
NaHCO3 |
|
|
|
|
|
NaHCO3 |
+ NaCl |
|
|
0 |
20 |
40 |
60 |
80 |
100 |
NaHCO3 |
% мас. |
|
NaCl |
||
Рис. 5. 3. Растворимость в системе NaHCO3 - NaCl - H2O при 25°С
5. 2. Система NaCl - Na2CO3 - NaHCO3 - H2O
Справочные данные о растворимости в системе NaCl - Na2CO3 - NaHCO3 - H2O при 25°С сведены в табл. 5.2 и изображены на рис. 5. 4 в виде перспективной проекции на солевое основание тетраэдра состава.
Представленная изотерма растворимости отличается от описанной в п. 2. 4 принципиальной схемы тем, что в оконтуривающей системе NaCl - Na2CO3 - H2O происходит обезвоживание десятиводного кристаллогидрата карбоната натрия, а в тройной системе появляется перитоника и поле кристаллизации неустойчивого кристаллогидрата. На солевой проекции четверной системы данный процесс отображается появлением тройной перитоники (Р1), линии двойного насыщения относительно троны и десятиводного карбоната натрия (e1P1), двойного насыщения
50
относительно десятиводного и семиводного карбоната натрия (p2P1), поля кристаллизации неустойчивого десятиводного кристаллогидрата карбоната натрия
(Na2CO3e1P1p2).
Таблица 5. 2 Растворимость в системе NaCl - Na2CO3 - NaHCO3 - H2O при 25°С
Жидкая фаза, % мас. |
Твердая фаза |
|||
NaCl NaHCO3 |
Na2CO3 |
H2O |
||
- |
1.5 |
22.6 |
75.9 |
NaHCO3·Na2CO3·2H2O+Na2CO3·10H2O |
5.01 |
1.34 |
19.84 |
73.81 |
- " - |
11.09 |
0.76 |
18.99 |
69.16 |
- " - |
11.38 |
0.8 |
18.99 |
68.83 NaHCO3·Na2CO3·2H2O+Na2CO3·10H2O+Na2CO3·7H2O |
|
12.84 |
0.53 |
18.36 |
68.27 |
Na2CO3·7H2O+NaHCO3·Na2CO3·2H2O |
15.45 |
- |
17.25 |
67.3 |
NaCl + Na2CO3·7H2O |
15.28 |
0.34 |
17.28 |
67.1 |
NaCl+Na2CO3·7H2O+NaHCO3·Na2CO3·2H2O |
11.8 |
- |
19.0 |
69.2 |
Na2CO3·7H2O + Na2CO3·10H2O |
25.8 |
0.9 |
0.1 |
73.2 |
NаНСО3+NaCl |
21.35 |
0.53 |
7.28 |
70.84 |
NaCl+NaHCO3·Na2CO3·2H2O |
17.72 |
0.61 |
13.28 |
68.39 |
- " - |
23.97 |
1.38 |
2.55 |
72.1 |
NаНСО3+NaCl+NaHCO3·Na2CO3·2H2O |
15.04 |
1.95 |
6.65 |
76.36 |
NaHCO3 + NaHCO3·Na2CO3·2H2O |
7.57 |
2.90 |
11.35 |
78.18 |
- " - |
- |
4.05 |
17.9 |
78.05 |
- " - |
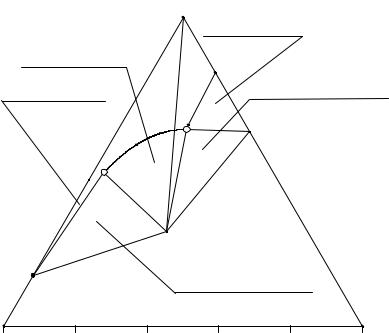
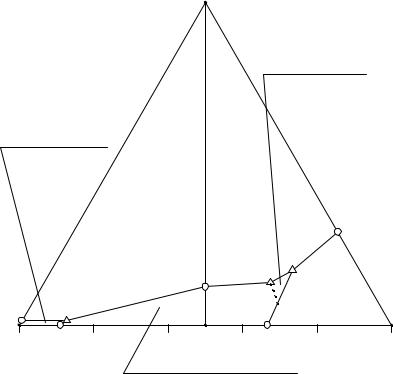
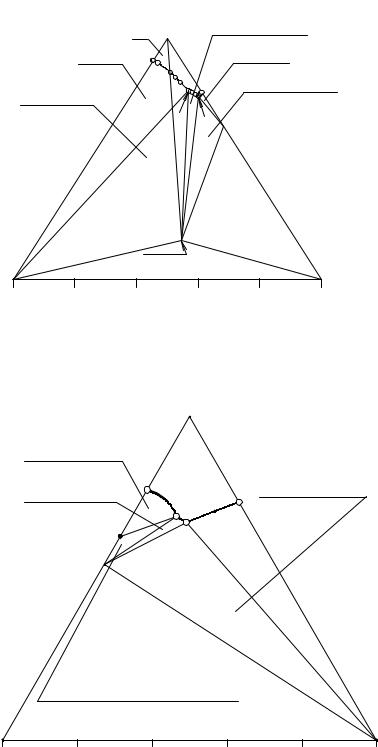
На солевой проекции изотермы растворимости четверной системы также имеются поле кристаллизации гидрокарбоната натрия (NaHCO3p1P2e3), поле хлорида натрия (NaCle2EP2e3), троны (p1e1P1EP2p1), поле кристаллизации семиводного карбоната натрия (p2P1Ee2), линия двойного насыщения относительно хлорида натрия и гидрокарбоната натрия (e3P2), троны и хлорида натрия (P2E), семиводного кристаллогидрата карбоната натрия и хлорида натрия (e2E), линия перитонического превращения (NaHCO3(S)+L → NaHCO3·Na2CO3·2H2O(S)) кристаллов гидрокарбоната натрия в трону (p1P2), тройная инконгруэнтная перитоническая точка (P2), тройная конгруэнтная эвтоническая точка (E).
На примере раствора М рассмотрим, как влияет появление дополнительных фазовых областей на процесс изотермического испарения. Точка М находится в поле кристаллизации гидрокарбоната натрия и в треугольнике V-NaCl-Na2CO3. Следовательно, кристаллизация начнется с появления кристаллов гидрокарбоната натрия, а закончится в точке Е совместным выделением в твердую фазу троны, хлорида натрия и семиводного кристаллогидрата карбоната натрия.
После появления первых кристаллов гидрокарбоната натрия солевая проекция насыщенного раствора будет двигаться по лучу NaHCO3-M от точки М до М1. В точке М1 начинается перитоническая реакция растворения кристаллов гидрокарбоната натрия в жидкой фазе и образование кристаллов троны. Состав жидкой фазы при этом меняется по линии p1P2 от точки М1 до точки М2, точка твер-
