
С.А. Мазунин, Г.С. Посягин ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА Часть 2. 1999г
..pdf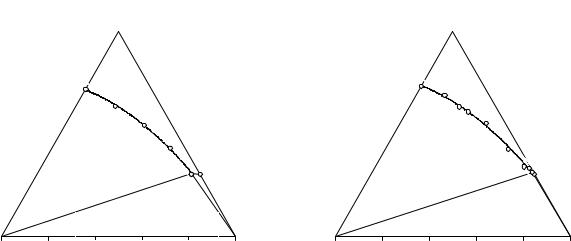
161
Растворимость в системе NH4Cl - (C2H5)2NH2Cl - Н2О при 25°С
№ |
Плот- |
Состав насыщенного раствора, |
|
||
|
ность |
|
% мас. |
|
Твердая |
п/п |
г/мл |
NH4Cl |
(C2H5)2NH2Cl |
H2O |
фаза |
1 |
1.064 |
28.2 |
- |
71.8 |
NH4Cl |
2 |
1.052 |
19.5 |
16.6 |
63.9 |
-"- |
3 |
1.035 |
12.1 |
33.7 |
54.2 |
-"- |
4 |
1.023 |
6.5 |
50.2 |
43.3 |
-"- |
5 |
1.013 |
3.6 |
65.9 |
30.5 |
NH4Cl + (C2H5)2NH2Cl |
6 |
- |
- |
69.7 |
30.3 |
(C2H5)2NH2Cl |
|
|
|
|
|
Таблица 13. 3 |
|
|
Растворимость в системе NaCl - (C2H5)2NH2Cl - Н2О при 25°С |
|||
№ |
Состав насыщенного раствора, % мас. |
Твердая |
|||
п/п |
NaCl |
(C2H5)2NH2Cl |
H2O |
фаза |
|
1 |
0.0 |
|
69.7 |
30.3 |
(C2H5)2NH2Cl |
2 |
0.4 |
68.2 |
31.4 |
NaCl + (C2H5)2NH2Cl |
|
3 |
0.5 |
66.0 |
33.5 |
NaCl |
|
4 |
2.6 |
63.2 |
34.2 |
-"- |
|
5 |
5.0 |
52.5 |
42.5 |
-"- |
|
6 |
8.0 |
36.8 |
55.2 |
-"- |
|
7 |
13.0 |
26.1 |
60.9 |
-"- |
|
8 |
15.5 |
21.1 |
63.4 |
-"- |
|
9 |
19.0 |
12.2 |
68.8 |
-"- |
|
10 |
26.5 |
0 |
73.5 |
-"- |
|
|
|
|
H2О |
|
H2O |
|
|
NH4Cl |
|
|
|
|
NaCl |
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
NH4Cl+(C2H5)2NH2Cl |
|
|
|
NaCl+(C2H5)2NH2Cl |
|
||||
0 |
20 |
40 |
60 |
80 |
100 |
0 |
20 |
40 |
60 |
80 |
100 |
NH4Cl |
|
|
% мас. |
(C2H5)2NH2Cl |
NaCl |
|
|
% мас. |
(C H ) NH Cl |
||
|
|
|
|
|
|
|
2 5 2 |
2 |
|||
Рис. 13. |
4. Изотерма растворимости сис- |
Рис. 13. |
5. Изотерма растворимости сис- |
||||||||
темы NH4Cl - C2H5)2NH2Cl - Н2О при 25°С |
темы NaCl - C2H5)2NH2Cl - Н2О при 25°С |
||||||||||
Обе изотермы этих тройных оконтуривающих систем имеют простой эвтонический тип.
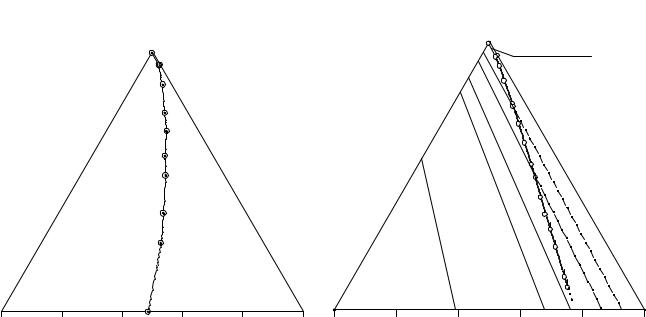
Сведения о растворимости в четверной системе NaCl - (C2H5)2NH2Cl - NH4Cl - Н2О (3) сведены в табл. 13. 4 и изображены на рис. 13. 6 в виде перспек-
162
тивной проекции на солевое основание тетраэдра состава. Изотерма растворимости системы 3 построена по результатам исследования растворимости в оконтуривающих системах, линий моновариантного равновесия и определения положения нонвариантных точек.
Таблица 13. 4 Растворимость в системе NaCl - NH4Cl - C2H5)2NH2Cl - Н2О при 25°С
№ |
Плот- |
Состав насыщенного раствора, % мас. |
|
Твердая |
|||
п/п |
ность, |
NaCl |
NH4Cl |
(C2H5)2NH2Cl |
H2O |
|
фаза |
|
г/мл |
|
|
|
|
|
|
1 |
- |
0.4 |
- |
68.2 |
31.4 |
NaCl+(C2H5)2NH2Cl |
|
2 |
1.013 |
- |
3.6 |
65.9 |
30.5 |
NH4Cl+(C2H5)2NH2Cl |
|
3 |
1.017 |
0.3 |
3.2 |
65.9 |
30.6 |
NaCl+NH4Cl+(C2H5)2NH2Cl |
|
4 |
1.031 |
1.7 |
5.8 |
51.1 |
41.4 |
|
NaCl+NH4Cl |
5 |
1.053 |
4.0 |
8.1 |
38.9 |
49.0 |
|
-"- |
6 |
1.065 |
5.1 |
9.6 |
33.2 |
52.1 |
|
-"- |
7 |
1.082 |
7.1 |
10.7 |
26.6 |
55.6 |
|
-"- |
8 |
1.097 |
8.3 |
11.9 |
22.2 |
57.6 |
|
-"- |
9 |
1.121 |
10.7 |
13.6 |
14.8 |
60.9 |
|
-"- |
10 |
1.141 |
12.6 |
14.7 |
9.7 |
63.0 |
|
-"- |
11 |
1.170 |
17.0 |
16.0 |
- |
67.0 |
|
-"- |
|
|
(C2H5)2NH2Cl |
|
|
(C2H5)2NH2Cl |
||
|
|
|
|
95 |
(C2H5)2NH2Cl |
||
|
|
|
|
|
|
||
|
|
|
|
|
|
90 |
|
|
|
|
|
|
|
80 |
|
|
|
|
|
|
|
70 |
|
UNa+0
|
NaCl |
|
|
NH4Cl |
|
|
NaHCO3 |
|
NH4Cl |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
20 |
40 |
60 |
80 |
100 |
0 |
20 |
U |
+ 0 |
60 |
70 80 90 |
95 |
|
Na 40 |
80 |
100 |
|||||||||
NaCl |
|
% мас. |
|
NH4Cl |
NaHCO3 |
|
|
% мас. |
|
NH4Cl |
||
|
Рис. 13. 6. Изотерма растворимости |
Рис. 13.7. Комбинированная проекция изо- |
||||||||||
|
системы NaCl-NH4Cl-C2H5)2NH2Cl-Н2О |
|
термы растворимости системы NH4Cl - |
|||||||||
|
|
при 25°С |
|
|
(C2H5)2NH2Cl - NaHCO3 - H2O при 25°С |
|||||||
Изотерма растворимости системы 3 имеет простой эвтонический тип. Выявлены поля кристаллизации всех трех слагающих систему солей. Расположение тройного эвтонического раствора четверной системы 3 и двойных эвтонических растворов тройных оконтуривающих систем, а также ход линии двойного насы-
163
щения относительно хлоридов натрия и аммония на солевой проекции свидетельствуют о высоком высаливающем действии хлорида диэтиламмония на остальные солевые компоненты системы. Кроме того, хлорид натрия высаливается сильнее, чем хлорид аммония. Появление хлорида аммония в насыщенных растворах хлорида диэтиламмония оказывает дополнительное высаливающее действие на хлорид натрия.
Получен следующий состав тройного эвтонического раствора, насыщенный относительно хлоридов натрия, аммония и диэтиламмония (% мас.): 0.34 - NaCl; 3.23 - NH4Cl; 65.92 - (C2H5)2NH2Cl; 30.51 - H2O.
13. 3. 2. Система (C2H5)2NH2Cl - NH4Cl - NaHCO3 - H2O (4)
Изотерма растворимости системы (4) построена по результатам изучения следующих тройных оконтуривающих систем:
(C2H5)2NH2Cl - NH4Cl - H2O,
(C2H5)2NH2Cl - NaHCO3 - H2O, NH4Cl - NaHCO3 - H2O,
а также ряда разрезов тетраэдра состава, позволяющих выявить линии моновариантных равновесий и положение нонвариантной точки.
Оконтуривающая тройная система (C2H5)2NH2Cl - NH4Cl - H2O описана в разд. 13. 3. 1, система (C2H5)2NH2Cl - NaHCO3 - H2O - в разд. 11. 3, а система NH4Cl - NaHCO3 - H2O - в разд. 12. 3. 5.
С целью изучения поверхности кристаллизации гидрокарбоната натрия исследовано пять разрезов системы 4: S1(12 % мас. - NH4Cl; 88 % мас. - (C2H5)2NH2Cl)
- NaHCO3 - Н2О; S2(21 % мас. - NH4Cl; 79 % мас. - (C2H5)2NH2Cl) - NaHCO3 - Н2О; S3(33 % мас. - NH4Cl; 67 % мас. - (C2H5)2NH2Cl) - NaHCO3 - Н2О; S4(51 % мас. - NH4Cl; 49 % мас. - (C2H5)2NH2Cl) - NaHCO3 - Н2О; S5(72 % мас. - NH4Cl; 28 % мас. -
(C2H5)2NH2Cl) - NaHCO3 - Н2О. Данные о растворимости в разрезах приведены в табл. 13. 5.
Система 4 является стабильным диагональным разрезом пятерной взаимной системы. Сведения о растворимости в ней в доступной нам литературе не обнаружены. Результаты исследований растворимости в системе 4 сведены в табл. 13. 6 и представлены на рис. 13. 7.
На изотерме растворимости системы 4 выявлены наиболее выраженное поле кристаллизации гидрокарбоната натрия, поле кристаллизации хлорида аммония, слабовыраженное поле кристаллизации хлорида диэтиламмония, что свидетельствует о сильном высаливающем действии его на гидрокарбонат натрия и хлорид аммония.
Изотерма растворимости простого эвтонического типа. Особенностью системы является отсутствие двойного эвтонического раствора в оконтуривающей системе NaHCO3 - NH4Cl - H2O и обрыв линии двойного насыщения относительно хлорида аммония и гидрокарбоната натрия, что объясняется протекающим в этой концентрационной области процессом декарбонизации. Определен состав тройного эвтонического раствора (% мас.): NаНСО3 - 0.6; NН4Сl - 3.3; (С2Н5)2NН2С1 - 65.5; Н2О - 30.6.
164
Таблица 13. 5 Составы насыщенных растворов на разрезах поверхности кристаллизации гидро-
карбоната натрия системы (C2H5)2NH2Cl - NH4Cl - NaHCO3 - H2O при 25°С
№ |
Плот- |
Состав насыщенного раствора, % мас. |
Твердая |
||||
п/п |
ность, |
NH4Cl |
Et2NH2Cl |
NaHCO3 |
Na2CO3 |
H2O |
фаза |
|
г/мл |
|
|
|
|
|
|
|
|
S1(NH |
4Cl - 12 % мас., (C2H5)2NH2Cl - 88 % мас.) - NaHCO3 - Н2О |
||||
1 |
1.032 |
6.8 |
48.5 |
1.0 |
0.3 |
43.4 |
NaHCO3 |
2 |
1.035 |
5.7 |
41.5 |
1.7 |
0.2 |
50.9 |
-”- |
3 |
1.039 |
5.0 |
34.8 |
2.3 |
0.3 |
57.6 |
-”- |
4 |
1.042 |
3.9 |
27.5 |
3.6 |
0.3 |
64.7 |
-”- |
5 |
1.045 |
2.9 |
20.4 |
4.7 |
0.3 |
71.7 |
-”- |
6 |
1.053 |
2.2 |
13.9 |
5.9 |
0.3 |
77.7 |
-”- |
7 |
1.059 |
1.1 |
7.1 |
7.3 |
0.4 |
84.1 |
-”- |
|
|
S2(NH4Cl - 21 % мас., (C2H5)2NH2Cl - 79 % мас.) - NaHCO3 - Н2О |
|||||
8 |
1.045 |
10.0 |
38.6 |
1.5 |
0.5 |
49.4 |
NaHCO3 |
9 |
1.047 |
6.5 |
25.6 |
3.3 |
0.5 |
64.1 |
-”- |
10 |
1.051 |
5.4 |
21.1 |
4.0 |
0.5 |
69.0 |
-”- |
11 |
1.052 |
4.7 |
18.1 |
5.0 |
0.4 |
71.8 |
-”- |
12 |
1.058 |
2.4 |
9.2 |
6.5 |
0.5 |
81.4 |
-”- |
|
|
S3(NH4Cl - 33 % мас., (C2H5)2NH2Cl - 67 % мас.) - NaHCO3 - Н2О |
|||||
13 |
1.06 |
13.7 |
28.3 |
2.0 |
0.9 |
55.1 |
NaHCO3 |
14 |
1.06 |
12.0 |
24.0 |
2.3 |
1.0 |
60.7 |
-”- |
15 |
1.061 |
9.8 |
20.2 |
3.1 |
0.8 |
66.1 |
-”- |
16 |
1.061 |
7.8 |
16.2 |
4.2 |
0.8 |
71.0 |
-”- |
17 |
1.062 |
5.9 |
12.4 |
5.8 |
0.5 |
75.4 |
-”- |
18 |
1.065 |
4.1 |
8.2 |
5.8 |
0.7 |
81.2 |
-”- |
19 |
1.065 |
2.2 |
4.2 |
7.7 |
0.5 |
85.4 |
-”- |
|
|
S4(NH4Cl - 51 % мас., (C2H5)2NH2Cl - 49 % мас.) - NaHCO3 - Н2О |
|||||
20 |
1.082 |
18.5 |
17.1 |
2.4 |
1.7 |
60.3 |
NaHCO3 |
21 |
1.078 |
15.6 |
14.7 |
2.9 |
1.6 |
65.2 |
-”- |
22 |
1.077 |
13.2 |
12.5 |
4.1 |
1.1 |
69.1 |
-”- |
23 |
1.074 |
8.5 |
7.0 |
5.7 |
1.1 |
77.7 |
-”- |
24 |
1.071 |
5.3 |
5.2 |
5.9 |
1.4 |
82.2 |
-”- |
25 |
1.068 |
3.0 |
2.8 |
7.5 |
0.7 |
86.0 |
-”- |
|
|
S5(NH4Cl - 72 % мас., (C2H5)2NH2Cl - 28 % мас.) - NaHCO3 - Н2О |
|||||
26 |
1.103 |
22.3 |
8.8 |
2.9 |
2.2 |
63.8 |
NaHCO3 |
27 |
1.094 |
18.6 |
9.1 |
3.6 |
1.9 |
66.8 |
-”- |
28 |
1.091 |
16.2 |
7.1 |
4.2 |
1.8 |
70.7 |
-”- |
29 |
1.092 |
13.1 |
5.6 |
4.5 |
2.0 |
74.8 |
-”- |
30 |
1.083 |
9.5 |
3.6 |
5.9 |
1.6 |
79.4 |
-”- |
Таблица 13. 6 Растворимость в системе NaHCO3 - (C2H5)2NH2Cl - NH4Cl - H2O при 25°С
№ |
Плот- |
Состав насыщенного раствора, % мас. |
Твердая |
||||
п/п |
ность, |
NH4Cl |
Et2NH2Cl |
NaHCO3 |
Na2CO3 |
H2O |
фаза |

165
г/мл
1. |
1.013 |
3.6 |
65.8 |
- |
- |
30.6 |
NH4Cl+ Et2NH2Cl |
2. |
1.011 |
0.0 |
68.6 |
0.5 |
0.0 |
30.9 |
NaHCO3+ Et2NH2Cl |
3. |
1.017 |
3.3 |
65.5 |
0.6 |
0.0 |
30.6 |
NaHCO3+ Et2NH2Cl+NH4Cl |
4. |
1.024 |
4.7 |
55.5 |
0.7 |
0.1 |
39.0 |
NaHCO3+NH4Cl |
5. |
1.032 |
6.8 |
48.5 |
1.0 |
0.3 |
43.4 |
-"- |
6. |
1.057 |
9.7 |
39.1 |
1.5 |
0.4 |
49.3 |
-"- |
7. |
1.045 |
10.0 |
38.6 |
1.5 |
0.5 |
49.4 |
-"- |
8. |
1.051 |
11.8 |
33.2 |
1.1 |
1.1 |
52.8 |
-"- |
9. |
1.060 |
13.7 |
28.3 |
2.0 |
0.9 |
55.1 |
-"- |
10. |
1.069 |
15.8 |
23.4 |
2.1 |
1.2 |
57.5 |
-"- |
11. |
1.073 |
16.8 |
20.7 |
2.2 |
1.4 |
58.9 |
-"- |
12. |
1.082 |
18.5 |
17.1 |
2.4 |
1.7 |
60.3 |
-"- |
13. |
1.088 |
19.8 |
14.1 |
3.1 |
1.6 |
61.4 |
-"- |
14. |
1.094 |
21.1 |
11.6 |
2.4 |
2.2 |
62.7 |
-"- |
15. |
1.103 |
22.3 |
8.8 |
2.9 |
2.2 |
63.8 |
-"- |
16. |
1.114 |
24.4 |
4.4 |
3.1 |
2.5 |
65.6 |
-"- |
17. |
1.118 |
25.1 |
3.0 |
3.3 |
2.5 |
66.1 |
-"- |
Относительное расположение сетки изолиний коэффициента использования ионов натрия и линии двойного насыщения относительно хлорида аммония и гидрокарбоната натрия свидетельствует о медленном увеличении максимального равновесного коэффициента использования ионов натрия по мере увеличения содержания диэтиламина в исходной реакционной смеси.
13. 3. 3. Система NаСl - NаНСО3 - NН4Сl - (С2Н5)2NН2С1 - Н2О
Изотерма растворимости пятерной системы построена по результатам изучения оконтуривающих систем и разрезов солевого тетраэдра состава, позволяющих выявить линии моновариантного равновесия и положение нонвариантной точки.
Данные о растворимости в пятерной системе изображены на рис. 13. 8 в виде комбинированной проекции на солевой тетраэдр состава и приведены в табл. 13. 7.
Заглавными буквами на рис. 13. 8 обозначены четырех- и пятифазные эвтонические точки системы с индексами солевых компонентов, находящихся в твердой фазе. Сплошными линиями проведены границы полей, лежащих на видимых гранях солевого тетраэдра состава (NаСl - NаНСО3 - (С2Н5)2NН2С1 и NаСl - NаНСО3 - NН4Сl), штриховой - на невидимых гранях (NН4Сl - (С2Н5)2NH2С1 - NаСl и NаНСО3 - (С2Н5)2NH2С1NН4Сl), штрихпунктирной линией обозначены моновариантные линии внутри солевого тетраэдра, содержание продуктов декарбонизации в насыщенных растворах на линии тройного насыщения относительно гидрокарбоната натрия, хлоридов натрия и аммония - вертикальными штрихами.

166
NaHCO3(4)
Et2NH2Cl(1) |
e14 |
e13E134 |
|
e12 E |
|
EE |
|
|
|
||
|
124 |
123 |
|
NH4Cl(3)
E234
e23
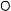 e24
e24
NaCl(2)
Рис. 13. 8. Комбинированная проекция изотермы растворимости системы NаСl - NаНСО3 - NН4Сl - (С2Н5)2NН2С1 - Н2О при 25°С
На изотерме растворимости пятерной системы объем кристаллизации гидрокарбоната натрия занимает подавляющую часть солевого тетраэдра состава, объем кристаллизации хлорида диэтиламмония практически вырожден в линию, кроме того имеются объемы кристаллизации хлоридов аммония и натрия.
Поверхности двояконасыщенных растворов относительно гидрокарбоната натрия и хлорида диэтиламмония, гидрокарбоната натрия и хлорида натрия, гидрокарбоната натрия и хлорида аммония, хлорида диэтиламмония и хлорида натрия, хлорида натрия и хлорида аммония, хлорида диэтиламмония и хлорида аммония разделяют соответствующие объемы кристаллизации одной соли.
Растворы, насыщенные относительно трех солей, находятся на линиях моновариантного равновесия: ЕЕ123; ЕЕ124; ЕЕ134; ЕЕ234. Линия моновариантных равновесий насыщенных растворов с кристаллами гидрокарбоната натрия, хлоридами аммония и натрия (ЕЕ234) является наиболее протяженной. Определен состав четверного эвтонического раствора насыщенного всеми четырьмя солевыми ком-
понентами (% мас.): NаСl - 0.33; NаНСО3 - 0.04; NН4Сl - 3.38; (С2Н5)2NН2С1 - 65.70; Н2О - 30.55, что свидетельствует о правильной триангуляции пятерной взаимной системы.
На рис. 13. 9 представлен в увеличенном масштабе угол солевой проекции, отвечающий хлориду диэтиламмония.
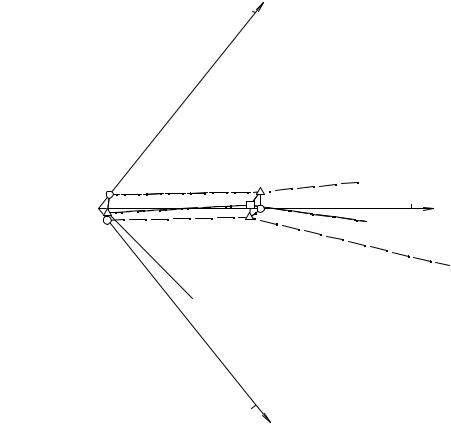
167
NaHCO3 10 % мас.
|
|
e14 |
E E134 |
Et NH Cl |
E124 |
e13 |
|
2 |
2 |
E123 |
|
|
|
e12 |
|
NH4Cl
10 % мас.
10 % мас.
NaCl
Рис. 13. 9. Объем кристаллизации хлорида диэтиламмония комбинированной проекции изотермы растворимости системы NаСl - NH4Cl - NаНСО3 - (C2H5)2NH2Cl - Н2О при 25°С в увеличенном масштабе
13. 4. Пятерная система NН4НСО3 - NаНСО3 - NН4С1 - (С2Н5)2NН2С1 - Н2О
Данная пятерная водно-солевая система имеет следующие оконтуривающие четверные системы:
4.(C2H5)2NH2Cl - NH4Cl - NaHCO3 - H2O,
5.NН4НСО3 - NаНСО3 - NН4С1 - Н2О,
6.NН4НСО3 - NН4С1 - (С2Н5)2NН2С1 - Н2О,
7.NН4НСО3 - NаНСО3 - (С2Н5)2NН2С1 - Н2О.
Системы (4) и (5) описаны выше. Данных о растворимости в двух других системах в доступных нам литературных источниках не обнаружено. Изотермы растворимости систем (6) и (7) изучались экспериментально.
13. 4. 1. Система NН4НСО3 - NH4Cl - (С2Н5)2NН2С1 - Н2О (6)
Изотермы растворимости тройных оконтуривающих систем NH4Cl -
NН4НСО3 - Н2О и NH4Cl - (С2Н5)2NН2С1 - Н2О описаны выше в разд. 12. 3. 12. 2 и 13.3.1 соответственно. Данных о растворимости в системе (С2Н5)2NН2С1 -
NН4НСО3 - Н2О в доступных нам литературных источниках не обнаружено. Составы насыщенных растворов и равновесных им твердых фаз, полученные в экспериментах, приведены в табл. 13. 8 и изображены на рис. 13. 10 в виде комбинированной проекции. В данной тройной системе в значительной мере протекает
168
процесс декарбонизации, в результате чего в насыщенных растворах появляются карбонат диэтиламмония и хлорид аммония.
Таблица 13. 7 Растворимость в системе NаСl - NH4Cl - NаНСО3 - (C2H5)2NH2Cl - Н2О при 25°С
|
Плот- |
Состав насыщенного раствора, % мас. |
Твердая |
|||||
№ |
ность, |
NaCl |
NH4Cl |
Et2NH2Cl |
NaHCO3 |
Na2CO3 |
H2O |
|
п/п |
г/мл |
|
|
|
|
|
|
фаза |
1. |
1.013 |
- |
3.6 |
65.8 |
- |
- |
30.6 |
NН4С1+ Et2NH2Cl |
2. |
1.011 |
- |
- |
68.6 |
0.5 |
0.0 |
30.9 |
NаНСО3+Et2NH2Cl |
3. |
1.017 |
- |
3.3 |
65.5 |
0.6 |
0.0 |
30.6 |
NаНСО3+NН4С1+Et2NH2Cl |
4. |
- |
0.4 |
- |
68.1 |
- |
- |
31.5 |
NaCl +Et2NH2Cl |
5. |
1.017 |
0.3 |
3.2 |
65.9 |
- |
- |
30.6 |
NaCl +NН4С1+Et2NH2Cl |
6. |
1.17 |
17.0 |
16.0 |
- |
- |
- |
67.0 |
NaCl + NН4С1 |
7. |
- |
0.4 |
- |
68.4 |
0.04 |
0.0 |
31.16 |
NaCl+NаНСО3+ Et2NHCl |
8. |
1.187 |
25.8 |
- |
- |
0.9 |
0.1 |
73.2 |
NaCl+NаНСО3 |
9. |
1.014 |
0.3 |
3.4 |
65.7 |
0.04 |
0.0 |
30.56 |
NaHCO3+NaCl+NH4Cl+Et2NH2Cl |
10. 1.025 |
0.6 |
4.7 |
56.3 |
0.4 |
0.1 |
37.9 |
NaHCO3+NaCl+NH4Cl |
|
11. 1.035 |
1.3 |
5.9 |
50.6 |
0.4 |
0.1 |
41.7 |
-"- |
|
12. 1.063 |
4.0 |
8.5 |
37.4 |
0.6 |
0.1 |
49.4 |
-"- |
|
13. 1.078 |
6.2 |
10.5 |
28.3 |
0.5 |
0.2 |
54.3 |
-"- |
|
14. 1.112 |
8.7 |
12.6 |
19.3 |
0.8 |
0.1 |
58.5 |
-"- |
|
15. 1.134 |
12.0 |
14.2 |
10.5 |
0.4 |
0.5 |
62.4 |
-"- |
|
16. 1.167 |
14.8 |
17.4 |
- |
1.0 |
0.4 |
66.4 |
-"- |
|
|
|
|
|
|
|
|
|
|
Таблица 13. 8 |
|
Растворимость в системе NH4HCO3 - (С2Н5)2NН2С1 - Н2О при 25°С |
||||||||
№ |
Плот- |
Состав насыщенного раствора, % мас. |
|
Твердая |
|||||
п/п |
ность, |
NH4HCO3 |
NH4Cl |
(Et2NH2)2 |
(NH4)2 |
Et2NH2 |
|
H2O |
фаза |
|
г/мл |
|
|
CO3 |
CO3 |
Cl |
|
|
|
1. |
- |
14.3 |
- |
- |
4.7 |
- |
|
81.0 |
NH4HCO3 |
2. |
1.062 |
11.2 |
3.8 |
7.2 |
- |
4.3 |
|
73.5 |
-"- |
3. |
1.05 |
9.9 |
2.0 |
3.6 |
- |
21.4 |
|
63.1 |
-"- |
4. |
1.037 |
6.5 |
1.6 |
3.7 |
- |
36.3 |
|
51.9 |
-"- |
5. |
1.029 |
3.1 |
2.7 |
2.9 |
- |
47.2 |
|
44.1 |
-"- |
6. |
1.021 |
3.7 |
1.0 |
2.0 |
- |
64.7 |
|
28.6 |
NH4HCO3+Et2NН2С1 |
7. |
- |
- |
- |
- |
- |
69.7 |
|
30.3 |
(С2Н5)2NН2С1 |
После исследования тройных оконтуривающих систем изучались разрезы четверной системы 6, позволяющие выявить ход линий моновариантных равновесий и положение нонвариантных точек. Данные о растворимости в четверной системе 6 сведены в табл. 13. 9 и изображены в виде комбинированной проекции на рис. 13. 11.
Таблица 13. 9 Растворимость в системе NН4НСО3-NН4Сl-(С2Н5)2NН2С1-Н2О при 25°С
169
|
Плот- |
|
Состав насыщенного раствора, % мас. |
|
Твердая |
||||
№ |
ность, |
(Et)2NH2 |
NH4Cl |
NH4HCO3 |
(NH4)2CO3 |
[(Et)2NH2]2 |
H2O |
фаза |
|
п/п |
г/мл |
Cl |
|
|
|
|
CO3 |
|
|
1 |
1.093 |
- |
|
25.9 |
4.7 |
1.8 |
- |
67.6 |
NH4HCO3 + NH4Cl |
2 |
1.079 |
2.6 |
24.3 |
3.1 |
0.0 |
4.7 |
65.3 |
- " - |
|
3 |
1.064 |
12.7 |
19.5 |
2.8 |
0.0 |
3.8 |
61.2 |
- " - |
|
4 |
1.055 |
21.9 |
15.4 |
2.7 |
0.0 |
3.0 |
57.0 |
- " - |
|
5 |
1.043 |
31.6 |
11.4 |
2.4 |
0.0 |
2.6 |
52.0 |
- " - |
|
6 |
1.036 |
40.1 |
8.6 |
2.2 |
0.0 |
2.5 |
46.6 |
- " - |
|
7 |
1.032 |
49.4 |
5.7 |
2.4 |
0.0 |
2.0 |
40.5 |
- " - |
|
8 |
1.02 |
63.3 |
2.1 |
2.7 |
0.0 |
2.3 |
29.6 |
NH4HCO3+NH4Cl+Et2NH2Cl |
|
9 |
1.013 |
65.8 |
3.6 |
0.0 |
0.0 |
0.0 |
30.6 |
NH4Cl +Et2NH2Cl |
|
10 |
1.021 |
64.8 |
1.0 |
3.7 |
0.0 |
1.9 |
28.6 |
NH4HCO3+Et2NH2Cl |
|
Изотерма растворимости системы 6 имеет простой эвтонический тип. Выявлены поля кристаллизации всех трех слагающих систему солей. Расположение тройного эвтонического раствора четверной системы 6 и двойных эвтонических растворов тройных оконтуривающих систем, а также ход линии двойного насыщения относительно хлорида и гидрокарбоната аммония на солевой проекции свидетельствует о высоком высаливающем действии хлорида диэтиламмония на остальные солевые компоненты системы. Кроме того, гидрокарбонат аммония высаливается сильнее, чем хлорид аммония. Появление хлорида аммония в насыщенных растворах хлорида диэтиламмония оказывает дополнительное высаливающее действие на гидрокарбонат аммония.
Получен следующий состав тройного эвтонического раствора, насыщенный относительно хлоридов аммония, диэтиламмония и гидрокарбоната аммония
(% мас.): 2.7-NH4HCO3; 63.3-(C2H5)2NH2Cl; 2.1-NH4Cl; 2.3-[(C2H5)2NH2]2CO3; 29.6 - H2O.
13. 4. 2. Система NН4НСО3 - NаНСО3 - (С2Н5)2NН2С1 - Н2О (7)
Изотермы растворимости тройных оконтуривающих систем NН4НСО3 -
NаНСО3-Н2О и NН4НСО3-(С2Н5)2NН2С1-Н2О описаны выше, в разд. 12.3.3 и 13.4.1 соответственно. Растворимость в системе NаНСО3 - (С2Н5)2NН2С1 - Н2О при 25°С
описана в литературе.
После исследования тройных оконтуривающих систем изучались разрезы четверной системы 7, позволяющие выявить ход линий моновариантных равновесий и положение нонвариантных точек, а также исследовать поверхность кристаллизации гидрокарбоната натрия.
Данные о растворимости в разрезах NaHCO3 - S1(7 % мас. - NН4НСО3; 93 %
мас. - (С2Н5)2NН2Сl ) - H2O и NaHCO3 - S2(12 % мас. - NН4НСО3; 88 % мас. - (С2Н5)2NН2Сl) - H2O, а также в четверной системе (7) сведены в табл. 13.10-13.12
и изображены в виде комбинированных проекций на рис. 13.12-13.14 соответственно.
170
NH4HCO3
H2O
|
|
|
|
|
NH4HCO3 |
|
|
(C2H5)2NH2Cl |
|
|
|
|
|
NH4HCO3 |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(C2H5)2NH2Cl |
|
|
|
|
|
|
NH4HCO3+(C2H5)2NH2Cl |
|
|
|
|
|
|
NH4Cl |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
20 |
40 |
60 |
80 |
100 |
|
0 |
20 |
|
40 |
% мас. |
60 |
80 |
100 |
|||||||||||||||
NH4HCO3 |
|
|
% мас. |
(C2H5)2NH2Cl |
|
NH4Cl |
|
|
|
|
(C2H5)2NH2Cl |
||||||||||||||||||
Рис. 13. 10. Комбинированная проекция |
Рис. 13. 11. Комбинированная проекция |
||||||||||||||||||||||||||||
|
|
изотермы растворимости системы |
|
|
изотермы растворимости системы |
||||||||||||||||||||||||
NH4HCO3-(С2Н5)2NН2С1-Н2О при 25°С |
NН4Сl-NН4НСО3-(С2Н5)2NН2С1-Н2О (6) |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
при 25°С |
Таблица 13. 10 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
Растворимость в разрезе NaHCO3 - S1(7 % мас. - NН4НСО3; 93 % мас. - |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
(С2Н5)2NН2Сl) - H2O при 25°С |
|
|
|
|
|
|
|
|
||||||||||||
№ |
Плот- |
|
|
|
Состав насыщенного раствора, % мас. |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
ность, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Твердая |
||||
п/п |
г/мл |
|
Et2NH2 |
NaHCO3 |
NH4HCO3 |
|
NH4Cl |
|
|
[Et2NH2]2 |
|
H2O |
|
|
|
|
фаза |
||||||||||||
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
CO3 |
|
|
|
|
|
|
|
|
|
|
|
||
1. |
|
- |
|
|
18.6 |
|
4.4 |
|
|
1.3 |
|
|
0.4 |
|
|
0.7 |
|
|
74.6 |
|
|
|
NaHCO3 |
||||||
2. |
|
1.028 |
|
|
38.5 |
|
1.2 |
|
|
2.9 |
|
|
0.1 |
|
|
0.8 |
|
|
56.5 |
|
|
|
|
|
-"- |
|
|||
3. |
|
1.026 |
|
|
47.0 |
|
0.6 |
|
|
3.1 |
|
|
0.4 |
|
|
1.0 |
|
|
47.9 |
|
|
|
|
|
-"- |
|
|||
4. |
|
1.025 |
|
|
54.1 |
|
0.3 |
|
|
3.4 |
|
|
0.7 |
|
|
1.5 |
|
|
40.0 |
|
|
|
|
|
-"- |
|
|||
На изотермах растворимости разрезов, приведенных на рис. 13.12-13.13, подавляющую часть треугольника состава занимают поля кристаллизации гидрокарбоната натрия. Ветви насыщенных растворов относительно этой соли вплотную примыкают к стороне треугольника состава, отвечающей условной двойной системе смесь гидрокарбоната аммония и хлорида диэтиламмония - вода, что свидетельствует о высоком высаливающем действии этих смесей на гидрокарбонат натрия. Рисунки наглядно показывают, что степень декарбонизации выше в растворах, содержащих большее количество гидрокарбоната аммония.
Приведенные в табл. 13.10-13.12 результаты исследований доказывают, что в системе 7 в значительной степени протекает процесс декарбонизации, в результате в составах насыщенных растворов системы появляются хлорид аммония и карбонат диэтиламмония. Этим фактом объясняется повышенный разброс экспериментальных данных на линии двойного насыщения относительно гидрокарбонатов натрия и аммония (рис. 13. 14).
Таблица 13. 11
