
С.А. Мазунин, Г.С. Посягин ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА Часть 2. 1999г
..pdf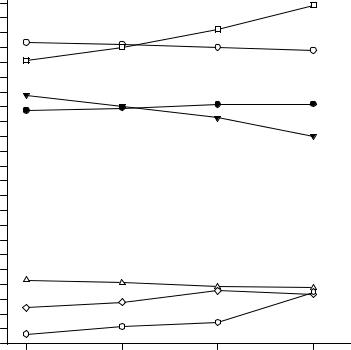
|
|
|
|
151 |
|
|
н.д., % |
|
|
|
+ |
|
|
115 |
|
|
|
|
NH4 |
|
110 |
Cl- |
|
|
|
|
|
105 |
|
|
|
Cl- |
|
|
100 |
|
|
|
|
|
|
95 |
NH + |
|
|
|
|
|
90 |
U |
+ |
|
|
|
|
85 |
4 |
|
|
|
||
|
NH4 |
|
|
|
|
|
80 |
|
|
|
|
UNa+ |
|
75 |
UNa+ |
|
|
|
|
|
|
|
|
|
|
||
70 |
|
|
|
|
UNH4+ |
|
65 |
|
|
|
|
|
|
60 |
|
|
|
|
|
|
55 |
|
|
|
|
|
|
50 |
|
|
|
|
|
|
45 |
|
|
|
|
|
|
40 |
|
|
|
|
|
|
35 |
|
|
|
|
|
|
30 |
Na+ |
|
|
|
Na+ |
|
25 |
|
|
|
|
||
20 |
|
- |
|
|
CO32- |
|
15 |
HCO3 |
|
|
HCO |
- |
|
10 |
2- |
|
|
|
3 |
|
5 |
CO3 |
|
|
|
|
|
0 |
|
|
|
|
30 t, °C |
|
|
15 |
|
20 |
25 |
||
Рис. 12. 21. Вычисленные составов двояконасыщенных растворов относительно гидрокарбонатов натрия и аммония, коэффициенты использования ионов натрия и аммония этих растворов при получении гидрокарбоната натрия из рассола, содержащего 305 г/л хлорида натрия
Так, рассчитав отношение концентраций ионов натрия к гидрокарбонатионам по данным табл. 12. 7, получаем следующий ряд значений в соответствии с увеличением температуры: 1.76; 1.47; 1.07; 1.14. Приведенный ряд отношений показывает, что оптимальная температура проведения процесса получения гидрокарбоната натрия из рассола хлорида натрия, содержащего 305 г/л соли, в лабораторном реакторе находится между 20 и 25°С.
Используя идеальное соотношение концентраций ионов натрия и гидро- карбонат-ионов, можно вывести уравнение для определения оптимального избытка ионов аммония к хлорид-ионам в маточной жидкости колонн карбонизации
(н.д.):
[NH4+] - [Cl-] = 2[П.Т.] - [CO2] = [CO32-]. |
(12. 7) |
Анализируя уравнение (12. 7), приходим к выводу о том, что весь необходимый избыток ионов аммония идет на образование карбоната аммония в насыщенном растворе.
Таким образом, изучение растворимости в четверной взаимной системе Nа+, NН4+ // НСО3-, Cl- - H2O при 15, 20, 25 и 30°С, определение содержания кар- бонат-ионов в насыщенных растворах оконтуривающих систем, на линиях моновариантного равновесия и эвтонических растворах системы показало, что в изученном интервале температур система не имеет стабильной диагонали.
152
Оказалось, что исторически сложившаяся традиция вычисления содержания гидрокарбонат-ионов по прямому титру приводит к грубому искажению диаграммы состава и неверным выводам. Предложен новый способ построения безводной проекции, который не искажает типа изотермы растворимости и не изменяет вычисленного значения коэффициента использования ионов натрия раствора, снятого с диаграммы после проецирования.
Выведены уравнения изолиний коэффициента использования ионов натрия для четверной взаимной системы. Совместное изображение изолиний использования ионов натрия и безводной проекции взаимной системы позволяет легко увидеть составы насыщенных растворов с максимальным коэффициентом использования ионов натрия, которые и должны быть получены при синтезе гидрокарбоната натрия из хлорида натрия, аммиака и диоксида углерода.
Обнаружено, что насыщенные растворы, полученные при термостатировании исходных реакционных смесей в токе диоксида углерода на лабораторной установке, имеют практически такую же степень карбонизации, что и маточная жидкость карбонизационных колонн, и могут быть использованы для моделирования производственных процессов.
Вычислено, что маточные растворы, получаемые из рассола хлорида натрия промышленных концентраций, являются насыщенными относительно гидрокарбонатов натрия и аммония, если содержание ионов аммония превышает содержание ионов хлора.
Найдено, что отношение концентраций ионов натрия к гидрокарбонатионам является очень значимым параметром процесса карбонизации, стремящимся к единице при улучшении условий синтеза гидрокарбоната натрия.
13. ИССЛЕДОВАНИЕ РАСТВОРИМОСТИ В ПЯТЕРНОЙ ВЗАИМНОЙ СИСТЕМЕ Na+, NH4+, (C2H5)2NH2+ // HCO3-, Cl- – H2O ПРИ 25°С
13. 1. Теоретический анализ
Процесс получения гидрокарбоната натрия из хлорида натрия, диэтиламина, аммиака и углекислого газа при стехиометрическом соотношении компонентов описывается следующим уравнением:
(K+1)NaCl + NH3 + K(C2H5)2NH + (K+1)CO2 + (K+1)H2O → (K+1)NaHCO3 + +K(C2H5)2NH2Cl + NH4Cl, (13. 1)
где К - мольное отношение диэтиламина и аммиака в исходной реакционной смеси.
Диэтиламин, аммиак или оба эти реагента могут быть взяты в избытке или недостатке по отношению к хлориду натрия, тогда в результате проведения процесса карбонизации в маточном растворе кроме продуктов реакции (13. 1) будут содержаться гидрокарбонаты диэтиламмония и аммония или избыток хлорида натрия. Выбор оптимальных концентрационных условий получения гидрокарбоната натрия возможен только на основании изучения растворимости солей в соответствующей многокомпонентной системе.
153
Исходные вещества и продукты реакции (13.1) в идеале образуют следующую пятерную взаимную систему: Na+, NH4+, (C2H5)2NH2+ // HCO3-, Cl- – H2O. Но в результате протекания в системе процесса декарбонизации в составах насыщенных растворов присутствуют карбонат-ионы. Возникает вопрос, с какими катионами связать карбонат-ионы при вычислении составов насыщенных растворов, выраженных в солях? Для корректного ответа на этот вопрос нужно провести
триангуляцию шестерной взаимной водно-солевой системы Na+, NH4+, (C2H5)2NH2+ // HCO3-, CO32-, Cl- – H2O.
Шестерная взаимная водно-солевая система Na+, NH4+, (C2H5)2NH2+ //
HCO3-, Cl- – H2O содержит шесть оконтуривающих пятерных взаимных систем: Na+, (C2H5)2NH2+ // HCO3-, CO32-, Cl- – H2O;
Na+, NH4+ // HCO3-, CO32-, Cl- – H2O;
NH4+, (C2H5)2NH2+ // HCO3-, CO32-, Cl- – H2O; Na+, NH4+, (C2H5)2NH2+ // HCO3-, Cl- – H2O; Na+, NH4+, (C2H5)2NH2+ // CO32-, Cl- – H2O; Na+, NH4+, (C2H5)2NH2+ // HCO3-, CO32- – H2O;
шесть простых четверных систем:
Na+, NH4+, (C2H5)2NH2+ // HCO3- – H2O; Na+, NH4+, (C2H5)2NH2+ // CO32- – H2O; Na+, NH4+, (C2H5)2NH2+ // Cl- – H2O; Na+ // HCO3-, CO32-, Cl- – H2O;
NH4+ // HCO3-, CO32-, Cl- – H2O; (C2H5)2NH2+ // HCO3-, CO32-, Cl- – H2O.
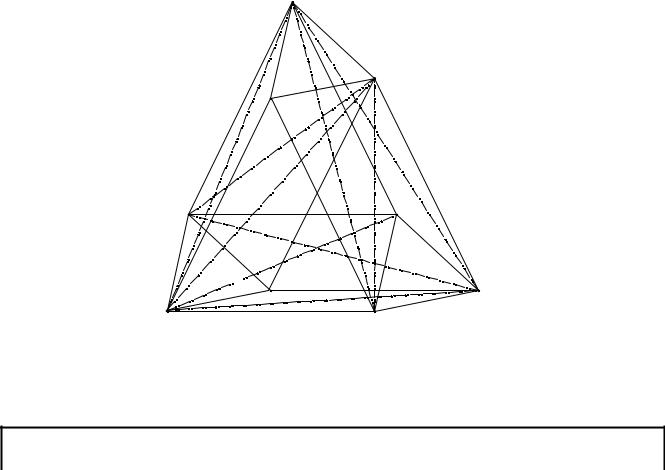
Солевая часть системы может быть изображена в виде призматического гексаэдроида, имеющего соответствующее количество вершин, сторон, граней и т.д. (см. рис. 13. 1).
Для проведения триангуляции необходимо знать стабильные пары солей во всех оконтуривающих четверных взаимных водно-солевых системах. В экспериментальном исследовании всех этих систем необходимости нет. Достаточно вычислить произведение растворимости диагональных пар солей. Пара с наименьшим произведением растворимости и образует стабильную пару солей.
При определении произведения растворимости должны учитываться стехиометрические коэффициенты уравнения реакции, связывающей взаимную солевую пару. Величины растворимости солей, выраженные в молях, должны возводиться в степень, показатель которой равен числу ионов, образующихся из данного числа молей соли, участвующего в реакции.
Данные о растворимости всех солей (моль соли/кг насыщенного раствора) при 25°С приведены в табл. 13. 1.
Ниже приведены уравнения реакций, связывающие взаимные солевые пары системы, а также вычисленные значения произведения растворимости. Уравнения записаны таким образом, что слева находится нестабильная солевая пара, а справа - стабильная.
154
[Et2NH2]2CO3
Et2NH2Cl
Et2NH2HCO3
Na2CO3 |
(NH4)2CO3 |
NaCl |
NH4Cl |
NaHCO3 |
NH4HCO3 |
Рис. 13. 1. Солевая часть шестерной взаимной водно-солевой системы
Na+, NH4+, (C2H5)2NH2+ // HCO3-, CO32-, Cl- – H2O
Таблица 13. 1
Растворимость солей в воде при 25°С
Содержание соли в насыщенном растворе, моль/кг
NaCl |
Et2NH2Cl |
NH4Cl |
NaHCO3 |
Et2NH2HCO3 |
NH4HCO3 |
Na2CO3 |
[Et2NH2]2CO3 |
(NH4)2CO3 |
||
4.51 |
6.37 |
5.27 |
|
1.09 |
|
4.78 |
2.53 |
2.14 |
4.05 |
6.00 |
|
NaCl + [(C2H5)2NH2]HCO3 = NaHCO3 + [(C2H5)2NH2]Cl |
|
||||||||
|
4.51·4.78=21.56 |
|
1.09·6.37=6.94, |
|
|
|
||||
|
NaCl + NH4HCO3 = NaHCO3 + NH4Cl |
|
|
|
||||||
|
4.51·2.53= 11.4103 |
1.09·5.27=5.74, |
|
|
|
|||||
|
2NaCl + [(C2H5)2NH2]2CO3 = Na2CO3 + 2[(C2H5)2NH2]Cl |
|
||||||||
|
4.514 ·4.053 = 27483.4 |
2.143·6.374 =16136.1, |
|
|
||||||
|
2NaCl + (NH4)2CO3 = Na2CO3 + 2NH4Cl |
|
|
|
||||||
|
4.514·6.003 = 89363 |
2.143·5.274 = 7559, |
|
|
|
|||||
|
2[(C2H5)2NH2]HCO3 + (NH4)2CO3 = 2NH4HCO3 + [(C2H5)2NH2]2CO3 |
|||||||||
|
4.784·6.003= 112763 |
|
|
2.534·4.053= 2721.7, |
|
|||||
|
2[(C2H5)2NH2]HCO3 + Na2CO3 = 2NaHCO3 + [(C2H5)2NH2]2CO3 |
|
||||||||
|
4.784·2.143= 5116 |
1.094·4.053= 93.8, |
|
|
||||||
|
Na2CO3 + 2NH4HCO3 = (NH4)2CO3 + 2NaHCO3 |
|
|
|||||||
|
2.143·2.534 = 401.5 |
6.003·1.094 |
= 304.9, |
|
|
|
||||
|
NH4Cl + (C2H5)2NH2HCO3 = (C2H5)2NH2Cl + NH4HCO3 |
|
||||||||
|
5.27·4.78 = 25.2 |
|
6.37·2.53 = 16.1, |
|
|
|||||
|
(NH4)2CO3 + 2(C2H5)2NH2Cl = 2NH4Cl +[(C2H5)2NH2]2CO3 |
|
||||||||
|
6.003·6.374 = 355641 |
5.274·4.053 = 51240. |
|
|
||||||
Определение стабильных пар солей (на рис. 13. 1 они соединены штрих-
155
пунктирными линиями) позволило триангулировать шестерную взаимную систе-
му Na+, NH4+, (C2H5)2NH2+ // HCO3-, CO32-, Cl- – H2O на шесть простых шестерных систем:
1. NaHCO3 - NaCl - NH4Cl - (C2H5)2NH2ClNa2CO3- H2O;
2. NaHCO3 - NH4Cl - NH4HCO3- (C2H5)2NH2Cl - [(C2H5)2NH2]2CO3- H2O;
3. NaHCO3 - NH4HCO3- (C2H5)2NH2Cl- (C2H5)2NH2HCO3- [(C2H5)2NH2]2CO3- H2O; 4. NaHCO3 - NH4Cl - (C2H5)2NH2Cl - [(C2H5)2NH2]2CO3- Na2CO3-H2O;
5. NaHCO3 - NH4Cl - NH4HCO3- (NH4)2CO3- [(C2H5)2NH2]2CO3- H2O; 6. NaHCO3 - NH4Cl - (NH4)2CO3- [(C2H5)2NH2]2CO3- Na2CO3- H2O.
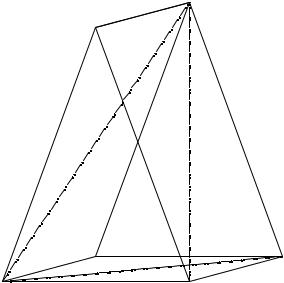
Исследуемая пятерная взаимная система Na+, NH4+, (C2H5)2NH2+ // HCO3-, Cl- – H2O триангулируется при 25°С на три простые пятерные системы (солевая призма системы приведена на рис 13. 2, стабильные пары солей на рис. 13. 2 также соединены штрихпунктирными линиями):
1.NaCl - (C2H5)2NH2Cl - NH4Cl - NaHCO3 - H2O;
2.NaHCO3 - NH4HCO3 - NH4Cl - (C2H5)2NH2Cl - H2O;
3.NaHCO3 - NH4HCO3 -(C2H5)2NH2Cl - (C2H5)2NH2HCO3 - H2O.
Первая простая пятерная система входит в состав первой простой шестерной системы, пятым солевым компонентом в ней является карбонат натрия, на эту соль необходимо пересчитывать карбонат-ионы в составах насыщенных растворов данной пятерной системы, когда в них имеется избыток хлорида натрия.
Вторая и третья пятерные системы входят в состав второй и третьей шестерных систем, пятым солевым компонентом в них является карбонат диэтиламмония, на эту соль необходимо пересчитывать карбонат-ионы в составах насыщенных растворов данных пятерных систем.
При графическом представлении экспериментальных данных возникает проблема, заключающаяся в том, что в составах насыщенных растворов содержатся компоненты, образующиеся в результате процесса декарбонизации, которых нет на фигуре состава. Для решения этой проблемы также использован комбинированный вариант построения проекций. По отношению к карбонатам аммония и диэтиламмония применено перспективное проецирование. Примесь карбоната натрия пересчитана на эквивалентное количество гидрокарбоната натрия. При таком подходе не изменились тип водно-солевой системы и коэффициент использования ионов натрия проецированного состава раствора.
Кроме того, для наглядности на проекциях изотерм растворимости отображено штрихами содержание примесных компонентов в составах насыщенных растворов.
Графическое представление изоплоскостей и изолиний коэффициента использования ионов натрия на изотерме растворимости пятерной взаимной системы и на ее разрезах позволяет лучше сочетать интересы теории и практики.
Для вывода зависимости коэффициента использования ионов натрия (UNa+) от состава пятерной взаимной системы также воспользуемся формулой Федотьева (11. 3):
UNa+(%) = ([Cl-] - [Nа+])·100/[Cl-].
156
Et2NH2·Cl
Et2NH2·HCO3
NaCl |
NH4Cl |
NaHCO3 |
NH4HCO3 |
Рис. 13. 2. Солевая призма пятерной взаимной системы
Na+, NH4+, (C2H5)2NH2+ // HCO3-, Cl- – H2O
В пятерной системе NaCl - (C2H5)2NH2Cl - NH4Cl - NaHCO3 - H2O общее содержание ионов хлора равно сумме молярных концентраций хлоридов натрия, аммония и диэтиламмония, а концентрация ионов натрия равна молярной концентрации гидрокарбоната натрия в насыщенном растворе. В формуле для определения коэффициента использования ионов натрия концентрации ионов выразим через мольное содержание компонентов:
U Na+ (%) = |
[NaCl]+[NH4 Cl]+[Et2 NH2 Cl]−[NaCl] |
100 . |
(13. 2) |
||
[NaCl]+[NH4 Cl]+[Et2 NH2 Cl] |
|
||||
|
|
|
|||
Учитывая, что [NaCl]+[NH4Cl]+[Et2NH2Cl] = 100-[NaHCO3], из (13. 2) по-
лучаем
[NH4Cl] + [Et2NH2Cl] + |
U Na+ −100 |
[NaHCO3] - U |
|
+ = 0. |
(13. 3) |
|
100 |
Na |
|||||
|
|
|
|
Выражение (13. 3) является уравнением плоскости для каждого значения коэффициента использования ионов натрия в объеме солевой пирамиды. Для по-
строения изоплоскостей использования ионов натрия достаточно трех точек на различных ребрах солевой пирамиды, исключая ребро NаСl - NаНСО3, на котором не могут получаться составы в результате обменной реакции между нестабильными солевыми компонентами.
Результатом пересечения изоплоскостей коэффициента использования ионов натрия боковых граней солевой пирамиды состава являются прямые линии - изолинии коэффициента использования ионов натрия в четверных оконтуривающих системах.
Для системы NaCl - NH4Cl - NaHCO3 - H2O ([Et2NH2Cl]=0) из (13. 3) полу-
чается следующее выражение для изолиний коэффициента использования ионов
157 |
|
натрия, выведенное нами ранее в разделе 12. 1: |
|
[NaHCO3] = 100·[NH4Cl]/(100-UNa+) - (100·UNa+)/(100 - UNa+). |
(12. 4) |
В системе NaCl - (C2H5)2NH2Cl - NaHCO3 - H2O ([NH4Cl]=0) уравнение изо-
линий коэффициента использования ионов натрия имеет вид
[NaHCO3] = 100·[Et2NH2Cl]/(100-UNa+) - (100·UNa+)/(100-UNa+). |
(13. |
4) |
Для системы NaCl - (C2H5)2NH2Cl - NH4Cl - H2O из (13. 3) получаем |
|
|
[NH4Cl] = UNa+ - [Et2NH2Cl]. |
(13. |
5) |
Выражение (13.5) является также уравнением прямой линии для каждого значения коэффициента использования ионов натрия, проходящей параллельно стороне (C2H5)2NH2Cl - NH4Cl солевого треугольника состава.
Для системы (C2H5)2NH2Cl - NH4Cl - NaHCO3 - H2O, наиболее интересной с технологической точки зрения, при выводе уравнений для изолиний коэффициента использования ионов натрия из (13. 3) учитываем, что [NaCl] = 0 и [NH4Cl] = =100 - [Et2NH2Cl] - [NaHCO3]:
[NaHCO3] = 100( UNa+ - 100)/ ( UNa+ - 200). |
(13. 6) |
Выражение (13. 6) представляет собой уравнение прямой линии для каждого значения коэффициента использования ионов натрия, проходящей параллельно стороне солевого треугольника состава (C2H5)2NH2Cl - NH4Cl. Причем нулевая линия коэффициента использования ионов натрия проходит через точки эквимолярных соотношений на сторонах NH4Cl - NaHCO3 и (C2H5)2NH2Cl - NaHCO3 солевого треугольника состава.
В пятерной системе (C2H5)2NH2Cl - NH4Cl - NaHCO3 - NH4HCO3 - H2O кон-
центрация хлорид-ионов равна молярной концентрации хлорида диэтиламмония, концентрация ионов натрия равна молярной концентрации гидрокарбоната натрия. Из (11. 3) получаем
|
100 - UNa+ |
[NH4Cl] + |
100 - UNa+ |
[Et2NH2Cl] - [NaHCO3] = 0. |
(13. 7) |
|
100 |
100 |
|||||
|
|
|
||||
Выражение (13. 7) является уравнением плоскости для каждого значения коэффициента использования ионов натрия. Следами пересечения изоплоскостей коэффициента использования ионов натрия с боковыми гранями солевой пирамиды состава являются прямые линии - изолинии коэффициента использования ионов натрия в четверных оконтуривающих системах.
В системе NH4Cl - NaHCO3 - NH4HCO3 - H2O ([Et2NH2Cl] = 0) уравнение изолиний коэффициента использования ионов натрия имеет вид, выведенный в
разделе 12. 1: |
|
[NaHCO3]= [NH4Cl]·(100 - UNa+)/100. |
(12. 2) |
Учитывая, что [NaHCO3] = 0, в системе (C2H5)2NH2Cl-NH4Cl-NH4HCO3- H2O из (13. 7) получаем
|
|
158 |
|
|
|
100 - U Na+ |
([NH4Cl] + [Et2NH2Cl]) = 0. |
(13. 8) |
|
100 |
||||
|
|
|||
Уравнение (13. 8) имеет корни, когда UNa+ = 100 (любые значения мольных
концентраций солей) или когда [NH4Cl] + [Et2NH2Cl] = 0 (вершина, отвечающая составу гидрокарбоната аммония). Другими словами, данная система является плоскостью 100 %-ной утилизации ионов натрия.
В системе (C2H5)2NH2Cl - NH4Cl - NaHCO3 - H2O из (13. 7) получаем
[NaHCO3] = 100( UNa+ - 100)/ ( UNa+ - 200). |
(13. 9) |
Уравнения (13. 3) и (13. 7) в пограничной системе NH4Cl - (C2H5)2NH2Cl - -NaHCO3 - H2O идентичны.
Учитывая, что в системе (C2H5)2NH2Cl - NaHCO3 - NH4HCO3 - H2O [NH4Cl]=0, из (13. 7) получаем
[NaHCO3] = |
100 - U Na+ |
[Et2NH2Cl]. |
(13. |
|
100 |
||||
|
|
10) |
||
|
|
|
Выражение (13. 10) представляет собой уравнение прямой линии для каждого значения коэффициента использования ионов натрия, исходящей из вершины солевого треугольника состава, отвечающей составу гидрокарбоната аммония,
на сторону (C2H5)2NH2Cl - NaHCO3, от вершины (C2H5)2NH2Cl ( UNa+ = 100) до точ-
ки эквимолярного соотношения гидрокарбоната натрия и хлорида диэтиламмония
( UNa+ = 0).
В пятерной системе (C2H5)2NH2Cl-NaHCO3-(C2H5)2NH2HCO3-NH4HCO3- H2O концентрация хлорид-ионов равна сумме молярных концентраций хлоридов аммония и диэтиламмония, концентрация ионов натрия равна молярной концентрации гидрокарбоната натрия. Из (13. 1) получаем
|
100 - U Na+ |
[Et2NH2Cl] - [NaHCO3] = 0. |
(13. 11) |
|
100 |
||||
|
|
|||
Выражение (13. 11) является уравнением плоскости для каждого значения коэффициента использования ионов натрия, исходящей из стороны NH4HCO3 - (C2H5)2NH2HCO3 солевой пирамиды состава в точку на стороне (C2H5)2NH2Cl - NaHCO3, начиная от вершины (C2H5)2NH2Cl, отвечающей 100 %-ной утилизации ионов натрия, и заканчивая точкой эквимолярных соотношений хлорида диэтиламмония и гидрокарбоната натрия, соответствующей нулевой утилизации ионов натрия. Следами пересечения изоплоскостей коэффициента использования ионов натрия с единственной боковой гранью солевой пирамиды состава (C2H5)2NH2Cl - NaHCO3 - NH4HCO3 - H2O являются прямые линии - изолинии коэффициента использования ионов натрия.
Учитывая, что в системе (C2H5)2NH2Cl - NaHCO3 - NH4HCO3 - H2O
159
[NH4Cl]=0, из (13. 11) получаем выражение, тождественное (13. 10):
[NaHCO3] = |
100 - UNa+ |
[Et2NH2Cl]. |
(13. 12) |
|
100 |
||||
|
|
|
Выражение (13. 12) представляет собой уравнение прямой линии для каждого значения коэффициента использования ионов натрия, исходящей из вершины солевого треугольника состава, отвечающей составу гидрокарбоната аммония,
на сторону (C2H5)2NH2Cl - NaHCO3, от вершины (C2H5)2NH2Cl ( UNa+ = 100) до точки эквимолярного соотношения гидрокарбоната натрия и хлорида диэтилам-
мония ( UNa+ = 0).
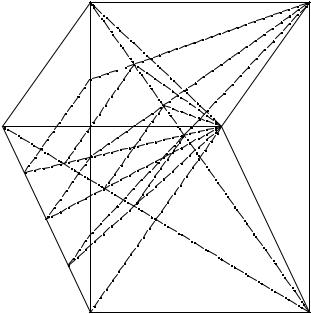
Положение изоплоскостей коэффициента использования ионов натрия в солевой призме исследуемой пятерной взаимной системы представлено на рис. 13. 3.
|
|
UNa+ |
|
|
|
Et2NH2Cl |
100 |
Et NH HCO |
|
||
|
3 |
||||
|
|
|
2 |
2 |
|
|
|
75 |
|
|
|
|
|
75 |
|
|
|
UNa+ |
|
|
50 |
|
|
NH Cl 100 |
|
|
|
|
|
|
|
NH4HCO3 |
|
|
|
4 |
|
50 |
25 |
|
|
|
|
|
|
||
75 |
75 |
|
0 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
50 |
|
|
|
|
50 |
25 |
25 |
|
|
|
0 |
|
|
||
|
25 |
|
|
|
|
|
NaCl |
0 |
NaHCO3 |
|
|
Рис. 13. 3. Изоплоскости коэффициента использования ионов натрия
всолевой призме состава пятерной взаимной системы
Na+, NH4+, (C2H5)2NH2+ // HCO3-, Cl- – H2O (% мол.)
Совместное изображение изотерм растворимости и сетки изолиний или изоплоскостей коэффициента использования ионов натрия позволяет легко графически определить солевые составы насыщенных растворов с максимальным выходом гидрокарбоната натрия в кристаллическом виде и показывает часть пятерной взаимной системы, в которой могут получаться составы насыщенных растворов из исходных компонентов.
13. 2. Методика изучения растворимости
Поскольку в процессе насыщения гидрокарбонаты натрия, аммония и диэтиламмония в растворе подвергаются частичной декарбонизации, опыты произ-
160
водили в токе диоксида углерода. Исходную навеску помещали в сосуд, снабженный термостатируемой рубашкой, механической мешалкой и приспособлением для барботирования диоксида углерода.
Сцелью наиболее быстрого установления равновесия (2 - 3 часа) компоненты исходной реакционной смеси, представляющие собой продукты реакции и одно или несколько исходных веществ, смешивали в следующей последовательности при включенном потоке диоксида углерода: сначала вода и наименее растворимый компонент (гидрокарбонат натрия) термостатировались при перемешивании в сосуде в течение 3-5 минут, затем добавляли необходимое количество диэтиламина и термостатировали до постоянного значения рН и выделения в осадок гидрокарбоната диэтиламина, далее прибавляли в исходную реакционную смесь гидрокарбонат и карбонат аммония и снова термостатировали до постоянного значения рН, самым последним добавляли хлорид диэтиламмония и далее смесь термостатировали до полного установления равновесия.
Установление равновесия определяли по постоянству трех измерений показателя преломления насыщенного раствора, производимых через 30 минут. Измерения начинали производить после полутора часов от начала опыта. После установления равновесия перемешивание прекращали, давали раствору осветлиться
иотбирали калиброванной пипеткой образцы жидкой фазы на анализ в мерные колбы с дистиллированной водой.
Сцелью уменьшения затрат времени на определение составов эвтонических растворов, линий моновариантных равновесий на изотермах четверной взаимной системы проводили планирование эксперимента.
При вычислениях составов исследуемых жидких фаз использовали уравнение ионного баланса для определения содержания ионов диэтиламмония.
13.3. Пятерная система NaCl-(C2H5)2NH2Cl-NH4Cl-NaHCO3-H2O
Данная пятерная система имеет следующие оконтуривающие четверные системы:
NaCl-NH4Cl-NaHCO3-H2O; NaCl-(C2H5)2NH2Cl-NaHCO3-H2O;
NaCl-(C2H5)2NH2Cl-NH4Cl-H2O; (C2H5)2NH2Cl-NH4Cl-NaHCO3-H2O.
Системы 1 и 2 описаны выше (см. разд. 12. 4 и 11. 4 соответственно). Данных о растворимости в двух других системах в доступных нам литературных источниках не обнаружено. Изотермы растворимости систем 3 и 4 изучались экспериментально.
13. 3. 1. Система NaCl - (C2H5)2NH2Cl - NH4Cl - H2O (3)
Изотерма растворимости тройной оконтуривающей системы NaCl - NH4Cl - H2O хорошо изучена и описана в литературе. Данные, полученные экспериментально, о растворимости в двух других тройных оконтуривающих системах
(C2H5)2NH2Cl - NH4Cl - H2O и NaCl - (C2H5)2NH2Cl - H2O сведены соответственно в табл. 13. 2 и 13. 3, изображены на рис.13. 4 и 13. 5.
Таблица 13. 2
